第二章 化学反应的一般原理资料
第二章 化学反应的一般原理

第二章化学反应的一般原理(The General Principle of Chemical Reaction)学习要求1.理解反应进度ξ、系统与环境、状态与状态函数的概念;2.掌握热与功的概念和计算,掌握热力学第一定律的概念;3.掌握Q p、∆U、∆r H m、∆r H m、∆f H m、∆r S m、∆r S m、S m、∆r G m、∆r G m、∆f G m的概念及有关计算和应用;4.掌握标准平衡常数K 的概念及表达式的书写;掌握∆r G m与K 的关系及有关计算;5.了解反应速率、基元反应、反应级数的概念;理解活化分子、活化能、催化剂的概念;了解影响反应速率的因素及其应用。
在化学反应的研究中,常涉及到化学反应进行的方向、程度以及反应过程中的能量变化关系和化学反应进行的快慢即化学反应的速率两个问题。
一个化学反应从始态到终态能否发生,反应的完全程度如何,是吸热反应还是放热反应等等,属于化学热力学的研究范畴;而化学反应的速率,反应从始态到终态所经历的途径即化学反应机理等问题则属于化学动力学的研究范畴。
人们总是希望有利的反应进行得快一点、完全一点;而不利的反应进行得慢一点、或尽可能抑制它的进行。
这就必须研究化学热力学和化学动力学的问题。
本章通过化学热力学、化学动力学的一般原理介绍,引出化学反应的焓变、熵变和吉布斯函数变的概念及其与平衡常数的关系,反应速率方程、反应级数、活化能等的概念及有关的计算。
无机及分析化学2.1 基本概念和术语2.1.1 化学反应进度1.化学反应计量方程式在化学中,满足质量守恒定律的化学反应方程式称为化学反应计量方程式。
在化学反应计量方程式中,用规定的化学符号①和相应的化学式将反应物(reactant)与生成物(product)联系起来。
例如,对任一已配平的化学反应方程式,质量守恒定律可用下式表示:0 = B BB ∑ν (2-1) 式中B 为化学反应方程式中任一反应物或生成物的化学式,称物质B ;νB 为物质B 的化学计量数(stoichiometric number)(当B 为具体的物质时也可表示在圆括号内,如ν(NH 3)),是出现在化学反应方程式(2-1)式中的物质B 的化学式前的系数(整数或简分数),是化学反应方程式特有的物理量,其量纲为一,单位为1①。
化学反应的一般原理-精选

状态函数的变化只取决于终 始态而与途径无关
五、功和热
热和功是系统状态发生变化时与环境之间的两种 能量交换形式,单位均为J或kJ。
热 系统与环境之间因存在温度差异而发生的能 量交换形式称为热,用Q来表示
功 系统怀环境之间无物质交换时,除热以外的 其他各种能量交换形式称为功,用W来表示
热效应中规定只做体积功,W=-pV 而此时, V=0,因此,W=-pV=0 此时系统的热力学能变为:
U=QV
上式说明, 恒容过程中系统的热量变化全部用来 改变系统的热力学内能。
U和QV都为正值,表示反应吸热;U和QV都为 负值,表示反应放热;
2. 恒压反应热
在等温条件下,若系统发生化学反应是恒压且 只做体积功不做非体积功的过程,则该过程中与环 境之间交换的热就是恒压反应热,其量符号为“Qp”
热力学中对W和Q的符号的规定如下:
(1) 系统向环境吸热,Q取正值(Q>0,系统能量升高)
系统向环境放热,Q取负值(Q<0,系统能量下降)
(2) 环境对系统做功,功取正值(W>0,系统能量升高)
系统对环境做功,功取负值(W<0,系统能量降低)
热力学中把系统反抗外压而体积变化时所做的功
称为体积功或膨胀功(或无用功),用-pV表示;除
状态变则状态函数随之改变。 (2)状态函数变化只与系统的终始态
有关,而与变化的具体途径无关。
“状态函数有特征,状态一定值一定, P V n T均为状态函数 殊途同归变化等,周而复始变化零”
例如,水的状态一定时,水的温度是定值,所 以,T是一个状态函数。如状态1变为状态2 时,T=308-298=10 K
无机化学各章节第2章 化学反应的基本原理知识点

第二章 化学反应的基本原理知识点一、基本概念:体系和环境;状态和状态函数;过程和途径;热与功;相;化学计量数与反应进度;焓;熵;吉布斯自由能。
① 状态函数的特征:状态一定值一定,途殊回归变化等,周而复始变化零。
② 热和功(非状态函数)符号:体系吸热 Q 为+ 体系放热 Q 为— 体系做功 W 为— 环境做功 W 为+ 体积功 : W=-P 外·ΔV ③ 化学计量数与反应进度:N 2 (g) + 3 H 2 (g) = 2 NH 3 (g)化学计量数 ν(N 2)= -1 ν(H 2) =-3 ν(NH 3) = 2 反应进度1mol :表示1mol N 2与3mol H 2作用生成2mol NH 312N 2 (g) + 32H 2 (g) = NH 3 (g) 化学计量数:ν(N 2)=-12 ν(H 2)=-32 ν(NH 3) = 1反应进度1mol :表示12mol N 2与32mol H 2作用生成1mol NH 3④ 熵:S(g)>S(l)>S(s) ; S (复杂)> S(简单) ; 气体:S(高温) > S (低温); S(低压) > S (高压); 固~液相溶,S 增大; 晶体析出,S 减小;气~液相溶,S 减小; 固体吸附气体,S 减小; 气体等温膨胀,S 增大 二、盖斯定律总反应的反应热等于各分反应的反应热之和。
若反应①+反应②→反应③,则()()()312r mr m r m H H H θθθ∆=∆+∆若反应①×2—反应②→反应③,则()()()3212r mr m r m H H H θθθ∆=∆-∆三、热力学第一定律:U Q W ∆=+ 四、化学反应的方向(298.15)()r m B f m BH k H B θθν∆=∆∑(298.15)()r m B m BS k S B θθν∆=∑(298.15)()r m B f m BG k G B θθν∆=∆∑(注:指定单质通常为稳定单质的()0f m H B θ∆=,()0f m G B θ∆=()()()()T (298k)T 298r m r m r m r m r m G T H T S T H S K θθθθθ∆=∆-∆≈∆-∆ 反应在标准状态下进行:若()0r mG T θ∆<,则反应正向自发进行;若()0r m G T θ∆=,则反应处于平衡状态;若()0r m G T θ∆>,则反应逆向自发进行。
第二章 化学反应的一般原理

例
aA bB gG dD 若发生了 1mol 反应进度的反应,则 ΔnA ΔnB ΔnG ΔnD ξ 1mol νA νB νG νD
表明:每消耗掉a mol物质A的同时,也消耗掉b mol 的物质B,并生成g mol的物质G和d mol物质D
无机及分析化学 第二章 11
在隔离系统中,能的形式可以相互转化,但
不会凭空产生,也不会自行消失。若把隔离系
统分成系统与环境两部分,系统热力学能的改
变值U等于系统与环境之间的能量传递。
ΔU (Q W) 0
ΔU Q W
无机及分析化学 第二章 22
例:某过程中,系统从 环境吸收200kJ的 热,对环境做功 120kJ, 求该过程中系统的热力学 能变和环境的热力学 能变。
2
ν(H2 ) 3
如反应: 1 N 2 3 H 2 NH 3 其化学计量数分别为:
ν(NH 3 ) 1 1 ν(N 2 ) 2
无机及分析化学 第二章
3 ν(H 2 ) 2
8
2. 化学反应进度 [ksi]
表示化学反应进行的程度的物理量,单位mol。
定义式
dξ νB dnB
c. 反应进度与化学反应计量方程式的写法有关
如
N2 3H2 2NH3
Δn(NH 3 ) 1 ξ 0.5mol ν(NH 3 ) 2
当 Δn(NH 3 ) 1mol 时
1 3 N 2 H 2 NH 3 2 2
当 Δn(NH 3 ) 1mol 时
Δn(NH 3 ) 1 ξ 1mol ν(NH 3 ) 1
例 450g水蒸汽在101.3kPa 和373.15K 下凝结成水, 已知水 的蒸发热为 2.26kJ g 1, 试计算此过程的 、 ΔH和ΔU。 W
普通化学第二章 化学反应的基本原理

本章内容
2.1 化学反应的方向和吉布斯函数 2.2 化学反应的限度和化学平衡 2.3 化学反应速率
3
2.1 化学反应的方向和吉布斯函数
一、自发过程( spontaneous process)
无须施加任何外力就能自动发生的过程叫自发过程。
T2 > T1 Q
P2 > P1 气体
自发过程的共同特征:
p c
)d )b
24
例1.
MnO2(s) + 4H+(aq) + 2Cl-(aq) → Mn2+(aq) + Cl2(g) + 2H2O (l)
ΔrGm=ΔrGm+ RTlnQ =ΔrGm+RTln —{{cc—((MH—n+)2—/+c)—/c}4}—{{c—p(C(C—l-l)2—/)c/p—}2}
3. 反应的吉布斯函数变
既然熵作为自发反应方向判据的一个前提 条件是体系必须是一个孤立体系,而一般的化 学反应都不是在孤立体系中进行的,计算体系 和环境的总的熵变也是非常困难的,故实际情 况中,以熵变作为判据并不方便。
前已述及:自发的过程,其内在的推动因 素有两个方面:其一是能量的因素,其二还有
混乱度即熵的因素。ΔH 仅考虑了能量的因素, 不可作为判据,而ΔS 仅考虑了混乱度的因素,
Pθ=100 kPa
rGm
(T
)
r
G
m
(T
)
RT ln
( pB / P ) B
B
Q (PG P ) g (PD P )d (PA P )a (PB P )b
Q称为反应商
ΔG=ΔGθ+ RTlnQ 该式称为热力学等温方程
第二章 化学反应的一般原理
∑ 对各物种 加和。 对各物种B加和 加和。
B
Байду номын сангаас
§2.1 基本概念
2. 化学反应进度ξ 化学反应进度ξ 化学反应进度ξ[ksai]是表示化学反应进行的程度的一个物理量 是表示化学反应进行的程度的一个物理量, 化学反应进度ξ[ksai]是表示化学反应进行的程度的一个物理量, 单位为mol。 单位为mol。 mol 定义:dξ= vB-1dnB 定义: 物质B的物质的量; nB :物质B的物质的量; 物质B的化学计量数; vB :物质B的化学计量数; 积分式: 积分式:ξ= vB-1ΔnB 或 或 dnB = vBdξ
反应过程若非恒温恒压,也有 但此时∆H ≠Qp 反应过程若非恒温恒压,也有∆H ,但此时
§2.2 热化学
∆ rUm与∆rHm 的关系
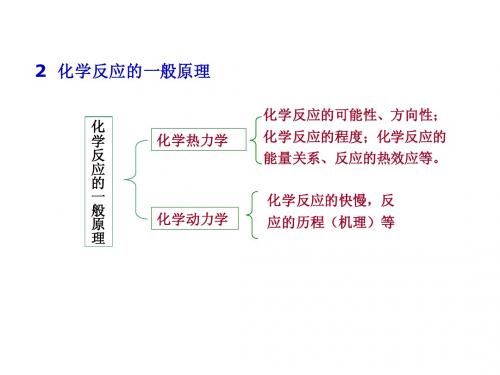
2 化学反应的一般原理
化 学 反 应 的 一 般 原 理 化学 力学 化学热力学 化学反应的可能性、方向性; 化学反应的可能性、方向性; 化学反应的程度; 化学反应的程度;化学反应的 能量关系、反应的热效应等。 能量关系、反应的热效应等。 化学反应的 应的 程 反 理 等
§2.1 基本概念
2.1.1 化学反应进度 1. 化学计量数 B 化学计量数v 对任一已配平的化学反应方程式, 对任一已配平的化学反应方程式,按国家法定计量单位可表示为
§2.2 热化学
由热力学第一定律得: 由热力学第一定律得:
U 2 − U1 = Q p − pex (V2 − V1 )
U 2 − U1 = Q p − ( p2V2 − p1V1 )
Q p = (U 2 + p2V2 ) − (U1 + p1V1 )
状态函数 Qp = ∆ H
大学化学:第二章 化学反应的基本原理
§2-1 §2-2 §2-3 §2-4
熵与熵变 吉布斯函数变 反应限度与化学平衡 化学反应速率
§2-1 熵与熵变
一、过程的可逆与不可逆性一、过程的可逆与不可逆性 从自然界中观察到的过二程、(变熵化与)都熵是增不加可原逆理的。 ➢热由高温物体传给低温三物、体熵,值直及至熵温变差的为计零算; ➢气体从高压扩散到低压,直至压差为零; ➢正电荷从高电位迁移到低电位,直至电位差为零; ➢不同种组分的相互混合、扩散(推动力?);
▪ 对于化学反应,反应物质是可逆的,且变化在无 限接平衡状态下进行时,为热力学可逆过程。
▪ 可逆过程的逆过程发生后,体系及环境都得以复 原,不留下任何变化的痕迹(包括物质的和能量的)。
二、熵与熵增加原理
1、熵与熵变 对于简单、熟悉的过程,可用诸如ΔT、 Δ p、 ΔE
等作为自发过程方向与限度的判据(推动力); 对于复杂的物理化学过程,用什么函数来判断? 已知很多放热反应是自发的,那么放热则自发?
放热并非一定自发
二、熵与熵增加原理
1、熵与熵变
S qr 定温可逆过程: S qr
T
T
对定温的任意过程: S q 不可逆 (2-1-1)
T 可逆
封闭系统的定温过程中,系统的熵变不可能小于
过程的热温商。
即封闭系统的定温可逆过程中,熵变等值于过程 热温商,不可逆中,系统的熵变大于过的热温商;
S是一个状态函数(广度性质),但宏观抽象。
生的熵变。食物(蛋白质、淀粉等)的熵小于排泄 物的熵。
“新陈代谢的最基本内容是:有机体成功地使自 身放出他活着时不得不产生的全部熵。”
3
三、熵值及熵变的计算
1、物质的规定熵与标准摩尔熵 ➢由热三律指出:规定,纯物质完美晶体,S0K=0 ➢物质的标准摩尔熵:Sθm(B,T)为单位物质的量的纯 物质标准条件下的规定熵。单位“J·K-1·mol-1”。
第2章 化学反应的一般原理(s)
d.在反应物和生成物都是固态和液态时,反应 的ΔV很小,PΔV可以忽略,故ΔH≈ΔU e.在有气体参与的反应中,PΔV=△nRT, 则 ΔH=ΔU+△nRT (△n为气体摩尔数的变化量。) △n= ng(生成物)- ng(反应物) ΔU=QV ΔH= QP 热不是状态函数,但在这两种特殊情况下, QV 、QP只与始态和终态有关,与变化的途径 无关。
系统净增了50 kJ的热力学能,而环境减少了50 kJ的 热力学能,系统与环境的总和保持能量守恒。 即 U(系统)+ U(环境)= 0
2014-2-25 20
根据热力学第一定律,系统热力学
能的改变值△U等于系统与环境间的
能量传递,即热力学第一定律的表
达式: ΔU = Q + W
★隔离系统的热力学能变ΔU=0
t 2时 nB /mol 1.5
5.5
3.0
ξ2
Δn1 N 2 (2.0 3.0)mol ξ1 1.0mol νN 2 1
Δn1 H 2 (7.0 10.0)mol ξ1 1.0mol ν H 2 3 Δn1 NH 3 (2.0 0)mol ξ1 1.0mol ν NH 3 2 ξ 2 1.5mol
22
2.2.1化学反应的热效应(反应热)
定义:系统发生化学变化时,当系统不作非 体积功,并使体系终态温度恢复到始态 温度,则在这一过程中放出或吸收的热 量称为该反应的反应热。 或:系统发生化学反应时,在只做体积功而 不做非体积功的等温过程中吸收或放出的 热量。 化学反应通常在恒容或恒压条件下进行。化学 反应热效应分为恒容反应热和恒压反应热。
反应物υ为负值,产物的υ为正值。
第2章化学反应的基本原理
3、自由能变的计算
(1) 用标准摩尔生成自由能计算 298.15K 时反应的标准摩尔吉布斯自由能变的计算 在标准状态时,由指定单质生成单位物质的量的纯物质 时反应的吉布斯函数变,叫做该物质的标准摩尔生成吉布斯 函数: f Gm,常用单位为 kJ. mol-1 。
任何指定单质(注意磷为白磷) f Gm = 0 并规定Δf Gm(H+,aq) = 0
第2章
化学反应的基本原理
2.1 化学反应的方向和吉布斯函数
2.1.1 自发过程
在给定条件下不需要外界做功、一经引发就能自动进行的 过程叫自发过程。
自发过程与非自发过程是一个互逆的过程;自发过程和非自发过程都是可 以进行的,区别就在于自发过程可以自动进行,而非自发过程则需要借助外力 才能进行,在条件变化时,自发过程与非自发过程可以发生转化。
自发过程的共同特征:
(1) 具有不可逆性——单向性 (2) 有一定的限度 (3) 可由一定的物理量来判断变化的方向和限度——判据
实例 水流 气流 电流 风 热
自发进行方向 推动力 自发条件 高水位-低水位 Δh ΔH<0 高压-低压 Δp ΔP<0 高电位-低电位 ΔE ΔE<0 高气压-低气压 Δp ΔP<0 高温-低温 ΔT ΔT<0
反应的焓变能否作为反应方向的判据?
1 (1) C(g) O 2 (g) CO 2 (g ) , r H m = 110.5 kJ mol1 2 该反应在任何温度下均可正向进行。
(2) HCl(g ) NH 3 (g) NH 4Cl(s) , r H m = 176.9 kJ mol1
吉布斯:美国物理 学家、化学家 (1839~1903),1958 年入选美国名人纪 念馆。
总结-第二章 化学反应的一般原理-完成
一、系统与环境——P27
2.1 几个基本概念
系统的分类——P28
特征
系统与环境之间有物质和 能量的交换; 系统与环境之间有能量交 换但无物质交换; 系统与环境之间既无物质 交换也无能量交换,也称 孤立系统,是一种理想状 态。
系统
敞开系统 封闭系统 隔离系统
二、状态和状态函数
●
状态函数的特点
(1) 状态一定,其值一定。 (2) 殊途同归,值变相等。 (3) 周而复始,值变为零。
四、化学反应进度(★)
1. 化学反应计量方程式
任意反应:aA + bB = cC + dD
0= – aA – bB + cC+ dD=
满足质量守恒定律的化学反 应方程式
B
B
B
B 称为B 的化学计量数(stoichiomertric number) 如:A =-a,B =-b,C =c,D =d
状态Ⅰ
U1
Q
W
状态Ⅱ
U2 数学表达式
∆U = Q+W
2.2 热化学 ——P30
一、 化学反应热效应
二、盖斯定律 三、反应焓变的计算()
1. 恒容热 QV
Q = U W = U + p V
因 V = 0
所以 Q = U
2. 恒压热(QP)和焓(H)
焓的特点 状态函数 能量单位 无绝对值 无明确物理意义
优点:与选择的反应物或生成物无关
= nA /A = nB /B = nC /C = nD /D 注意:① 单位是mol ② 与化学方程式的写法有关
1/2N2(g) + 3/2H2(g) = NH3(g) 则 = ??
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
理量;
理想气体
n=1mol p=101.3kPa V=22.4L T=273.15K
状态函数特性:状态函数的变化值(增量)只取决 于系统的始态与终态,而与变化的具体途径无关。
活化分子、活化能、催化剂的概念;了解影响反应速率的因素 及其应用。
2020/9/11
第二章 化学反应的一般原理
3
化学反应的可能性、方
化 学
化学热力学
向;化学反应的程度; 化学反应的能量关系、
反
反应的热效应等。
应
一
般
பைடு நூலகம்
原 理
化学动力学
化学反应的快慢,反 应的历程(机理)等
2020/9/11
第二章 化学反应的一般原理
当 =1mol时,称单位反应进度,意即按计量方程式进
行了一次完整反应;如反应 N2 + 3H2 = 2NH3 若
=1mol,意指1mol N2与3molH2反应生成了2molNH3 。 对任一化学反应 aA + bB = gG + dD 有
nA nB nG nD
A
B
G
D
即在表示反应进度时物质B和B可以不同,但用 不同物种表示的同一反应的不变。(显示出用来衡量
B:化学反应方程式中的反应物或生成物,称物质B;
B:物质B的化学计量数,其量纲为1,规定:
反应物的化学计量数为负值,而生成物的化学计 量数为正值。 如 N2 + 3H2 = 2NH3 即 0 = N2 3H2 + 2NH3
化学计量数 B分别为: (N2)= 1, (H2) = 3 , (NH3) = +2
2、掌握热与功的概念和计算,掌握热力学第一定律的概念; 3、掌握Qp、U、rHm、rHm、fHm、rSm、rSm、Sm、
rGm、rGm、fGm的概念及有关计算和应用; 4、掌握标准平衡常数K的概念及表达式的书写;掌握rGm与K
的关系及有关计算; 5、理解反应速率、反应级数的概念;掌握基元反应的概念;理解
第二章 化学反应的一般原理
2020/9/11
第二章 化学反应的一般原理
1
2.1 基本概念 2.2 热化学 2.3 化学反应的方向与限度 2.4 化学平衡及其移动 2.5 化学反应速率 2.6 化学反应一般原理的应用
2020/9/11
第二章 化学反应的一般原理
2
本章要求
1、理解反应进度、系统与环境、状态与状态函数的概念;
= 5.000104mol 显然,反应进度与物质B的选择无关,而与化学反应计量方程 式的写法有关。
2020/9/11
第二章 化学反应的一般原理
11
2.1.2 系统和环境
系统: 人们所研究的对象。 可以是实际的,也可以是假想的。
环境: 系统以外与系统密切相关的其它物质和空 间;
2020/9/11
第二章 化学反应的一般原理
而此时n(N2) =- 0.5mol,
= n(N2)/(N2) = 0.5mol/(-1/2) = 1mol,
同理n(H2) = -1.5,
= n(H2)/(H2) = -1.5mol/(-3/2) =1mol,
2020/9/11
第二章 化学反应的一般原理
9
注意:
对给定计量方程式,B为定值,随反应进行,求得nB 即 可求得;
12
根据系统与环境之间的交换情况,系统分为三类
系统
特征
有物质和能量的交换;
敞开系统
封闭系统
有能量交换, 无物质交换;
隔离系统
无物质交换 无能量交换, 是一种理想状态。 也称孤立系统。
2020/9/11
第二章 化学反应的一般原理
13
2.1.3 状态和状态函数
状态:由一系列表征系统性质的宏观物
理量(如p、T、、V等)所确定下
第二章 化学反应的一般原理
5
2.1 基本概念和术语
1.化学反应进度
2.系统和环境
3.状态和状态函数 4.过程与途径
5.热和功
6.热力学能
7.热力学第一定律
2020/9/11
第二章 化学反应的一般原理
6
2.1.1 化学反应进度 1.化学计量数 B
对任一已配平的化学反应方程式,按国家法定计
量单位可表示为 0 = BB B
4
化学热力学研究与解决的主要问题
化学热力学:研究物质及状态变化时能量的转换。 一在指定的条件下,某一化学反应能否自发进行,
即判断化学反应进行的方向。 二在指定的条件下,某一化学反应进行时,与外界
交换多少能量?即计算化学反应热。 三 若能自发进行,反应进行的程度如何?即进行有
关化学平衡的计算。
2020/9/11
也即当物质B从反应起始的n0(0= 0) nB()时,反应进
度
nB n0 nB
B
B
2020/9/11
第二章 化学反应的一般原理
8
注意:反应进度与化学反应计量方程式的写法有
关,必须指明具体的化学反应方程式。
例
1 2
N2
+ 3 H2 NH3
2
当n(NH3) = 1mol时,
= n(NH3)/(NH3) = 1mol/1 = 1mol,
反应进行程度的优越性,实际使用时,可选一个较易
准确测量的物质B来表示反应进度。)
2020/9/11
第二章 化学反应的一般原理
10
例2-1 用c(Cr2O72) = 0.02000molL1的K2Cr2O7溶液滴定 25.00mL c(Fe2+) =0.1200molL1的酸性FeSO4溶液,其滴定 反应式为 6Fe2+ + Cr2O72 + 14H+ = 6Fe3+ + 2Cr3+ + 7H2O 滴定至终点共消耗25.00mL K2Cr2O7溶液,求滴定至终点的 反应进度? 解:n(Fe2+) = 0 c(Fe2+)V(Fe2+) = 00.1200molL125.00103L
2020/9/11
第二章 化学反应的一般原理
7
2.1.2.化学反应进度
化学反应进度 [ksai]是按化学计量方程式为单元表
示化学反应进行的程度的一个物理量,单位为mol。
定义: d = B1dnB 或
dnB = Bd
nB:物质B的物质的量;
B:物质B的化学计量数;
积分式: = B1nB 即
nB = B
= 3.000103mol
= (Fe2+)1n(Fe2+)= (1/6) (3.000 103)mol
= 5.000104mol 或 n(Cr2O72) = 0 c(Cr2O72)V(Cr2O72)
= 0 0.02000 molL125.00103L
= 5.000104mol
= (Cr2O72)1n(Cr2O72)= 1(5.000104)mol
