前白蛋白测定试剂盒(免疫比浊法)标准化操作规程
前白蛋白测定试剂盒(免疫比浊法)产品技术要求北京世纪沃德生物

前白蛋白测定试剂盒(免疫比浊法)
适用范围:用于体外定量测定人血清中前白蛋白(PA)的含量。
1.1包装规格
1.2主要组成成分
外观
试
1为无色
2为无
澄清液体。
试剂盒标签标识清晰,外包装完整无损。
2.2装量
不少于瓶签标示量。
2.3试剂空白
在340nm处测定试剂空白吸光度,应≤0.50;
2.4分析灵敏度
测试50 mg/dL的被测物时,吸光度变化(ΔA)应≥0.05。
2.5线性
2.5.1在[0.3,100] mg/dL区间内,线性相关系数r≥0.990;
2.5.2在[0.3,30)mg/dL区间内,线性绝对偏差不超过±4.5mg/dL;在[30,100] mg/dL区间内,线性相对偏差不超过±15%。
2.6精密度
2.6.1重复性
测定高、中、低三个不同浓度样本,其结果的变异系数应不超过5%。
2.6.2批间差
随机抽取三批试剂盒,测试同一份样本,试剂盒批间极差不超过10%。
2.7准确度
待检系统与比对系统测值的相关系数r≥0.975;在[0.3,30﹚mg/dL区间内,绝对偏差不超过±4.5mg/dL;在[30,100] mg/dL区间内,相对偏差不超过±15%。
2.8稳定性
该产品在2℃~8℃条件下贮存有效期为12个月,取效期末的产品进行检测,应符合2.1、2.3、2.4、2.5、2.6.1、2.7的要求。
微量白蛋白测定试剂盒(免疫比浊法)产品技术要求莱帮生物

微量白蛋白测定试剂盒(免疫比浊法)
适用范围:该产品用于体外定量测定人尿液中微量白蛋白的含量。
1.1 包装规格
试剂1(R1):1×40ml 试剂2(R2):1×10ml;
试剂1(R1):2×40ml 试剂2(R2):2×10ml;
试剂1(R1):2×60ml 试剂2(R2):2×15ml ;
2.1外观
试剂盒文字符号清晰;试剂1、试剂2试剂均应澄清、无异物。
2.2净含量
试剂净含量不低于标示值。
2.3试剂空白
用蒸馏水作为样品进行检测,其空白吸光度≤0.5。
2.4分析灵敏度
测定微量白蛋白为100mg/L样本时,测定吸光度差值应>0.005△A。
2.5线性范围
本试剂盒线性(10,240)mg/L区间内,其相关系数r≥0.9900;在线性(10,40]mg/L 区间内,绝对偏差不超过±4mg/L,在线性(40,240)mg/L区间内,相对偏差不超过±10%。
2.6重复性
2.6.1测量精密度
用高低两个浓度的质控物或样本测试同一批号试剂盒,其变异系数(CV)应≤10%。
2.6.2批间差
用高低两个浓度的质控物或样本测试三个不同批号试剂盒,其批间差应≤10%。
2.7准确度
检测国际标准参考物质ERM470,相对偏差不超过±15%。
2.8稳定性
试剂盒在2~8℃条件可保存12个月,取效期末的试剂盒,检测其试剂空白吸光度,试剂空白吸光度变化率,分析灵敏度,准确度,线性和重复性等,其质量指标应符合2.1,2.2,2.3,2.4,2.5,2.6.1,2.7的要求。
前白蛋白测定试剂盒(免疫比浊法)产品技术要求瑞正善达

前白蛋白测定试剂盒(免疫比浊法)适用范围:本试剂盒用于体外定量测定人血清中前白蛋白的含量。
1.产品型号/规格及其划分说明1.1产品型号/规格及其划分说明1.2主要组成成分2.1外观2.1.1 试剂1(R1)应为无色澄清液体;2.1.2 试剂2(R2)应为淡黄色澄清液体;2.1.3 校准液应为淡黄色澄清液体;2.1.4 试剂盒标签标识清晰,外包装完整无损。
2.2 净含量试剂1(R1)、试剂2(R2)、校准液的净含量不少于标示值。
2.3 试剂空白吸光度在主波长340nm、副波长700nm处(光径1cm),试剂空白吸光度A ≤0.2。
2.4分析灵敏度测定1mg/L的被测物时,吸光度变化△A≥0.0002。
2.5 线性范围在[20,560]mg/L线性范围内,线性相关系数r≥0.990。
在[20,40]mg/L范围内,绝对偏差不超过±6mg/L;在(40,560]mg/L 范围内,相对偏差不超过±15%。
2.6 精密度2.6.1 重复性重复测定(160±30)mg/L、(300±50)mg/L、(500±30)mg/L的样品,变异系数CV≤4%。
2.6.2 批间差相对极差≤6%。
2.7 准确度本公司PA试剂盒和已上市的产品进行比对试验:相关系数r≥0.975,在[20,100]mg/L范围内,绝对偏差不超过±15mg/L,在(100,560]mg/L 范围内,相对偏差不超过±15%。
2.8 稳定性原包装试剂在2℃~8℃避光保存,有效期为12个月。
试剂盒在规定的储存条件下保存至有效期满后,检测2.3、2.4、2.5、2.6.1、2.7项,结果应符合各项目的要求。
2.9 校准液溯源性按GB/T21415-2008《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》的要求,提供校准液来源、赋值过程及不确定度计算。
试剂盒内校准液溯源至本公司工作校准液。
血清前白蛋白测定标准规程

血清前白蛋白测定标准操作规程1 检验申请单独检验项目申请:血清前白蛋白(缩写PAB)测定,组合项目申请:血生化中肝功能项目测定。
临床医生根据需要提出检验申请。
2 标本采集与处理2.1标本采集2.1.1常规静脉采血约2 ml,不抗凝,置普通试管中。
或采用含分离胶的真空采血管。
检查体液乳酸脱氢酶的体液标本应用肝素抗凝。
2.1.2检验申请单和血标本试管标上统一且唯一的标识符。
2.1.3急诊标本采集后,在检验申请单上填写标本采集时间。
2.1.4标本采集后与检验申请单一起及时运送至检验科。
专人负责标本的接收并记录标本的状态,对不合格标本予以拒收。
2.1.5下列标本为不合格标本2.1.5.1标本量不足:少于0.3ml的全血标本,或少于0.1ml的血清或血浆。
2.1.5.2对反应吸光度有干扰的标本,包括严重溶血、严重浑浊的标本。
2.1.5.3无法确认标本与申请单对应关系的。
2.1.5.4其他如标识涂改、标本试管破裂等。
2.2标本保存2.2.1接收标本后在30min内将标本离心分离出血清。
2.2.2标本保存时间:室温(15~25℃)下可稳定8h,普通冰箱中(2~8℃)稳定24h。
-20℃保存稳定30天。
为避免标本中水分挥发使血清浓缩,对保存时间超过1天的标本均加塞密闭或覆盖湿巾。
2.2.3已完成测试的标本保持完整的识别号,置4~8℃冰箱内保存7天。
2.3标本采集的注意事项2.3.1采血前使受检者保持平静、松弛、避免剧烈活动,24h不饮酒和12h以上禁食空腹状态。
2.3.2注意有无应用影响测试项目的药物。
2.3.3可以使用肝素抗凝的血液标本。
3 方法原理人血清PA与其相应抗体在液相中相遇,立即形成抗原-抗体复合物,并形成一定浊度。
该浊度的高低在一定量抗体存在时与抗原的含量成正比。
通过与同样处理的校准比较,计算未知样品的PA含量4 试剂及其他用品4.1试剂:前白蛋白试剂盒,由北京利德曼生化技术有限公司出品。
4.2试剂盒保存:未开瓶的试剂储存在2~8℃可稳定至有效期。
微量白蛋白测定试剂盒(免疫比浊法)产品技术要求丹大

微量白蛋白测定试剂盒(免疫比浊法)适用范围:本品用于体外定量测定人尿液中微量白蛋白的含量。
1.1规格规格1: (试剂1:20mL;试剂2: 5mL);规格2: (试剂1:40mL;试剂2:10mL);规格3: (试剂1:80mL;试剂2:20mL);校准品(冻干品):为选配:规格1(0.3mL×1;1水平);规格2(0.5mL×1;1水平);规格3(1.0mL×1;1水平);质控品(冻干品):为选配规格1(0.5mL×2;2水平);规格2(1.0mL×2;2水平)。
1.2组成试剂盒组成见表1定试表1 微量白蛋白测定试剂盒组成2.1试剂2.1.1外观试剂盒外观应整洁,文字符号标识清晰;试剂1、试剂2均为无色透明液体,不得有沉淀和絮状物。
2.1.2装量每瓶不少于标示值。
2.1.3试剂空白吸光度用指定的空白样品测试试剂(盒),在光径1cm下,在A340nm处测定试剂空白吸光度A≤0.2。
2.1.4分析灵敏度测定30 mg/L的样品,吸光度差值△A≥0.01。
2.1.5线性范围2.1.5.1在[2, 400]mg/L内,相关系数R≥0.990。
2.1.5.2在[2, 30]mg/L内,线性绝对偏差不超过±3.0mg/L;(30, 400]mg/L内,线性相对偏差不超过±10%。
2.1.6 重复性重复测试(45±9)mg/L和(90±18)mg/L样本,所得结果的变异系数(CV%)应不大于5%。
2.1.7批间差测定(45±9)mg/L和(90±18)mg/L样本,所得结果的批间相对极差(R)应不大于10%。
2.1.8准确度)中加入一定体积高于400mg/L的白蛋在正常浓度范围的临床样本(C白纯品(C)或由纯品配制的标准溶液,回收率应在90%-110%范围内。
s2.2校准品2.2.1外观校准品为冻干品。
前白蛋白测定试剂盒(免疫比浊法)产品技术要求万泰德瑞

前白蛋白测定试剂盒(免疫比浊法) 适用范围:用于体外定量测定人血清中前白蛋白的含量。
1.1 包装规格试剂1:60mL×8 、试剂2:48mL×2;试剂1:65mL×3 、试剂2:39mL×1;试剂1:50mL×4 、试剂2:20mL×2;试剂1:50mL×1 、试剂2:10mL×1;试剂1:100mL×2 、试剂2:20mL×2;试剂1:20mL×1 、试剂2:4mL×1;2400 测试/盒(试剂1:70mL×4 、试剂2:14mL×4);1680 测试/盒(试剂1:99mL×2 、试剂2:20mL×2);1260 测试/盒(试剂1:50mL×3 、试剂2:9mL×3);840 测试/盒(试剂1:50mL×2 、试剂2:10mL×2);1260 测试/盒(试剂1:50mL×3 、试剂2:10mL×3);900 测试/盒(试剂1:25mL×2 、试剂2:5mL×2);1200 测试/盒(试剂1:70mL×2 、试剂2:14mL×2);960 测试/盒(试剂1:50mL×4 、试剂2:10mL×4);1640 测试/盒(试剂1:64mL×3 、试剂2:39mL×1);600 测试/盒(试剂1:50mL×1 、试剂2:9mL×1);1720测试/盒(试剂1:74mL×4 、试剂2:19mL×4)。
1.2 组成成分试剂1:Tris缓冲液pH=7.6 18.2mmol/L氯化钠 123.2mmol/L聚乙二醇适量试剂2:前白蛋白抗体适量Tris缓冲液pH=7.6 18.2mmol/L氯化钠 123.2mmol/L2.1 试剂装量应不低于试剂瓶标示装量。
前白蛋白(PA)测定试剂盒(免疫比浊法)产品技术要求lideman
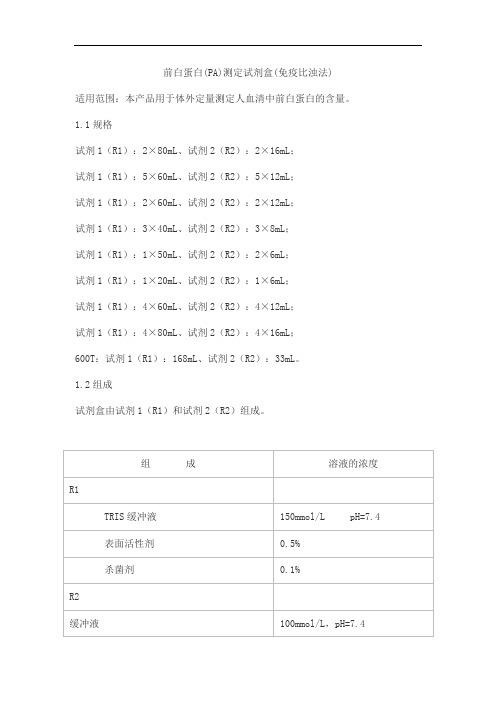
前白蛋白(PA)测定试剂盒(免疫比浊法)适用范围:本产品用于体外定量测定人血清中前白蛋白的含量。
1.1规格试剂1(R1):2×80mL、试剂2(R2):2×16mL;试剂1(R1):5×60mL、试剂2(R2):5×12mL;试剂1(R1):2×60mL、试剂2(R2):2×12mL;试剂1(R1):3×40mL、试剂2(R2):3×8mL;试剂1(R1):1×50mL、试剂2(R2):2×6mL;试剂1(R1):1×20mL、试剂2(R2):1×6mL;试剂1(R1):4×60mL、试剂2(R2):4×12mL;试剂1(R1):4×80mL、试剂2(R2):4×16mL;600T:试剂1(R1):168mL、试剂2(R2):33mL。
1.2组成试剂盒由试剂1(R1)和试剂2(R2)组成。
2.1 外观液体双试剂:试剂1(R1)(缓冲液):无色液体,试剂2(R2)(启动液):无色或淡黄色液体。
2.2 净含量液体试剂的净含量不得低于标示体积。
2.3 空白吸光度在37℃、340 nm波长、1cm光径条件下,试剂空白吸光度应<0.1 ABS。
2.4 分析灵敏度浓度为5mg/dL时,吸光度变化范围在(0.01- 0.10)之间。
2.5 线性范围在3-52]mg/dL线性范围内,线性相关系数r2 ≥0.990。
在(20–52 ]mg/dL范围内的相对偏差≤10%;测定结果3-20] mg/dL时绝对偏差≤2 mg/dL。
2.6 精密度试剂盒测试项目精密度 CV< 5 %。
2.7 批间差不同批号之间测定结果的相对偏差应< 6 %。
2.8 准确度回收率:回收率应为 80%-120%范围内。
2.9 稳定性原包装试剂,在(2~8)℃下有效期为18个月,取失效期的试剂盒检测其准确度和线性,试验结果满足2.5、2.8的要求。
血清前白蛋白测定标准规程(知识资料)

血清前白蛋白测定标准操作规程1 检验申请单独检验项目申请:血清前白蛋白(缩写PAB)测定,组合项目申请:血生化中肝功能项目测定。
临床医生根据需要提出检验申请。
2 标本采集与处理2.1标本采集2.1.1常规静脉采血约2 ml,不抗凝,置普通试管中。
或采用含分离胶的真空采血管。
检查体液乳酸脱氢酶的体液标本应用肝素抗凝。
2.1.2检验申请单和血标本试管标上统一且唯一的标识符。
2.1.3急诊标本采集后,在检验申请单上填写标本采集时间。
2.1.4标本采集后与检验申请单一起及时运送至检验科。
专人负责标本的接收并记录标本的状态,对不合格标本予以拒收。
2.1.5下列标本为不合格标本2.1.5.1标本量不足:少于0.3ml的全血标本,或少于0.1ml的血清或血浆。
2.1.5.2对反应吸光度有干扰的标本,包括严重溶血、严重浑浊的标本。
2.1.5.3无法确认标本与申请单对应关系的。
2.1.5.4其他如标识涂改、标本试管破裂等。
2.2标本保存2.2.1接收标本后在30min内将标本离心分离出血清。
2.2.2标本保存时间:室温(15~25℃)下可稳定8h,普通冰箱中(2~8℃)稳定24h。
-20℃保存稳定30天。
为避免标本中水分挥发使血清浓缩,对保存时间超过1天的标本均加塞密闭或覆盖湿巾。
2.2.3已完成测试的标本保持完整的识别号,置4~8℃冰箱内保存7天。
2.3标本采集的注意事项2.3.1采血前使受检者保持平静、松弛、避免剧烈活动,24h不饮酒和12h以上禁食空腹状态。
2.3.2注意有无应用影响测试项目的药物。
2.3.3可以使用肝素抗凝的血液标本。
3 方法原理人血清PA与其相应抗体在液相中相遇,立即形成抗原-抗体复合物,并形成一定浊度。
该浊度的高低在一定量抗体存在时与抗原的含量成正比。
通过与同样处理的校准比较,计算未知样品的PA含量4 试剂及其他用品4.1试剂:前白蛋白试剂盒,由北京利德曼生化技术有限公司出品。
4.2试剂盒保存:未开瓶的试剂储存在2~8℃可稳定至有效期。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
前白蛋白测定试剂盒(免疫比浊法)标准化操作规程
1 目的
规范实验室操作,保证检验工作顺利有效进行特制定此规程。
2 授权操作人经培训且考核通过的实验室检验人员。
3 适用范围本试剂适用于体外定量检测人血清中前白蛋白的浓度。
4 检验方法
本试剂盒采用免疫透射比浊法测定人血清中前白蛋白的浓度。
5 检验原理
样本中前白蛋白与抗体结合产生免疫复合物的浊度,根据浊度的高低与样本中前白蛋白的含量成正比。
在340nm处测定吸光度的变化值,即可计算出样本中前白蛋白的含量。
6 标本要求
6.1标本类型: 新鲜血清标本,避免溶血。
6.2标本运输: 室温条件下运输。
6.3标本保存: 若不能及时测定,请尽快置于-20℃保存,避免反复冻融。
7 试剂及配套品
7.1试剂来源
长春迪瑞医疗科技股份有限公司前白蛋白测定试剂盒
7.2试剂组成
7.3试剂的稳定性与贮存
在2℃~8℃条件下,干燥、避光、密封贮存,有效期12个月;启用后在2~8˚C可稳定30天,试剂不可冰冻。
8 实验仪器及性能指标
8.1 实验仪器
迪瑞CS系列全自动生化分析仪
8.2试剂性能指标
8.2.1 空白吸光度:A≤0.30。
8.2.2分析灵敏度:测试30 mg/dL被测物时,吸光度变化△A≥0.015。
8.2.3 线性范围:11mg/dL~56mg/dL,线性相关系数r值≥0.9900;[11,19] mg/dL
区间内,线性绝对偏差应不超过±3.36mg/dL;(19,56] mg/dL区间内,相对偏差不超过±15%。
8.2.4 准确度:相对偏差应在±20%范围内。
8.2.5 测量精密度:
重复性:CV≤7.0%。
批间差:R≤8.0%。
8.2.6空白限≤11.00mg/dL。
9 校准
9.1校准品
前白蛋白校准品
9.2校准品存贮及使用注意事项
参见前白蛋白校准品使用说明书。
9.3 校准程序
建议使用试剂盒配套的校准品:进行5点校准测定,测定后仪器自动拟合成校准曲线。
当试剂批号更换或质控失控时,需要重新校准。
10 质量控制
10.1质控品
前白蛋白质控品
10.2质控品存贮及使用注意事项
参见前白蛋白质控品使用说明书。
10.3质量控制
建议使用迪瑞公司质控品,进行质量控制。
实验室应自行建立质控区间和限值,若质控值失控,应采取纠正措施。
11操作程序
11.1试剂配制
试剂1和试剂2均为液体试剂,可直接使用。
11.2 项目参数:
11.3 样本测试步骤:
11.4
根据校准品的浓度和对应吸光度变化值△A,采用非线性函数(Logit-log5p)确定校准曲线,所测样本吸光度变化在校准曲线上相对应的浓度值即为所测浓度。
11.5 注意事项
11.5.1 本品仅用于体外诊断。
11.5.2 避免测试过程中添加试剂,避免操作时日光直射。
11.5.3 试剂和样本用量可根据不同仪器的要求按比例改变
11.5.4不同批号试剂盒中各组份不可以互换。
12结果判断
12.1 如反应温度为25℃或30℃,孵育时间相应延长至8分钟或6分钟。
12.2 前白蛋白浓度的检测只是临床医师对患者进行诊断的指标之一,临床医师还要根据患者的体症、病史以及其它的诊断项目、诊断手段进行综合判断。
13 参考区间
正常成人的参考值范围:20mg/dL~40mg/dL
本参考值范围仅供参考,建议各实验室考虑参考值对接触人群的适用性,如有必要,应自行确定参考值范围。
14 临床意义
前白蛋白的分子量5.4万,由肝细胞合成,在电泳分离时,常显示在白蛋白的前方,其半衰期很短,仅约12小时。
因此,测定其在血浆中的浓度对于了解蛋白质的营养不良、肝功能不全、比之白蛋白和转铁蛋白具有更高的敏感性,是临床上判断营养状态的重要指标。
前白蛋白减少常见于急性肝炎、阻塞性黄疸以及肝功能衰竭,此外,营养不良,造成负氮平衡也会使前白蛋白的含量降低。
15复检操作程序
按仪器使用说明书进行复查操作。
16 方法局限性
16.1 检验结果的准确性依赖于仪器的校正和测定温度、时间的控制。
16.2 当样本中黄疸>1368μmol/L、血红蛋白>10g/L、抗坏血酸>50mmol/L时可能会影响检测结果。
17 注意事项
样本、废液等有潜在生物传染性,操作者应遵守实验室安全操作规定,并按当地医疗废弃物、感染性废弃物、产业废弃物等规定处理废液。
18 个人防护
18.1若本试剂误入眼内或口中、或接触到皮肤时,请迅速用水冲洗,必要时请接受医生治疗。
18.2请把标本当作可能感染HIV、HBV、HCV等的危险物质处置。
为了避免或减少相关的传染风险,请使用一次性手套。
19 当检测系统不能工作时,所采取的补救措施
当仪器发生故障时,迅速联系仪器厂家进行维修。
20 参考文献
20.1 Melamies LM,et al. Clin Chem,1986:32:1890~1894.
20.2 Winkles JW,et al. Clin Chem,1989:35:303~307.
20.3 US Department of Health and Human Services.Biosafety in Microbiological and Biomedical Laboratories.HHS Publication (CDC),4th ed. Washington,DC: US Government Printing Office,May 1999.
20.4 NCCLS . Interference Testing in Clinical Chemistry;Approved Guideline, 2005.。
