分析化验_气体中氨含量的测定
含氨气体的分析

、含氨气体的分析合成塔进、出口气中氨含量的测定规程(采用仲裁法又称改装型蓝舒仪法)1. 原理根据酸碱中和原理,使含氨的样气,连续通过预先加入甲基红指示剂和一定数量的硫酸标准液中,当硫酸溶液由红色变为黄色时,停止通气。
根据残余气体体积和硫酸标准液用量计算氨含量,反应方程式如下:H2SO4+ 2NH3= (NH4)2SO42. 仪器1) 改装型蓝舒仪由500ml直型带满刻度量气管与800ml水准瓶组成。
2) 氨反应管3. 试剂1) 硫酸标准液 C(1/2 H2SO4)=0.1mol/L;2) 甲基红指示剂 0.1%4. 测定步骤1) 于氨反应管中加硫酸标准溶液10ml(进空为2ml)、甲基红指示剂2滴,加蒸馏水至管高2/3左右;2) 调整量气管中含有甲基红指示剂的硫酸封闭液至零位,把氨反应管进口与样气管连接,反应管出口与量;气管连接3) 使样气缓慢通过反应管,严格控制鼓泡速度(出口气2~3个泡/S,进口气4~6个泡/S);4) 当溶液一半由红色变黄色,即停止通气;5) 再将氨反应管上下摇动,如全部溶液刚好由红色变为黄色时,说明化学计量点已到,如仍为红色,则需继续通入少量气体;6)读取残余气体体积和温度;7) 计算NH3%=C×V1×22.08×100/(V×f+C×V×22.08)式中 C----硫酸标准溶液之物质的量浓度,mol/LV1----硫酸标准溶液的体积,mlV-----残余气体t℃体积,mlf-----温度校正值,即273/(273+t)22.08---标况下氨的毫摩尔体积,ml5. 注意事项1) 采用改装型蓝舒仪是为适应控制分析,工艺考核时应使用蓝舒仪。
操作时,加入过量的硫酸标准溶液再返滴定。
着样可提高分析准确度。
2) 一定要采用细长的氨反应管,并且吸收液体应为管长2/3,使样气与其充分接触,并严格按规程中的通气速度,让气泡单个单个冒出液面,以利于吸收完全。
空气中氨的测定纳氏试剂比色(精)

采样5分钟,同时记录采样地点的温度、大气压。
(二) 样品分析 1。标准曲线的绘制:略。
2。样品分析:
(1)用吸收液洗涤进气管内壁3次,取1ml样品溶液于 比色管中,加吸收液至10ml。 (2)加纳氏试剂0.5ml,混匀,放置5分钟。
(3)比色:波长为420nm,比色杯厚度为20mm。
四、计算 空气中氨的浓度=10c/v0 v0= Vt×273×P/(273+t) ×7617℃
C:标准曲线上查得的样品中氨的含量
v0:标准状况下的采样体积。
五、结果评价
MAC=30mg/m3,
评价所采样品中的氨是否超标,若超标计算 超标倍数。
六、注意事项
1、 采样时注意吸收管与采样器的连接。 2、 加入纳氏试剂后溶液立即显色,放置
后颜色加深。
空气中氨的测定——纳氏试剂比色
一、目的 1.掌握空气中氨测定的实验原理和方法。 2.复习有关刺激性气体的理论知识。
二、原理
用稀硫酸吸收空气中的氨,与纳氏试 剂在碱性条件下作用产生黄色物质,颜色
深浅与空气中的氨含量成正比,比色定量。
三、操作步骤
(一) 采样:将盛有10ml吸收液的大型气泡吸 收管连接在大气采样器上,采样速度为0.5l/min,
室内空气中氨的测定方法

仪器文献- 室内空气中氨的测定方法频道:仪器仪表发布时间:2008-03-05测定空气中氨的化学方法有次氯酸钠—水杨酸分光光度法、纳氏试剂分光光度法、靛酚蓝试剂比色法;仪器法有离子选择电极法和光离子化气相色谱法等。
f.1次氯酸钠—水杨酸分光光度法f.1.1 相关标准和依据本方法主要依据gb/t14679 《空气质量氨的测定次氯酸钠-水杨酸分光光度法》。
f.1.2 原理氨被稀硫酸吸收液吸收后,生成硫酸铵。
在亚硝基铁氰化钠存在下,铵离子、水杨酸和次氯酸钠反应生成蓝色化合物,根据颜色深浅,用分光光度计在697nm波长处进行测定。
f.1.3 测定范围在吸收液为10ml,采样体积为10~20 l时,测定范围为0.008~110 mg/m3,对于高浓度样品测定前必须进行稀释。
本方法检出限为0.1μg/ml,当样品吸收液总体积为10ml,采样体积为10l时,最低检出浓度0.008mg/m3。
f.1.4 试剂分析中所用试剂全部为符合国家标准的分析纯试剂;使用的水为无氨水。
f.1.4.1 水:无氨,可用下述方法之一制备。
f.1.4.1.1 蒸馏法向1000ml的蒸馏水中加0.1ml硫酸(ρ=1.84g/ml),在全玻璃装置中进行重蒸馏,弃去50ml初馏液,于具塞磨口的玻璃瓶中接取其余馏出液,密封,保存。
f.1.4.1.2 离子交换法将蒸馏水通过强酸性阳离子交换树脂柱,其流出液收集在具塞磨口的玻璃瓶中。
f.1.4.2 硫酸吸收液硫酸溶液c(1/2 h2so4)=0.005mol/l。
f.1.4.3 水杨酸—酒石酸钾溶液称取10.0g水杨酸〔c6h4(oh)cooh〕置于150ml烧杯中,加适量水,再加入5mol/l氢氧化钠溶液15m l,搅拌使之完全溶解。
另称取10.0g酒石酸钾钠(knac4h4o6·4h2o),溶解于水,加热煮沸以除去氨,冷却后,与上述溶液合并移入200ml容量瓶中,用水稀释到标线,摇匀。
空气中氨检验方法

空气中氨检验方法 Modified by JACK on the afternoon of December 26, 2020公共场所空气中氨检验方法一、靛酚蓝分光光度法1原理空气中氨吸收在稀硫酸中,在亚硝基铁氰化钠及次氯酸钠存在下,与水杨酸生成蓝绿色的靛酚蓝染料,根据着色深浅,比色定量。
2试剂和材料本法所用的试剂均为分析纯,水为无氨蒸馏水,制备方法见附录A。
吸收液[c(H2SO4)=L]:量取浓硫酸加入水中,并稀释至1L。
临用时再稀释10倍。
水杨酸溶液(50g/L):称取10.0g水杨酸[C6H4(OH)COOH]和10.0g柠檬酸钠(Na3C6O7·2H2O),加水约50ml,再加55ml氢氧化钠溶液[c(NaOH)=2mol/L],用水稀释至200ml。
此试剂稍有黄色,室温下可稳定一个月。
亚硝基铁氰化钠溶液(10g/L):称取1.0g亚硝基铁氰化钠[Na2Fe(CN)5·NO·2H2O],溶于100ml水中,贮于冰箱中可稳定一个月。
次氯酸钠溶液[c(NaClO)=L]:取1ml次氯酸钠试剂原液,用碘量法标准定其浓度(标定方法见附录B)。
然后用氢氧化钠溶液[c(NaOH)=2mol/L]称释成L的溶液。
贮于冰箱中可保存两个月。
氨标准溶液2.5.1 标准贮备液:称取0.3142g经105℃干燥1h的氯化铵(NH4Cl),用少量水溶解,移入100ml容量瓶中,用吸收液(见)稀释至刻度,此液含氨。
标准工作液:临用时,将标准贮备液(见)用吸收液稀释成含μg氨。
3仪器、设备大型气泡吸收管:有10ml刻度线,出气口内径为1mm,与管底距离应为3~5mm。
空气采样器:流量范围0~2L/min,流量稳定。
使用前后,用皂膜流量计校准采样系统的流量,误差应小于±5%。
具塞比色管:10ml。
分光光度计:可测波长为,狭缝小于20nm。
4采样用一个内装10ml吸收液的大型气泡吸收管,以0.5L/min流量,采气5L,及时记录采样点的温度及大气压力。
煤气中氨含量的测定

煤气中氨含量的测定
《煤气中氨含量的测定》
煤气中氨含量的测定是煤气污染控制的重要指标,其中氨的含量过高会对人体健康有害。
因此,测定煤气中氨含量十分重要。
测定煤气中氨含量的方法有多种,其中最常用的是电化学检测法。
该方法以电化学传感器为主要检测仪器,用电化学反应原理测定煤气中氨含量。
除了电化学检测法外,还可以采用紫外分光光度法进行测定。
紫外分光光度法是以氨对紫外线的吸收特性为基础,通过测量煤气中氨的吸收率来测定氨含量。
此外,还可以采用气相色谱法进行测量。
气相色谱法是利用氨的不同分子量和极性,将其分离出来,再用质谱仪测量各分子量的氨的含量,从而测定煤气中的氨含量。
以上就是测定煤气中氨含量的方法,它们都可以准确测定煤气中氨含量,从而保证煤气污染控制的有效性。
气相色谱法测定气体中的氨含量

136
总第 232 期 2021 年第 4 期(第 47 卷)
连接管线尽量短。打开取样锡箔袋或者钢瓶的出口阀 调节适当的流量,充分清洗整个进样系统,管路置换 30 s 以上,关闭锡箔袋或者钢瓶出口的阀门,待色谱置换气 出口不再有气泡冒出时,按下色谱“开始”键。
中图分类号:TQ113.2;O657.71
文献标识码:A
文章编号:1008-553X(2021)04-0135-02
在甲醇生产过程中,氨含量的测定是工艺生产重要 的操作依据,对装置安全稳定运行具有重要意义。一般 常量氨含量的分析使用的是兰舒仪法,需要配制溶液, 操作复杂,并且操作者技能的差异可能造成分析误差。 笔者尝试采用气相色谱法测定,取得了很好的效果。与 兰舒仪分析法比较,分析速度和效率大大提高,准确度 和精密度也能满足要求。
色谱工作站将自动采集、记录色谱图,并根据样品 的峰面积和原来的校正表数据计算出气体中氨气的 含量。
将氨气样品连续进样平行测定 3 次,最后的结果以 三次测定结果的平均值为准。图 2 为气体中氨气的色 谱图。
安徽化工
表 2 精密度验证表
编号 1 2 3 4 5 6
测定结果(%) 3.20 3.19 3.22 3.20 3.20 3.21
参考文献
[1]罗淑华,成柏春. 气相色谱法测定氨气中的氨纯度[J]. 广石化科 技,2008(3):47-49.
[2]张志萍,肖华贵,龚 宁. 气相色谱仪快速测定氨合成塔进出口气 的氨含量[J]. 贵州化工,2012,37(4):35-36.
平均值(%) RSD(%)
3.20
0.32
6.2 准确度 将标准气氨气含量为 1.20%的气体,安装好减压阀
分析化验_气体中氨含量的测定
气体中氨含量的测定1方法适用本方法适合于工艺管道置换中及合成塔出口、入口氨含量的测定。
2原理酸碱中和法。
使样气通过预先加有甲基红指示剂的一定量的硫酸标准滴定液。
当硫酸标准溶液的红色刚好褪色时,停止通气,记下未被酸吸收的残余气体体积,即可进行氨的计算。
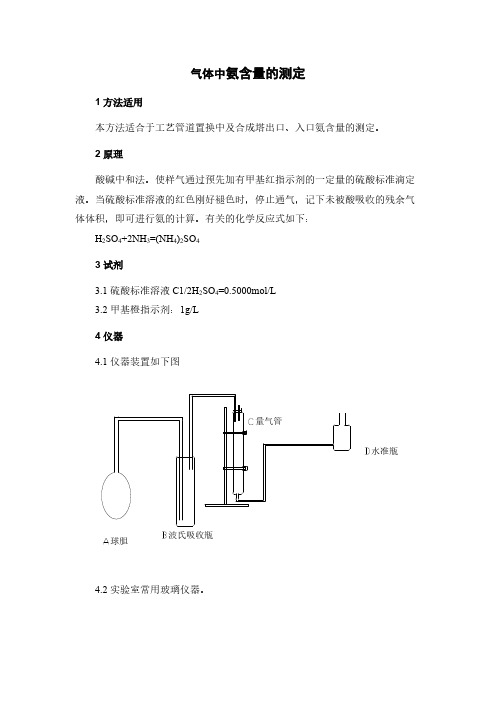
有关的化学反应式如下:H2SO4+2NH3=(NH4)2SO43试剂3.1硫酸标准溶液C1/2H2SO4=0.5000mol/L3.2甲基橙指示剂:1g/L4仪器4.1仪器装置如下图量气管水准瓶波氏吸收瓶球胆4.2实验室常用玻璃仪器。
5操作步骤准确加入一定量的硫酸标准溶液,2滴甲基橙指示剂于波氏吸收瓶内,按图连接好仪器,操作水准瓶,调整量气管中封闭液到零点,把吸收管的进口与球胆连接,出口与量气管连接。
控制进气流速,鼓泡以每秒2~3个为宜。
当吸收瓶中的溶液一半由红变成黄色时,表明终点已到。
读取残气体积。
6计算结果样气中氨含量以体积百分数表示,按下式计算:10008.2208.22%(V/V)NH 0103⨯⨯⨯+⨯⨯⨯=V C f V V C 式中:C 为实验中用硫酸标准溶液的浓度,mol/LV 0为实验中用硫酸标准溶液的体积,mLV 1为硫酸吸收氨后的残余体积,mLF 为气体体积换算成标准状况下的体积的换算系数,花山大约为0.74(20℃)22.08为标准状况下,氨气的摩尔体积,L/mol 。
7注意事项7.1氨气在水中的溶解度很大,应防止采样带水;7.2仪器装置应保持良好的气密性;7.3气体在通过吸收瓶时流速不应过快,以免吸收不完全。
7.4取样应站在上风口,戴乳胶手套。
氨气检验方法

氨气检验方法氨气是一种常见的气体,在工业生产和实验室中都有广泛的应用。
然而,氨气具有刺激性气味,对人体和环境都有一定的危害。
因此,及时准确地检验氨气的浓度就显得尤为重要。
下面将介绍几种常见的氨气检验方法。
首先,最常见的氨气检验方法之一是使用pH试纸。
这种方法简单易行,无需复杂的仪器设备,只需要将pH试纸浸泡在待检测的液体或气体中,然后根据试纸变色的程度来判断氨气的浓度。
但是,这种方法只能检测氨气的存在与否,无法准确测量其浓度。
其次,氨气检验的常用方法还包括使用氨气检测仪。
这种仪器可以准确测量氨气的浓度,并且操作简便,结果准确可靠。
使用氨气检测仪可以快速获得氨气的浓度数据,对于需要频繁检测氨气的工作场所来说,是一种非常有效的方法。
此外,还有一种常见的氨气检验方法是化学分析法。
通过化学反应来检测氨气的浓度,这种方法可以精确测量氨气的含量,但是需要使用一些化学试剂和仪器,操作相对复杂,且需要一定的化学知识和技能。
除了以上介绍的方法外,还有一些新型的氨气检验技术不断涌现,如光电检测技术、红外吸收技术等,这些技术在氨气检验领域也有着广泛的应用前景。
总的来说,对于氨气的检验,我们可以根据具体的情况选择合适的方法。
如果只是简单的判断氨气是否存在,可以选择使用pH试纸;如果需要准确测量氨气的浓度,可以选择使用氨气检测仪或化学分析法;如果想要追求更高的检测精度和效率,也可以考虑采用一些新型的氨气检测技术。
在进行氨气检验时,我们需要注意安全问题,尤其是在使用化学试剂和仪器时,要严格遵守操作规程,做好个人防护。
另外,对于检测结果的解读和处理也需要谨慎,及时采取相应的措施,保障人员和环境的安全。
综上所述,氨气检验是一项重要的工作,选择合适的检验方法对于保障生产和实验的安全至关重要。
希望本文介绍的氨气检验方法能够为大家在实际工作中提供一些帮助。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
气体中氨含量的测定
1方法适用
本方法适合于工艺管道置换中及合成塔出口、入口氨含量的测定。
2原理
酸碱中和法。
使样气通过预先加有甲基红指示剂的一定量的硫酸标准滴定液。
当硫酸标准溶液的红色刚好褪色时,停止通气,记下未被酸吸收的残余气体体积,即可进行氨的计算。
有关的化学反应式如下:
H2SO4+2NH3=(NH4)2SO4
3试剂
3.1硫酸标准溶液C1/2H2SO4=0.5000mol/L
3.2甲基橙指示剂:1g/L
4仪器
4.1仪器装置如下图
量气管
水准瓶
波氏吸收瓶
球胆
4.2实验室常用玻璃仪器。
5操作步骤
准确加入一定量的硫酸标准溶液,2滴甲基橙指示剂于波氏吸收瓶内,按图连接好仪器,操作水准瓶,调整量气管中封闭液到零点,把吸收管的进口与球胆连接,出口与量气管连接。
控制进气流速,鼓泡以每秒2~3个为宜。
当吸收瓶中的溶液一半由红变成黄色时,表明终点已到。
读取残气体积。
6计算结果
样气中氨含量以体积百分数表示,按下式计算:
10008.2208.22%(V /V )NH 0103⨯⨯⨯+⨯⨯⨯=V C f V V C
式中:C 为实验中用硫酸标准溶液的浓度,mol/L
V 0为实验中用硫酸标准溶液的体积,mL
V 1为硫酸吸收氨后的残余体积,mL
F 为气体体积换算成标准状况下的体积的换算系数,花山大约为0.74(20℃) 22.08为标准状况下,氨气的摩尔体积,L/mol 。
7注意事项
7.1氨气在水中的溶解度很大,应防止采样带水;
7.2仪器装置应保持良好的气密性;
7.3气体在通过吸收瓶时流速不应过快,以免吸收不完全。
7.4取样应站在上风口,戴乳胶手套。
