药物分析 第10章 电位
药物分析中的电分析化学方法

药物分析中的电分析化学方法药物分析是指通过物理、化学及其它方法对药物进行定量和鉴别分析的过程。
其中,电分析化学方法在药物分析领域起着重要的角色。
本文将详细介绍药物分析中常用的电分析化学方法,并探讨其在药物研究与分析中的应用。
一、电分析化学方法的基本原理电分析化学方法是利用电化学技术与分析化学原理相结合的一种分析方法。
电分析化学方法包括电位法、电流法和电导法等。
1. 电位法电位法是基于电极之间的电势差进行药物分析的方法,常用的电位法有电位滴定法、电位滴定曲线法和极谱法等。
电位法适用于药物与氧化还原反应有关的分析,可用于药物含量测定、药物质量控制等方面。
2. 电流法电流法是通过测量药物溶液在电场中的电流变化进行分析的方法,常用的电流法有极谱法、电化学检测法和电解滴定法等。
电流法适用于药物的氧化还原性质分析,可以进行药物的稳定性研究、药物残留检测等。
3. 电导法电导法是利用药物溶液电导率与其浓度成正比关系进行分析的方法,常用的电导法有直接测定法和间接测定法。
电导法适用于药物溶液的浓度测定、纯度检测等方面。
二、药物分析中的电分析化学方法应用案例以下为几个药物分析中常见的案例,展示了电分析化学方法的应用。
1. 药物含量测定电位滴定法是药物含量测定中常用的方法之一。
以某药物A为例,通过将药物A溶解于适量溶剂中,用标准溶液滴定至药物溶液与指示剂颜色变化终点相一致,从而计算得到药物A的含量。
2. 药物残留检测电化学检测法可用于药物残留的检测。
以某药物B为例,将其溶解于适当的电解质中,经过电化学反应后,测定药物B产生的电流强度,从而判断药物B的残留情况。
3. 纯度检测电导法可用于药物纯度的检测。
以某药物C为例,将其溶解于适量的电解质溶液中,通过测定药物C溶液的电导率,从而判断药物C的纯度。
三、电分析化学方法的优势与挑战电分析化学方法在药物分析中具有以下优势:1. 灵敏度高:电分析化学方法具有较高的检测灵敏度,可以检测到药物的微量成分。
药物分析习题第10章.doc

1 .生物碱类药物中显两性的是,显弱酸性的是2.薄层色谱法分离鉴定生物碱,有机含氮药物,常采用A加碱试剂的展开液B制备含氮的薄层板C造成碱性气氛D将供试品溶液碱性化E喷洒碱性试剂3.各类型药物的特征鉴别反应分别是什么?4.咖啡因和茶碱的特征鉴别反应是:A,双缩月尿反应 B. Vitali反应C.Marquis反应D.紫服酸铉反应E.绿奎宁反应5.盐酸吗啡中应检查的特殊杂质为:A.吗啡B.阿朴吗啡C.罂粟碱D.直着碱E.其它生物碱6.用非水溶液滴定法测定盐酸吗啡含量时,应使用的试剂是:A.5%醋酸汞冰醋酸液B.盐酸C.冰醋酸D.二甲基甲酰胺E.高氯酸7.非水溶液滴定法测定硫酸奎宁含量的反应条件为:A.冰醋酸一醋酎为溶剂B.高氯酸滴定液(O.lmol/L)滴定C.Imol的高氯酸与么mol的硫酸奎宁反应D.仅用电位法指示终点E.漠酚蓝为指示剂8.非水溶液滴定法测定硫酸奎宁原料的含量时,可以用高氯酸直接滴定冰醋酸介质中的供试品,1摩尔硫酸奎宁需要消耗高氯酸的摩尔数为A. 1B. 2C. 3D. 4E. 59.酸性染料比色法测定生物碱类药物,有机溶剂萃取测定的有色物是A.离子对和指示剂的混合物B.生物碱盐C.指不剂D.后子对E.游昌生物碱10.酸件染料比色法中,水相的pH值过大,则A.能形成离子对B.有机溶剂提取能完全C.酸性染料以阴离子状态存在D.生物碱几乎全部以分子状态存在11.可选择的药物:A.阿托品B.吗啡C.两者均可D.两者均不可①具有酯结构A ②为两性化合物B③显较强碱性A④用碱性染料比色法D12. A.双缩服反应B. Marquis反应C.两者皆是 D.两者皆不是①盐酸麻黄碱A②某些生物碱类药物C③盐酸吗啡B④咖啡因D ⑤硫酸奎尼丁D13.生物碱类药物的一般鉴别试验包括A.熔点测定B.显色反应C.沉淀反应D.光谱法(紫外、红外)E.薄层色谱法14.能够发生Vitali反应的药物是A.盐酸吗啡B.硫酸奎宁C.磷酸可待因D.盐酸麻黄碱E.硫酸阿托品什么是酸性染料比色法?其影响的主要因素有哪些?非水滴定法测定生物碱硫酸盐的含量时,其反应有什么特点?含量测定时,用氯仿作提溶剂,应注意哪些问题?为什么含酚类、含酯类、含脂肪性共存药物不适合用强碱溶解?。
《电位分析法》课件

氧传感器
pH传感器
电位分析法可用于制备氧传感器, 用于监测环境中氧气浓度的变化, 以及其他应用领域。
电位分析法可以应用于制备pH传 感器,用于测量溶液的酸碱性和 酸度、碱度的变化。
电位分析法的未来发展和挑战
未来,随着科技的进步,电位分析法可能会更多地与纳米技术、可穿戴设备等领域结合,但也面临着仪器精度、 样品复杂度以及快速化需求等挑战。
食品安全
电位分析法可以用于食品中有害物质的检测, 帮助保障食品安全,支持消费者的信任。
优势
电位分析法具有高灵敏度、非破坏性、快速和 低成本等优点,适用于各种分析需求。
电位分析法和标准溶液,校准电极,并确保实验环境的稳定性。
2
测量电势
将电极浸入待测溶液中,记录电极的电势变化,并根据反应进行必要的计算。
电位分析法的原理和基本概念
电位分析法基于电极与待测物质之间的化学反应,如氧化还原反应。通过测量电极的电势变化,我们可以推断 溶液中的物质浓度、物种的选择性等信息。
电位分析法的应用领域和优势
环境监测
电位分析法可以用于检测水体中的重金属离子、 有机物污染物等,有助于保护环境和人类健康。
药物分析
通过电位分析法,我们可以快速准确地测定药 物中的成分,评估其质量并指导生产过程。
3
分析结果
根据测得的电势和相关计算,得出溶液中物质的浓度或其他性质的分析结果。
电位分析法实验结果的解读和 分析
实验结果的解读和分析是电位分析法的重要环节,它们需要充分考虑反应机 制、电极响应特性和实验条件,以获得可靠的结论和科学的推理。
电位分析法实验案例分享
滴定实验
通过电位分析法进行滴定实验, 可以确认酸碱滴定终点和测定溶 液中特定组分的含量。
电位分析法

a pot K a i, j
i
ni n j
j
00:05:32
三、响应时间
响应时间:是指参比电极与离子选择性电极一起从接 触到试液开始到电极电位值达到稳定值的95%(波动在1mV 以内)所需的时间。
响应时间与溶液的搅拌速度、参比电极的稳定性和被 测离子的浓度等因素有关。
被测离子的浓度高,达到平衡快,响应时间短;静态测 定响应时间长,动态测定响应时间短,因此,在实际工作 中,通常采用搅拌试液的方法来加快响应速度。
ISE
nF
E 合并上述两式得
池
K
2.303RT nF
lg
a-
+
SCE
j
令k- φSCE+φj=K,则
E池
E
2.303RT nF
lg
a
(10-29)
式中,K的数值取决于内参比电极电位、膜内界面电 位和不对称电位、外参比电极电位和液接电位φj等。
00:05:32
二、标准曲线法——测定游离离子的活(浓)度
00:05:32
四、内阻
离子选择性电极的内阻主要是膜内阻,也 包括内充液和内参比电极的内阻。玻璃电极的 电阻高达107~109 Ω,PVC膜为106~107 Ω,晶 体膜为104~106 Ω.电极的电阻越高,要求测量 仪器的输入阻抗越高,而且越容易受外界噪声 的干扰,造成测量上的困难和误差
00:05:32
pHx
pHs
E E
s
x
2.303RT /
F
00:05:32
式中pHs已知,实验测出Es和Ex后,即可计算出试液的pHx 。IUPAC推
仪器分析-第10章 电位分析法

Instrumental Analysis第10章电位分析法10-4直接电位法y104 直接电位法电位滴定法y10-5 电位滴定法y10-6 电位分析法的应用5.掌握电位滴定法的测定原理和应用。
10‐1 概述电位分析法——是利用电极电电位分析法位与化学电池电解质溶液中某种组分活度(浓度)的对应关系而实现定量测定的一种电化学分析法。
学分析法●理论基础——Nernst方程式电位分析法特点电位法特点(1)灵敏度高(2)选择性好(3)仪器简单、操作方便,易于实现自动化(4)应用广泛()应用广泛10‐2 离子选择性电极Ion-Selective Electrodes (ISE)一、离子选择性电极的定义、结构和分类1、定义离子选择性电极是一种以电位法测定某些特定离子活度的指示电极。
其电极电位与溶液中给定离子活度的对数呈线性关系。
、离子选择牲电极的基本构造2、离子选择电造二、离子选择性电极的电位1、膜电位——离子选择电极膜电位是膜内扩散电位和膜与电解质溶液形成的内外界面的界面电位的代数和。
扩散电位——在两种不同离子或离子相同而活度不同的液液界面上,由于离子自由扩散速率离的不同所形成液接电位,称为扩散电位。
界面电位——膜与溶液接触时,膜相中可活动的离子与溶液中的某些离子有选择的发生互相作用,这种强制性和选择性的作用,从而造成两相界面的电荷分布不均匀产生双电层形成两相界面的电荷分布不均匀,产生双电层形成电位差,这种电位称为界面电位或相间电位。
膜电位——是膜内扩散电位和膜与电解质溶液形成的内外界面的界面电位的代数和。
三、玻璃膜电极1、pH玻璃电极的结构1pH玻璃电极的结构a a.单玻璃电极b.复合电极2、pH玻璃电极的响应机理pH玻璃电极膜电位形成示意图3、pH玻璃电极的特性(1)钠差(碱差)和酸差钠差——在pH≻9或含Na+浓度较高的溶液中,测得的pH比实际值偏低,引入的误差称为钠差(或碱差)。
酸差——在pH≺1或较高酸性条件下,测得的pH比实际值偏高,引入的误差称为酸差。
药物分析 第10章 电位
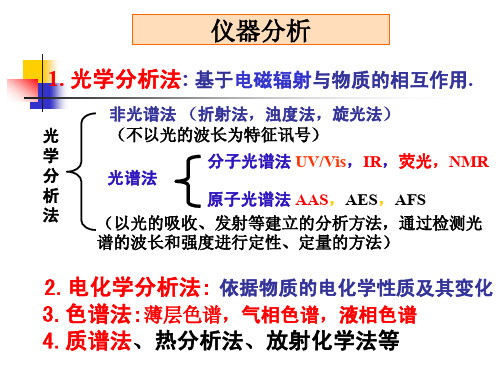
2.电化学分析法: 依据物质的电化学性质及其变化 3.色谱法:薄层色谱,气相色谱,液相色谱 4.质谱法、热分析法、放射化学法等
第十章 电位法及永停滴定法
Electrochemical Analysis
第一节 概述
电化学分析
电动势 电 流 电 阻 电 量
电位法 potentiometry 永停滴定法 dead-stop titration
写出下列电池的电池表达式
1、一银电极插入0.015mol/L AgNO3溶液,通过KNO3盐桥消除 液接电位,与一浸入0.028mol/L NiCl2 溶液的镍电极相连。
2、一锌电极插入0.04mol/L Zn(NO3)溶液,通过KCl盐桥消除液 接电位,与一浸入0.025mol/L HCl溶液的铂丝相连,HCl溶液以 0.5×105 Pa的H2饱和。 3、一铂丝插入含0.010mol/L Ce4+和0.050mol/L Ce3+ 的1mol/L 硫酸溶液中,通过多孔膜与一浸入含0.050mol/LmnO4-和 0.001mol/LmnO42-的1mol/L NaOH溶液中的金丝相连。
例:用下列电池按直接电位法测定草酸根离子浓度 Ag│AgCl│KCl(饱和) ║ C2O42- (未知浓度) │Ag2C2O4│Ag (1) 导出p C2O42-与电池电动势的关系式 (2) 若将一未知浓度的草酸钠溶液置入此电池,测得电动势为 0.402V,计算未知溶液的p C2O42-值。(φθAgCl/Ag=0.1990, φθAg+/Ag=0.7995V)
电导法 库仑法
第二节
一.电化学电池
电位法基础
定义:由两个电极插入适当的电解质溶液中组成
原电池 自发地将化学能转化成电能 电解池 消耗外电源的电能,使电池内部发生化学反应
药物分析中电化学法的应用

药物分析中电化学法的应用药物的质量控制是保证药物有效性和安全性的重要环节,而药物分析作为质量控制的手段之一,具有非常重要的作用。
在药物分析领域中,电化学法是一种常见的分析技术,它利用电化学原理和方法对药物进行分析和研究。
本文将介绍药物分析中电化学法的应用。
一、电化学法概述电化学是研究化学与电能之间相互转化的科学,其通过观察和测量电化学系统中的电荷转移和电荷传递过程,来研究各种化学现象。
电化学法在药物分析中的应用主要涉及到电位、电流、电荷等参数的测定,包括电位法、电流法、电导法、阻抗法等。
二、电化学法在药物分析中的应用1. 电位法电位法是一种通过测量电解质溶液的电位差来分析物质的浓度、活性等的方法。
在药物分析中,电位法可以用来测量药物溶液的pH值、离子浓度等参数,从而判断药物的结构、性质和质量。
2. 电流法电流法是利用电解质溶液中通过的电流来测定溶液中的离子浓度、物质的浓度等的方法。
在药物分析中,电流法常用于测量药物中含有的金属离子的浓度、有机物的含量等。
3. 电导法电导法是通过测量电解质溶液中的电导率来判断其中物质的浓度、离子性质等的方法。
在药物分析中,电导法可以用来判断药物溶液中的离子含量、溶解度等参数。
4. 阻抗法阻抗法是通过测量电解质溶液中交流电的阻抗来分析物质的浓度、活性等的方法。
在药物分析中,阻抗法可以用来判断药物中离子迁移速率、药物与生物体的相互作用等。
5. 循环伏安法循环伏安法是电化学法中常用的一种方法,它通过在电化学系统中施加周期性电压,来观察电流响应和电位变化,从而分析物质的电化学行为、电化学反应速率等。
在药物分析中,循环伏安法常用于药物的电化学检测、氧化还原行为分析等领域。
三、电化学法的优点与挑战1. 优点电化学法具有快速、灵敏、操作简便等优点,能够实现对药物样品的高效分析和监测。
2. 挑战电化学法在应用过程中需要注意电极的选择、溶液的条件、电位和电流范围等因素,同时也存在灵敏度不够高、难以分析复杂体系等挑战。
第十章电位分析

理论基础:能斯特方程(电极电位与溶液中待测离子 间的定量关系)。
对于氧化还原体系: Ox + ne- ⇌ Red
Ox/Red
O x/Red
RT nF
ln
aOx aRe d
若以 ln
aOx aRe d
为横坐标,实际电极电位 Ox/ Re d为纵
坐标,则得到一条直线,其斜率 S RT ,当 aOx 1时,
第十章电位分析
4. pH玻璃电极的特点
玻璃电极使用前,必须在水溶液中浸泡24小时,使玻 璃膜表面形成水合硅胶层,以便于表面的Na+与水中的H+ 交换。
⑴ 优点 a. 不受溶液中氧化剂、还原剂、颜色、沉淀及胶体、
杂质的影响,不易中毒; b. 高选择性:膜电位的产生不是电子的得失,其它离
子很难进入晶格产生交换。当溶液中Na+浓度比H+浓度高 1011倍时,两者才产生相同的电位;
内= k2 + 0.059 lg ( a2 / a2’ )
a1 、 a2 分别表示外部试液和电极内参比溶液的H+活度; a’1 、 a’2 分别表示玻璃膜外、内水合硅胶层表面的H+活度; k1 、 k2 则是由玻璃膜外、内表面性质决定的常数。
第十章电位分析
玻璃膜内、外表面的性质基本相同,则k1=k2 , a’1 = a’2
然后在相同条件下,测定未知液电池电动势为Ex , 设其酸度为pHx,则
Ex = Kx + 0.059 pHx
因为测定条件没有变化,Ks=Kx,所以
Ex – Es = 0.059 pHx-0.059 pHs
pHx
pHs
Ex Es 0.0592V
第十章电位分析
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
内参比电极: Ag-AgCl电极 内参比溶液: 一定pH的缓冲液
2. 原理 H+ + Na+GlNa+ + H+Gl-
2.303RT a1 V 1 K1 lg F a1'
2.303RT a2 V 2 K2 lg F a 2'
式中K1,K2是与玻璃表面性质有关的常数 K1=K2 a1′=a2′
仪器分析
1. 光学分析法: 基于电磁辐射与物质的相互作用.
光 学 分 析 法
非光谱法 (折射法,浊度法,旋光法) (不以光的波长为特征讯号) 光谱法
分子光谱法 UV/Vis,IR,荧光,NMR
原子光谱法 AAS,AES,AFS (以光的吸收、发射等建立的分析方法,通过检测光 谱的波长和强度进行定性、定量的方法)
2、滴定剂不可逆电对,被测物可逆电对
3、滴定剂可逆电对,被测物可逆电对
二.仪器装置
永停滴定与电位滴定法的比较
方法名称
电位滴定法
化学电池
电极体系
测定物理 量
终点确定
永停滴定法
三. 应用
1. 亚硝酸钠法
R [ R
NaNO2滴定芳胺
NH2 + NaNO2 + 2 HCl
+ N N ] Cl
+ 2 H2O +
2.电化学分析法: 依据物质的电化学性质及其变化 3.色谱法:薄层色谱,气相色谱,液相色谱 4.质谱法、热分析法、放射化学法等
第十章 电位法及永停滴定法
Electrochemical Analysis
第一节 概述
电化学分析
电动势 电 流 电 阻 电 量
电位法 potentiometry 永停滴定法 dead-stop titration
2.303RT ( EMF ) X ( EMF ) S ( pHX pHS ) F
( EMF ) X ( EMF ) S pHX pHS 2.303RT / F
第四节 电位滴定法
用标准溶液滴定待测物时,根据滴定过 程中指示电极的电位变化确定滴定终点的 滴定分析法.
适于无优良指示剂、混浊液、有色液的滴 定
例:涂有AgCl的Ag丝插入Cl-溶液中,称为Ag-AgCl电极 Ag︱AgCl, Cl-(acl-) AgCl + e→Ag + Clφ AgCl/Ag = φ °AgCl/Ag -0.059lgaCl证明下式成立 φ °AgCl/Ag = φ °Ag+/Ag + 0.059lgKsp
3.惰性金属电极
小结
例:下列电池
Ni│NiSO4(0.0250mol/l)║KIO3(0.100mol/l),Cu(IO3)2(s)│Cu
的电动势为0.482V,求Cu(IO3)2的Ksp。(φθNi2+/Ni=-0.231V, φθCu2+/Cu=0.337V)
例:已知下列原电池的电动势为0.621V Pt, H2(0.0250atm)│未知溶液║Cl-(1.00mol/l)│AgCl│Ag 求该未知溶液的pH
(-)Zn︱ZnSO4(xmol/L) ︱ CuSO4(ymol/L) Cu(+)
二、电池电动势
相界电位 φ 接界电位 液体接界电位 Ej
金属和溶液 两种不同溶液
E= φ+ - φ- + Ej
用盐桥消除
E= φ+ - φ-
1 已知Ni电极的标准电极电位是-0.23V,若将一个Ni电极插 入用Ni(OH)2沉淀饱和的1.00mol/L NaOH溶液中,则电极电位 如何变化? 2 有一原电池: Pt│Fe2+(0.02mol/L),Fe3+(0.01mol/L)║H+(1mol/L)│H2(1.01× 105Pa),Pt 说明下列情况下电动势的变化趋势:(1)在右侧半电 池中加入少量1mol/L HCl;(2)在左侧半电池中加入少量1M Fe2+;(3)降低右侧半电池的压力 3 设溶液中有CN-共存时,Fe3+/Fe2+的条件电位从0.77V降低 到0.36V,判断Fe3+和Fe2+哪个和CN-的络合反应的生成物更为 稳定。
Cu + Zn2+
(-)Zn︱ZnSO4(xmol/L) ‖CuSO4(ymol/L) ︱Cu(+)
(-)Zn︱ZnSO4(xmol/L) ‖CuSO4(ymol/L) Cu(+)
(-)电极a ︱溶液(a1) ‖溶液(a2) ︱电极b (+)
习惯: 1. 左为负极,右为正 2. ︱表示有接界电位 ‖表示盐桥 3. 电池内所有物质都要写出,注明物态,气体用压 力、温度表示,液体用浓度表示
一.应用
指示电极 酸碱滴定 玻璃电极 参比电极 饱和甘汞电极
沉淀滴定
络合滴定 氧化还原滴定 非水酸碱
银电极(Cl-,Br-,I-)
汞电极 铂电极 玻璃电极
饱和甘汞电极
饱和甘汞电极 饱和甘汞电极 饱和甘汞电极
二.电位滴定终点的确定
1. E-V曲线法 2. △E/△V—V曲线法(一级微商法) 3. △2E/△V2—V曲线法(二级微商法) 4.二级微商计算法 转折点 极大点 0
K pH
K 0.059 pH (25C )
F
二次测量法
先用已知pH值的标准缓冲液校正仪器 调节仪器上定位钮,使之定位,然后,用待测溶液测定 定位液与RT ( EMF ) S K pHS F
2.303RT ( EMF ) X K pHX F
电导法 库仑法
第二节
一.电化学电池
电位法基础
定义:由两个电极插入适当的电解质溶液中组成
原电池 自发地将化学能转化成电能 电解池 消耗外电源的电能,使电池内部发生化学反应
电极反应
原电池 负极 作用 (失电子) 正极 作用 (得电子)
阳极
Zn
Zn2+ + 2e
氧化
阴极
Cu2++ 2e
Cu
还原
总电池反应 Zn + Cu2+
NaCl
HNO2/NO为可逆电对 阳极 NO + H2O →HNO2 + H+ + e 阴极 HNO2 + H+ +e → NO + H2O
1.指示电极 参比电极 2.常用电极、电极反应、能斯特方程式会求会算,能与 酸碱、沉淀、络合平衡联系起来计算。 E=Φ +-Φ 3.溶液pH值的测定 指示电极: 玻璃电极 参比电极: SCE 不对称电位 酸误差 碱误差(钠差) 二次测量法,定位,强度校正,常用缓冲液,计算 4.电位滴定 各方法采用的指示、参比电极 四种确定终点方法 内插法计算 5.永停滴定法 可逆电对与不可逆电对 三种情况下电流变化情况 应用NaNO2法、卡氏测水法
例:用下列电池按直接电位法测定草酸根离子浓度 Ag│AgCl│KCl(饱和) ║ C2O42- (未知浓度) │Ag2C2O4│Ag (1) 导出p C2O42-与电池电动势的关系式 (2) 若将一未知浓度的草酸钠溶液置入此电池,测得电动势为 0.402V,计算未知溶液的p C2O42-值。(φθAgCl/Ag=0.1990, φθAg+/Ag=0.7995V)
惰性金属插入含有不同氧化态的离子溶液中组成
例:铂丝插入含有Fe3+,Fe2+的溶液 Pt︱Fe3+(aFe3+),Fe2+(aFe2+) Fe3+ + eFe2+ aFe3+ φ Fe3+/Fe2+ = φ °Fe3+/Fe2+ + 0.059lg a
Fe2+
4.膜电极
由固体膜或液体膜为传感体以指示溶液中某种离子浓
△2E/△V2=0
用内插法计算滴定终点
第五节 永停滴定法
一.原理 电流滴定法 两个相同的铂电极,外加一小电压,测定电流变化 可逆电对 电极反应是可逆 有电流 不可逆电对 电极反应不可逆 无电流 例:Na2S2O3滴定I2 I2/I-电对为可逆电对 S4O62-/S2O32-为不可逆电对
1、滴定剂可逆电对,被测物不可逆电对
SCE φ =0.241V 1mol/LKCl φ =0.280V
2.银-氯化银电极
例:计算下列原电池的电动势:
Hg│HgY2-(4.5010-5mol/L),Y4-(0.333mol/L)║SCE
已知:lgKHgY2-=21.8,φθHg2+/Hg=0.854V, φSCE=0.241V
第三节
写出下列电池的电池表达式
1、一银电极插入0.015mol/L AgNO3溶液,通过KNO3盐桥消除 液接电位,与一浸入0.028mol/L NiCl2 溶液的镍电极相连。
2、一锌电极插入0.04mol/L Zn(NO3)溶液,通过KCl盐桥消除液 接电位,与一浸入0.025mol/L HCl溶液的铂丝相连,HCl溶液以 0.5×105 Pa的H2饱和。 3、一铂丝插入含0.010mol/L Ce4+和0.050mol/L Ce3+ 的1mol/L 硫酸溶液中,通过多孔膜与一浸入含0.050mol/LmnO4-和 0.001mol/LmnO42-的1mol/L NaOH溶液中的金丝相连。
2.303RT a1 Em V 1 V 2 lg F a2
2.303RT K ' lg a1 F
E玻 Em EAgCl / Ag
2.303RT K ' EAgCl / Ag pH F
(1) 钠差 pH>9时,碱误差
pH<9 Na2O CaO SiO2 pH1-14 Li2O Cs2O La2O3 SiO2
