有机化学含氮和含磷有机化合物
有机化学课件——Chapter 11 含氮和含磷有机化合物

C6H5NH3+ · Cl氯化苯铵
(C2H5NH3+)2 · SO42硫酸二乙铵
(CH3)3N+CH2C6H5 · Br- [(C2H5)2NH2+]2 · SO42溴化三甲基苄铵 硫酸二(二乙铵)
??? ???
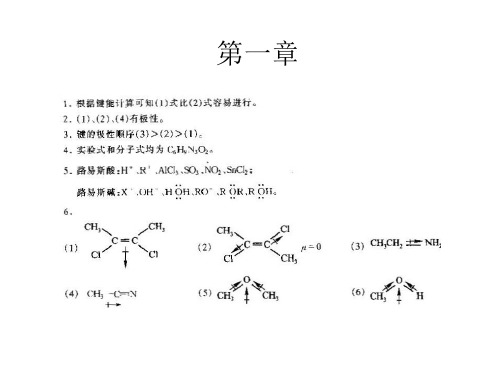
C4H9N+ · OH四丁基氢氧化铵
有机化学课件
(C2H5)2NH2+ · HSO4硫酸氢二乙铵
有机化学课件 22 第11章 含氮和含磷有机化合物
一、胺的碱性
N上的未共用电子对能接受一个质子,能与大多数的无机酸成 盐,所以胺具有碱性.
R
NH2 + HCl
R
+NH Cl 3
碱性强弱顺序: 脂肪胺 > NH3 > 芳香胺 pKb 3—4.5 4.75 9—10
在脂肪胺中: RNH2 < R2NH > R3N 一级 二级 三级
Na+
(2) 与羰基化合物缩合
CH3 NO2
-
CH2 NO2
O + R C R'(H)
H2O
OH R C CH2NO2 R'(H)
有机化学课件
10
第11章 含氮和含磷有机化合物
五、硝基对芳环的影响
硝基是强吸电子基, 当其与苯环直接相连时, 使芳环上的亲电取代 反应活性降低, 以致不能进行(如F-C反应). 但在卤代芳烃卤原子(如-Cl)的邻、对位引入-NO2时,卤原子的 反应活性增加,易于发生亲核取代反应.
有机化学课件 25 第11章 含氮和含磷有机化合物
二、胺的酸性
伯、仲胺中N-H键可以电离.
R2NH
R 2N - + H +
人民卫生出版社-有机化学 第10章 氮、磷化合物

NaNO2 + HCl
HO−N=O + NaCl 亚硝酸
四川大学化学学院 四川大学化学学院
41 41
伯胺 伯胺与HNO2反应生成重氮盐(重氮化反应)。
脂肪重氮盐 氨基酸和多肽的定量分析
醇、烯、卤代烃 等混合物
芳香重氮盐 (氯化重氮苯)
四川大学化学学院 四川大学化学学院
42 42
干燥的重氮盐通常极不稳定,受热或振荡易爆炸。升高 温度重氮盐会逐渐分解放出氮气,反应通常在低温下进行。
45 45
叔胺 脂肪叔胺氮上没有H,不发生亚硝化作用,与HNO2 作 用生成不稳定易水解的盐,若以强碱处理,则重新游离析出 叔胺。
(弱酸弱碱盐)
四川大学化学学院 四川大学化学学院
46 46
芳香叔胺与 HNO2 作用生成对-亚硝基胺。
对位被占的芳香叔胺与 HNO2作用发生邻位取代。
N,N-二甲基-4-亚硝基苯胺 (绿色晶体,mp 86 ℃ )
伯胺
仲胺
四川大学化学学院 四川大学化学学院
38 38
强吸电子 基团
显一定酸性
2
2
3
(溶于水)
Hinsberg(兴斯堡)试验——鉴别伯、仲和叔胺。
四川大学化学学院 四川大学化学学院
39 39
磺胺 (对氨基苯磺酰胺)
四川大学化学学院 四川大学化学学院
40 40
与亚硝酸的反应 胺与亚硝酸(HNO2)作用,伯、仲、叔胺各不同, 脂肪胺与芳香胺有差异;可用于鉴别。 亚硝酸是不稳定的弱酸,只能在反应过程中由亚硝酸 盐与盐酸或硫酸作用产生。
?
四川大学化学学院 四川大学化学学院
34 34
酰胺N采取sp2杂化,与羰基形成p-π共轭,使C-N键具有 部分双键性质。 由于羰基的吸电子作用,大大降低了N上电子云密度, 使酰胺N的碱性极弱(比水的碱性还弱,强酸也不容易使其 质子化)。
有机化学

+ I (CH3CH2)4N
碘化四乙铵
(CH3CH2)3N OH CH3
氢氧化甲基三乙铵
+
练习题
NHCH3
[ (CH3)2N(C 2H5)2] I
+
N-甲基苯胺
NH2
碘化二甲基二乙基铵
CH3CHCHCH2CH3 CH3
3-甲基-2-氨基戊烷
二.胺的物理性质(自学)
三.胺的化学性质 胺的分子结构
●●
4.与亚硝酸反应 脂肪族伯胺
R NH2 NaNO2 HCl
0-5℃醇、烯、卤代烃
N2
放出的氮气是定量的,可用于氨基的定量分析 。
芳香族伯胺
Ar NH2
0
NaNO2 HCl
。 5C
[Ar
N N]Cl
H2O
NaCl
芳香胺重氮盐 低温稳定,室温分解成酚和氮气
仲胺与亚硝酸反应
R2NH NaNO2 HCl R2N N O (黄色油状)
重氮化反应应用
可以制备一些不能用直接方法制备的化合物
NO2 浓HNO3 浓 H2SO4 N2+ClNaNO2 HCl
0 5。 C
NH2 Fe HCl
NH2 Br2 H2O Br Br Br
Br Br
Br
H3PO2
Br Br
Br
(2)偶联反应
重氮盐与芳香叔胺类或酚类化合物在弱碱性、中性或弱 酸性溶液中发生反应,生成偶氮化合物,称为偶联(偶合) 反应。
CH3 N CH2CH3
N
CH2CH3
Cl
N-甲基-N-乙基环戊胺 H2NCH2CH2 CH2 CH2 NH2 1,4-丁二胺(腐胺)
N-甲基-N-乙基-4-氯苯胺 CH3CH2NHCH2CH2CH3 乙、丙胺
含氮和含磷有机化合物

第十章含氮和含磷有机化合物I学习要求1.熟悉伯、仲、叔胺与伯、仲、叔醇和伯、仲、叔卤代烃的区别。
2.掌握胺、酰胺、硝基化合物、重氮盐和偶氮化合物的命名。
3.熟悉氨、脂肪胺及芳香胺的结构。
掌握氨、胺和铵的区别以及磷和膦的区别4.熟练掌握胺、酰胺、硝基化合物和重氮盐的化学性质及胺的分离提纯方法。
5.掌握氨基的保护及在合成中的应用。
II内容提要一. 胺的定义、分类和命名(略)应当注意伯、仲、叔醇指的是羟基分别与伯、仲、叔碳原子相连的醇,而伯、仲、叔胺指的是氮原子与一个、两个、三个烃基相连的胺,与氮原子所连碳的种类无关。
如(CH3)3COH是叔醇,而(CH3)3CNH2是伯胺。
二. 胺的性质1.碱性:在水溶液中,胺的碱性强弱顺序为:脂肪胺>氨>芳香胺。
脂肪胺在气相或非水溶液中的碱性与电子效应结果相一致:叔胺〉仲胺〉伯胺。
脂肪胺在水溶液中的碱性受多种因素影响,一般情况下,仲胺表现出较强的碱性。
就甲胺、二甲胺、三甲胺来说,其碱性强弱顺序为:二甲胺〉甲胺〉三甲胺。
芳香胺的碱性强弱顺序与电子效应、溶剂效应、位阻效应相一致。
即苯胺〉二苯胺>三苯胺。
2.烷基化反应:1)RX1)RXRX -AgO+_RNHRNHRN"22)OH-22)OH-37'」"H2O43.酰基化反应:汽RNH2I RCCl—RNHCR严R2NH+R'CCl—R2N-C-R'酰胺是结晶固体,可通过测熔点确定原来的胺,叔胺无此反应,可用于定性鉴定伯胺和仲胺,也可用于叔胺与伯胺和仲胺的分离。
酰胺在酸碱催化下水解得到原来的胺,可用酰基化反应保护氨基。
如:[O] NHCOCH3H_OOH-NHCOCH3H3NH2 CH3COCl-H3 OOH OOHNH2I24.磺酰化反应:RNH 2+匚-SO 2C1R 2NH 0~SO 2C^JNaOHN -RNa +(溶于NaOH 溶液)R 3N +.__SO 2C1该反应可用于鉴别和分离伯、仲、叔胺。
有机化学(第二版)答案__赵建庄
另一组答案为: A.
B. H3C CH2 CH2 CH2Br
C. H3C CH 2 CH CH2
10.
氧化后得到的
对称二酮为:
11.
反应式如下:
12. 透视式
纽曼式
第五章 卤代烃习题参考答案
1. (1) 2-甲基-4-氯戊烷 (3) 4-溴-1-环己烯 (5) 2-氯-4-溴甲苯
(2) 2-氯-2-己烯-4-炔 (4) 苄溴(溴化苄,苯溴甲烷) (6) 3,6-二氯-2-甲萘
H+ -H2O
H3C C CH CH 2 CH3 CH3
+ (1) O3
(2) Zn, H2O H3C CH 2 CHO
O H3C C CH3
丙醛可发生银镜反应,丙酮可发生碘仿反应。
第十章 羧酸、羧酸衍生物和取代酸 参考答案
1. (1) 3-甲基丁酸
(2) 3-乙基-3-丁烯酸
(3) 2,3-环氧丁酸
(4) 1,3-(间)苯二甲酸
(5) 2,4-二氯苯氧乙酸
(6) 反-1,2-环丙二甲酸
(7) 4-甲基-2,4-戊二烯酸
(8) 2-甲基丁酸
(9) 3-(间)甲基苯甲酰溴 (10) 乙酸对甲基苯酯
(11) N-甲基-N-乙基甲酰胺 (12) 乙丙酐
(13) 二乙酸乙二酯
(14) γ –丁内酯
(15) 2-甲基-3-丁酮酸
2.
3. (1)
(2)
(3)
(4)
(5)
4. (1)
(2)
5. (1)
+ CH3I
(2)
O
(3)
(4) 2 H3C C CH3
(5)
(6)
,
环磷酰胺的化学结构

环磷酰胺的化学结构
环磷酰胺是一种重要的有机化合物,其化学结构包含磷和氮元素。
具体来说,
环磷酰胺是通过磷酸和胺类化合物之间的缩合反应得到的环状产物。
它的分子结构通常表现为一个含氮的环与一个含磷的环相连,形成一个磷-氮键连接的环状结构。
环磷酰胺的化学结构使其具有许多重要的化学性质和应用。
首先,磷-氮键的
存在赋予环磷酰胺较高的反应活性,使其在有机合成中被广泛应用。
环磷酰胺可以通过开环反应生成氮化合物或磷酸酯,从而参与到各种有机合成反应中。
其次,环磷酰胺还具有较好的溶解性和稳定性,使其成为许多聚合物和胶体材料的重要组成部分。
另外,环磷酰胺还被广泛用作农药、医药和功能材料的中间体。
例如,环磷酰
胺可以被用作杀虫剂的原料,通过改变其侧链结构可以调控其杀虫活性和环境友好性。
在医药领域,环磷酰胺及其衍生物被用作抗肿瘤药物、抗生素和抗病毒药物的合成中间体,具有重要的药理活性。
此外,环磷酰胺还可以作为材料表面改性剂、离子交换树脂的功能单体等领域的重要应用。
总的来说,环磷酰胺的化学结构和性质决定了其在有机合成、聚合物材料、医
药和功能材料领域的重要应用。
随着研究的深入,环磷酰胺的化学结构和功能还有待进一步挖掘和应用,为更多领域的发展提供新的可能性。
大学有机化学含氮和含磷有机化合物

磷酸酐
具有酸酐的性质,易水解, 可发生酯交换反应。
04 含氮和含磷有机化合物的 反应机理
亲核反应与亲电反应
亲核反应
亲核试剂进攻带正电荷或电子密度较高的中心,形成稳定的 负离子中间体。例如,胺的烷基化反应中,醇进攻胺的N原 子,形成负离子中间体。
亲电反应
亲电试剂进攻带负电荷或电子密度较低的中心,形成稳定的 正离子中间体。例如,硝基化合物的取代反应中,亲电试剂 进攻硝基的碳原子,形成正离子中间体。
大学有机化学:含氮和含磷有机化 合物
目 录
• 引言 • 含氮有机化合物 • 含磷有机化合物 • 含氮和含磷有机化合物的反应机理 • 含氮和含磷有机化合物的生物活性与药物设计 • 结论
01 引言
主题简介
含氮和含磷有机化合物是大学有机化 学中一个重要的研究领域,主要涉及 氮和磷元素在有机分子中的存在形式 、性质、合成和反应机制。
腈的合成
通过烃基与氰化物的反应或重氮化反应制备。
代表性化合物与性质
010203 Nhomakorabea苯胺
无色油状液体,有强烈气 味,能溶于水,有毒,是 制造染料、药物等的原料。
硝基苯
无色至淡黄色晶体,有苦 杏仁气味,有毒,是制造 炸药、染料等的原料。
丙烯腈
无色液体,有刺激性气味, 易聚合,是制造合成纤维、 合成橡胶的原料。
建议四
加强跨学科合作。含氮和含磷有机化合物的研究涉及化学 、生物学、医学等多个领域,加强跨学科合作有助于推动 研究的深入发展,实现创新突破。
THANKS FOR WATCHING
感谢您的观看
03
这类抗生素主要通过抑制细菌DNA复制和蛋白质合成发挥抗菌
作用,如四环素和强力霉素等。
V707-有机化学-第7讲 习题及问题及参考答案

第七讲 有机含氮化合物和含磷化合物习题p377. 练习题11.13(2) p414. 练习题13.4p425. 练习题13.11(5) 练习题13.12(2) p433. 练习题13.15(2)p449 练习题14.1(2) 练习题14.2(1)(4)(5)(6) p455 练习题14.6(1) p456 练习题14.8p460 练习题14.11(2)(4) p471 练习题14.14(1) p480 练习题14.17(2) p384~386. 习题1.(3)(7)(8)2.3.(1)(4) 10.(4) p440~443. 习题1.(1)(4)(5)(6)(8)(12)2.(6)(7)(8)(11)(16) 6.(4) 7. 9. p481~484 习题 1.(5)(6) 2.(1)(2)(4)(9)3.(2)(3)(11)(13) 9.(1) 10. 12.补充题1.写出下列化合物的结构式:(1)乙酰苯胺 (2)邻-甲基苄胺 (3)氢氧化四甲铵 (4)三苯基膦 (5)4-甲基-2-羟基偶氮苯 (6)碘化三甲基乙基铵 2.排出下列各组化合物的碱性由强到弱的顺序: (1)乙胺、二乙胺、乙酰胺、氢氧化四乙铵; (2)二苯胺、苯胺、邻-苯二甲酰亚胺、苄胺; (3)对-甲苯胺、苯胺、对-硝基苯胺 3.完成下列反应( )( )34H 2NOCH CH 3NHCH 2CH 32~4.用简便的化学方法鉴别下列化合物:N -甲基苯胺、邻-甲苯胺、N,N -二甲基苯胺、环己胺 5.请将下列反应过程中空缺的试剂和产物补充完整。
磺胺类药物基本骨架的合成途径如下:NH 2NHCOCH3ClSO 2OHNHCOCH3SO 2ClNH 32-(1) (CH 3CH 2)3N + HBr (2)H 3CH 2C NH 20~5℃6.某化合物D分子式为C5H13N,具有旋光性。
与亚硝酸钠的硫酸溶液反应得到化合物E(C5H12O)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
R'2NCOR + HCl
不反应
SO2NHR
NaOH SO2N-Na+ R
SO2Cl + RNH2
SO2Cl + R2NH
SO2NR2
SO2Cl + R3N
不反应
这个方法既可分离又可鉴别伯、仲、叔胺,
该反应称为兴斯堡反应
4、胺与亚硝酸的反应
(1)伯胺的反应 脂肪族伯胺 NaNO2 + (RN HNO RNH2 + N)Cl 2
138℃
89.3℃
93.5℃
四、 胺的化学性质
1、胺的碱性
+ RNH2 + H Cl
RN H3Cl
RN H3 +
+
+
-
RNH2 + H2O
OH
-
RN H3Cl + NaOH
+
-
RNH2 + NaCl + H2O
结构对碱性的影响: 诱导效应
R3N > R 2NH > RNH 2
共轭效应 空间效应
NH2 < NH3
N(C 2H5)2 CH3CH-CH2-CH-CH3 CH3
2-甲基-4-(N,N-二乙氨基)戊烷
4-氨基-2-甲基戊烷
◇季铵类化合物
(CH3CH2)4N+Cl氯化四乙胺 季铵盐)
CH3 + CH3CH2N CH3OH CH3
+(CH3)2NH2 OOCCH3
氢氧化三甲乙铵(季铵碱)
CH3 H 3C N CH3 CH2CH2OH + OH -
乙酸二甲铵 (二甲胺乙酸盐)
氢氧化-三甲基 (2-羟乙基)-铵
二、 胺的结构
胺与氨的结构相似,氮原子是SP3不等性杂化
H H
N H
H H
N CH3
CH3 H3C
N CH3
N
H H
NH2
三、胺的物理性质
状态和气味:低级胺为气体或易挥发的液体, 有与氨相似的气味;高级胺为固体,近乎无味; 二甲胺和三甲胺有鱼腥味。 溶解度:胺与水能形成氢键,因此低级胺较易 溶于水;随着碳原子数的增加胺在水中的溶解性 逐渐下降。
HCl
重氮盐
H2O
ROH + N2
+ HCl
芳香族
NH2 + HNO2 0~5℃
(NaNO2 +HCl)
N+ NCl- + NaCl + H2O
(2).仲胺的反应: 脂肪族: R2NH + HO-NO 芳香族
NHCH3
(NaNO2 +HCl)
R2N-NO
黄色油状
N-亚硝基化合物
NCH3 黄色油状 NO
第二节 重氮盐和偶氮化合物 一 放氮反应 二 保留氮的反应 第三节 硝基化合物 一 硝基化合物的结构 二 硝基化合物的物理性质 三 硝基化合物的化学性质 第四节 含磷有机化合物
学习要求:
1.掌握胺的分类、命名及区别伯、仲、叔胺方法 2.熟练掌握胺、酰胺的化学性质 3.掌握重氮盐的反应和偶合反应在有机合成中的 应用。 4.掌握一些其他含氮化合物的重要性质 5.了解季铵盐和季铵碱的特性
(CH3)2NH > CH3NH2 > (CH3)3N > NH3 > NH2 > ( )2NH > ( )3N
pKb 3.27
3.35
4.22
4.75
9.28
12.8
15
NH2 G
NH2 a OCH3 b
给电子基碱性增强 吸电子基碱性减弱
比较下列化合物碱性:
NH2 c CH3 Cl NH2 d NO2 NH2 e NH2
a>b >e>c>d
R4N Cl
+
-
Ag2O H2O
R4N+OH- + AgCl
季铵碱的碱性可与KOH 、NaOH相比。 2、烷基化反应
RX + NH3
RNH2 RX R2NH
RNH2 + HX
RX
R3N
RX
R4N X
+ -
3、酰基化反应
RCOCl + R'NH2
R'NHCOR + HCl
RCOCl + R' 2NH
第十章 含氮有机化合物
有机含氮化合物的种类很多,范围也很广,它们的结 构特征是含有碳氮键(C—N、C=N、C≡N),有的还含有 N—N、N=N、N≡N、 N—O、N=O 及N—H键等。
RNH2 , R 2NH , R 3N
RCONH2
酰胺
RCN
胺 RNH-NH2
肼
腈
R-N=N-R
偶氮化合物
RNO2
HO-NO
(NaNO2 +HCl)
NCH3 NO
H+ ON
NHCH3 兰绿色
对亚硝基-N-甲基苯胺
(3) 叔胺
R3N + HNO 2
(NaNO2 +HCl)
R3N+HNO2-
N(CH3)2
HO-NO
(NaNO2 +HCl)
ON
N(CH3)2 绿色
对亚硝基 -N,N-二甲基苯胺
5、芳香胺的特殊反应 (1)氧化反应
硝基化合物
第一节
一、胺的分类及命名
胺
1.胺的分类 根据胺中烃基种类的不同,可分为: 脂肪族胺 芳香族胺
NH2 苯胺
混合胺
NHCH3 N-甲基苯胺
CH3CH2NH2 乙胺
根据分子中氨基的数目分为: 一元胺、二元胺、 多元胺。 NH2CH2CH2NH2 CH3NH2
甲胺(一元胺)
乙二胺(二元胺)
根据氮原子连结烃基的数目分为:伯胺、仲胺、 叔胺和季铵化合物
沸点:伯胺和仲胺分子间可形成氢键,但比
醇分子间的氢键要弱,所以分子量与醇相近的伯胺 它的沸点与分子量相近的烃相近。
CH3(CH2)4NH2 CH3(CH2)3CH2OH (CH3CH2)3N (CH3CH2)3CH
、仲胺的沸点要低于醇。叔胺分子间不能形成氢键,
分子量 87
88
101
100
沸点104.4℃
R3N < R2NH < RNH2 NH2 < NH3
同诱导效应相反
同共轭效应一致
溶剂化效应
R H N H H O H2 O H2 O H2 > R R N H H O H2 O H2 > R R N R H O H2
共轭酸稳定性好,酸性弱,碱性强。
1°胺>2°胺>3°胺
综合各种因素,各种胺的碱性强弱顺序如下:
NH2 KMnO4+H2SO4
CH 3NH2 (CH 3)2NH (CH 3)3N (CH 3)4N+Cl 氯化四甲胺 (季铵盐)
甲胺 (伯胺)
二甲胺 (仲胺)
三甲胺 (叔胺)
2、命名
◇简单的胺可根据其烃基来命名,即在胺字前写
出烃基的数目及名称
(CH3CH2)2NH
N CH3 CH2CH3
CH 3NHC2H5
二乙胺
N-甲基-N-乙基环丙胺
乙醇胺
甲乙胺
NH2CH2CH2OH
◇N原子上同时连有脂烃基和芳烃基时,以芳胺为母体,
并在脂烃基前冠以“N”字。
N( CH3)2
H3C N CH(CH3)2 NO2
CH3
N,N-二甲基对甲苯胺
N-甲基-N-异丙基 邻硝基苯胺
◇复杂的胺
以烃作母体氨基作为取代基来命名
CH3 NH2 CH3CHCH2CHCH3
