含硫含磷和含硅有机化合物
16-有机硫、磷和硅的化合物
2. 磺酸的制备
(1) 直接磺化法
H3C SO3
H3C 97%
SO3H + H3C SO3H
H+
(2) 间接磺化法
Na2SO3 + CH2Cl
CH2SO3Na
CH2SO3H
Cl NO2 Na2SO3 NO2
SO3Na NO2 H+ NO2
SO3H NO2 NO2
(3) 磺酸的物理性质 磺酸具有极强的吸湿性,不溶于一般的有机溶剂而易溶于水。在有机分 子中引入磺基,可显著地增加其水溶性。
CH3CH2SO3H
工业上的应用
KMnO4, H+
强氧化剂 = HNO3
(3) 亲核反应
亲核性:RS- > RO-, ArS- > ArO(a) 亲核取代反应
CH3CH2SNa + (CH3)2CHCH2 Br H2O (CH3)2CHCH2SCH2CH3 + NaBr
SNa + CH3
I
SCH3 + NaI
(3) 两性表面活性剂
+ C12H25N(CH3)2CH2COO-Na+
N C11H23 C + N HOCH2CH2 CH2COO-Na+
(4) 非离子表面活性剂
在水中不解离成离子,其亲水基是可以与水形成氢键的醚键中的氧原子
C12H25O CH2CH2O
n
H
C8H17
O
CH2CH2O n H
(5) 特殊类型的表面活性剂
锍盐,烷基化试剂
+ NH2 + CH3SCH3 CH3
+ S(CH3)2
CH3CH2CH2
含硫和含磷有机物

磷酸化法
总结词
磷酸化法是通过将磷酸根离子连接到有机分 子中的碳原子上,生成含磷有机物的方法。
详细描述
在磷酸化法中,通常使用磷酸或磷酸酯作为 磷源,与有机分子中的碳原子发生亲核取代 反应,生成含磷有机物。此方法广泛应用于
合成农药、染料、香料等精细化学品。
氧化法
总结词
氧化法是通过将含硫或含磷有机物与氧化剂反应,引入 氧原子或氧基团的方法。
有机化合物,具有酸性、润滑性、乳化 性等特点。
VS
详细描述
磷酸酯是一种有机化合物,具有酸性、润 滑性、乳化性等特点。在石油、化工、纺 织等领域有广泛应用。
焦磷酸酯
总结词
高分子化合物,具有热稳定性、阻燃性、绝 缘性等特点。
详细描述
焦磷酸酯是一种高分子化合物,具有热稳定 性、阻燃性、绝缘性等特点。在电线电缆、 建筑材料、涂料等领域有广泛应用。
除草剂
含硫和含磷有机物在除草剂的合成中具有重要作 用,如草甘膦和百草枯等。
杀虫剂
含硫和含磷有机物在杀虫剂的合成中也有广泛应 用,如马拉硫磷和敌敌畏等。
杀菌剂
含硫和含磷有机物在杀菌剂的合成中也有应用, 如代森锰锌和福美双等。
染料领域
01
02
03
酸性染料
含硫和含磷有机物在酸性 染料的合成中具有重要作 用,如酸性媒介染料和酸 性络合染料等。
柠檬烯
含硫和含磷有机物在柠檬烯的合成中 也有广泛应用,如柠檬烯类香料等。
04
含硫和含磷有机物的合成方 法
磺化法
要点一
总结词
磺化法是一种常用的合成含硫有机物的方法,通过将硫磺 或硫化物与烃类化合物反应,将硫原子引入有机分子中。
要点二
详细描述
【有机化学】含硫、磷和硅的化合物

Wittig试剂
=CHR + O=PPh3
维悌希反应的特点: 1 反应温和 低温条件 2 具有区域特异性 碳氧双键被碳碳双键替代 3 烯键、炔键、-OR、 -COOR不受影响
反应机理:四元环过渡态
+ Ph3+P--CR2
R' C=O
R'
反应活性 :醛〉酮〉酯
+ Ph3P
-O
CR2 CR'2
+ Ph3+P-O-
思考:如何除去石油中的硫醇?
2. 氧化还原反应
A 硫醇的氧化 发生在硫原子上
2R-SH
[O]
弱氧化剂
RSSR + H2O
2CH3CH2SH + I2 +2NaOH 2CH3CH2SSCH2CH3+2NaI+2H2O
C2H5SSC2H5
Li, NH3 H3O+
2C2H5SH
弱氧化剂:三氧化二铁、二氧化锰等金属氧化物,碘或氧气。
O
.. (CH2O)2PCH2CO2CH3 NaH (CH3O)2PC-HCO2CH3 Na+
(CH3)C=O
O
+ (CH3)2C=CHCO2CH3
(CH3O )2PO-N+a
优点:易反应、易分离、立体选择主要是反式的烯烃
例题分析:19-2 (CH3O)3P + BrCH2CO2CH3
NaH
+-
PhCOCH3 + (CH3O)2POCHCO2CH3
TM
C H3O C 6H4C HO
Ph3+PC-HC N
TM
第三节 有机硅化合物
自习 有机硅试剂 TMS 四甲基硅烷
硫、磷和硅的化合物

E型为主 注意:Wittig反应是一个在精细合成中非常有用
的 反 应 ,Wittig 因 此 而 获 得 诺 贝 尔 化 学 奖 。 但
Wittig反应在今天却不符合绿色化学的要求。
15
例:
O
+
Ph3P CH 2
CH 2
原子利用率=96/ (96+278)=26% 此反应为了利用原料276份质量中的14份质量, 产生了278份质量的“废物”,反应的原子利用 率仅为26%。 练习:从合适原料合成
O CH 3SCHCC 6H5 CH 2C6H5
CH 2C6H5
斯提文(Stevens)重排: 在碱性条件下,含有活泼 亚甲基的锍盐及铵盐进行的重排,结果S+ 、N+ 上的基 团重排到邻位亚甲基。
8
O (CH3)2NCH2CC6H5 CHC6H5 CH3
CH3 OH
O
O (CH 3)2NCHCC 6H5 CHC 6H5 CH 3
O
硫酸二甲酯 硫酸二乙酯
11
CH 3CH 2O S OCH 2CH 3 O
OH
(CH 3)2SO4 OH
OCH 3
O RO + CH 3 O S O O CH 3
ROCH 3 +
O O S O CH 3 O
12
二. 含磷化合物
RPH2
R2PH
R 3P
R4PX
伯膦
仲膦
叔膦
季
维悌希(Wittig)反应:
H3C N CH CC6H5 CHC6H5 CH3
2). 锍碱的热分解反应 同季铵碱热分解
CH 3CH 2CH CH 2 + CH 3SCH 3 H 2O
第十五章 含硫含磷和含硅化合物

2. 成键特点:
S R C
·
(1)利用3P轨道形成键(不稳定):
硫醛
S R C R
·
硫酮
H
·
·
只有少数含这样 π键的硫化合物,二硫化碳、硫脲、硫代 C S C O 羧酸及其衍生物是稳定的。
磷、硅原子的3p轨道更难形成π键。 原因:硫的3p轨道比较扩散,与碳的2p轨道不能有效重
叠,所以3p轨道形成的π键不稳定。
第一节
1. 电子结构: O:1s22s22p4 N:1s22s22p3 C: 1s22s22p2 电子结构特点:
磷硫硅原子的成键特征
S:1s22s22p63s23p43d0 P:1s22s22p63s23p33d0 Si: 1s22s22p63s23p23d0
①价电子位于第三电子层,虽然价电子构型和氧、 氮、碳相似,可形成相似的化合物,但原子比氧、氮、 碳体积大,电负性小。 ②存在3d空轨道,由于这些d轨道的存在和参与成键 ,可形成不同于氧、氮和碳的高价化合物。
C、硫醇的氧化
弱氧化剂:
RSH
+
I2(H2O2、O2)
+ KMnO /H + 4
RSSR
+
HI
强氧化剂:
RSH
RSO3H
NH2 SCH2 CHCOOH SCH2 CHCOOH NH2
2 HSCH2CHCOOH NH2
[O ] [H]
D、硫醇的亲核取代反应
-
RS
+
R'
X
R'SR
制备硫醚的方法
亲核性:RS-的亲核性比RO-强得多,碱性较弱
亚砜和砜,在相应的类名前加上烃基的名称即可。
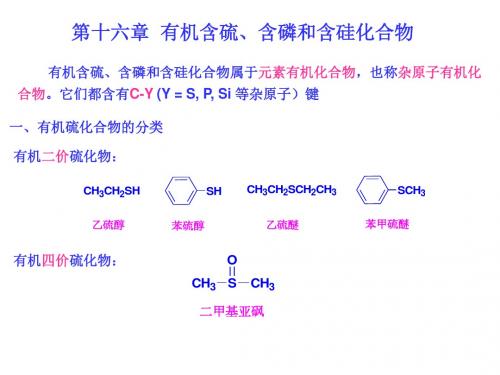
有机含硫含磷和含硅化合物
SH
CH3CH2SH
CH3CH2SCH2CH3
SCH3
乙硫醇 硫酚 乙硫醚 苯甲硫醚
有机四价硫化物: O
CH3 S CH3
二甲亚砜(DMSO)
第6页,共42页。
有机六价硫化物:
O
O
O
CH3CH2 S CH2CH3 CH3
S OH CH3 S Cl
O
O
O
CH3OH 95%
(CH3)3CS CH2 CH2 C N
(c) 硫醇与碳氧双键的亲核加成反应
醛和酮 加成反应 硫缩醛或硫缩酮
催化氢化 脱硫
O R C R +CH2 CH2 H+
SH SH
R S CH2 C
R S CH2
H2 / 兰尼Ni RCH2R + NiS + CH3CH3
第11页,共42页。
CH3CH2CH2 NH2 + CH3 S(CH3)2 CH3CH2CH2 NH2 + CH3SCH3
16.4 磺酸(sulfonic acids)
CH3
磺酸: 硫酸分子中羟基被烃基替代后的
化合物
O R S OH
O
Ar SO3H
磺基
芳磺酸 (aromatic acids)
第14页,共42页。
16.4.1 磺酸的命名
SO3H NO2
NO2
NO2
NO2
(98%)
第16页,共42页。
16.4.3 磺酸的物理性质 16.4.4 磺酸的化学性质 反应部位:
磺基的反应
O
Ar S O H
酸性
芳环上亲电 O 取代反应
《有机化学1A》和《有机化学1B》教学大纲
《有机化学1A》和《有机化学1B》教学大纲课程编号:2100300,2100301学时:96学时(讲课:96 学时,实验:0 学时)学分:6授课学院:天津大学理学院, 药学院,化工学院,材料学院,环境学院适用专业:化学、药学、应用化学、材料化学、环境科学教材:《有机化学》(第四版)主编:高鸿宾出版社:高等教育出版社出版时间:2005年5月主要参考资料:[1]Solomons T W G,Fryhle C B.Organic Chemistry[M].10th ed.Hoboken:John Wiley &Sons,Inc,2011.[2]Carey F A, Giuliano R M.Organic Chemistry[M].8th ed.New York:McGraw-HillCompanies,Inc,2010.[3]McMurry J.Organic Chemistry[M].7th ed.Belmont:Brooks/Cole Publishing Company,2008.[4]Peter K,V ollhardt C,Schore N E.Organic Chemistry: Structure and Function.4th ed.戴立信,席振峰,王梅祥,等译.有机化学:结构与功能[M].北京:化学工业出版社,2006.[5]邢其毅,裴伟伟,徐瑞秋,等.基础有机化学上下册[M].3版.北京:高等教育出版社,2005.[6] 张文勤, 郑艳, 马宁, 赵温涛. 《有机化学》(第五版).北京:高等教育出版社,2014.一.课程性质、目的和任务有机化学是化学、化工类及其相关专业本科生的必修基础课,主要讲授有机化合物的结构、性质及其相互转化的规律。
通过本门课程的学习,使学生掌握有机化学的基本概念、基本理论、基本有机反应及有机化合物结构与性能之间的关系,了解常见有机化合物在化工生产中以及人们日常生活中的地位和作用,提高学生的认知能力,培养学生的创新思维能力。
有机、第十六章 有机含硫、含磷和含硅化合物
运城学院
§16.9.3 卤硅烷的化学性质 一、水解 Si-X键具有较强的极性,很活泼,极易水 解。反应需在中性介质中进行。
在酸或碱的作用下,硅醇脱水反应生成硅醚:
应用化学系
运城学院 二、醇解 卤硅烷与醇作用生成硅氧烷。 三、与金属有机化合物的反应 在Grignard试剂或有机锂试剂作用下,Si-X键断 裂,Si-C键生成。
Si-Si键的键能较C-C键小,Si=C, Si=C双键不 稳定。 常见的有机硅化合物有:有机硅烷、卤硅烷、 硅醇、硅氧烷和硅醚。
应用化学系
运城学院 PhSiH3 苯基硅烷 (CH3)4Si 四甲基硅烷 (CH3)2SiCl2 二甲基二氯硅烷 (CH3)3SiOSi(CH3)3 六甲基二硅氧烷
(CH3)3SiOH C2H5Si(OC2H5)3 三甲基硅醇 乙基三乙氧基硅烷
应用化学系
运城学院
§16.8
16.8.1 16.8.2 16.8.3 16.8.4
有机磷化合物
烷基磷的结构 有机磷化合物作为亲核试剂的反应 磷酸酯 有机磷农药
§16.9
16.9.1 16.9.2 16.9.3 16.9.4
有机硅化合物
有机硅化合物的结构 卤硅烷的制备 卤硅烷的化学性质 有机硅化合物在合成中的应用
三、磺基的反应
应用化学系
运城学院 磺基可被氢原子、羟基、氰基等取代。 1、水解
2、碱熔与其它亲核取代反应
其它亲核试剂有氰基、氨、胺等。
应用化学系
运城学院
§16.5
芳磺酰胺(sulfonamides)
制备:
糖精(saccharin): 磺胺药物(sulfa drugs):
氨基苯磺酰胺 (sulfanilamide)
大学基础化学II课程教学大纲
大学基础化学II课程教学大纲一、课程说明(一)课程名称、所属专业、课程性质、学分;大学基础化学II——有机化学;物理学院材料化学专业,主干基础课;4学分;(二)课程简介、目标与任务;有机化学是化学学科的一个重要分支,是研究有机化合物的组成、结构、性质、相互转化、合成以及与此相关的理论问题的学科,是一门理论性和实践性并重的课程。
有机化学课程是高等学校化学、材料、生物专业教学计划中一门必修的基础课程。
《有机化学(第二版)》共17章,按照以官能团分章的方式编排,每章最后都设置了相应的习题。
教材内容精练,重点突出。
在选材和举例方面,注重实用性和前沿性,许多实例都来自于科研。
在内容设置上,在教授基础知识的同时,注重培养学生的思考和探究能力,几乎每个章节都设立了思考、引导和探究项目,可供学生讨论。
还设置了拓展阅读部分,以拓展学生的知识面。
《有机化学(第二版)》的另一特色是,引入理论计算,对每种官能团的代表化合物都拟合出形象的电子分布密度图,便于读者形象地理解化合物结构与反应性的关系。
课程任务:要求学生通过理论学习和实验能够掌握并运用一些常见重要有机物的化学性质,掌握有机化学的基本理论、基本知识和基本技能,了解本学科范围内重大的科学技术新成就,培养学生具有分析和解决有机化学一般问题的初步能力,为学习后续课程和培养造就应用型人才打好一定基础。
(三)先修课程要求,与先修课与后续相关课程之间的逻辑关系和内容衔接;无机化学与化学原理。
先修课程对学生在掌握学习有机化学结构理论和立体化学、反应动力学和化学平衡等化学理论方面具有重要的学习意义。
可通过前期的基本了解学习,为后续学习奠定良好的理论基础。
(四)教材与主要参考书。
教材:李艳梅等,有机化学(第二版),科学出版社,2014.参考资料:高坤、李瀛等,有机化学(第二版),科学出版社,2011.李瀛等,有机化学质疑暨考研指导,兰州大学出版社,2011.古练权等,有机化学,高等教育出版社,2008.伍越寰等,有机化学,中国科学技术大学出版社,2010.邢其毅等编著,基础有机化学(第三版),高等教育出版社,2005.二、课程内容与安排第一章绪论第一节有机化合物和有机化学第二节有机化合物的特征第三节共价键第四节分子间相互作用力第五节有机反应中的酸碱概念第六节有机化合物的分类第七节有机化合物构造式的写法第八节有机化合物命名的基本原则第九节有机化学的研究方法第二章饱和烃:烷烃和环烷烃第一节通式、同系列和同分异构第二节烷烃的命名第三节烷烃的结构第四节烷烃的物理性质第五节烷烃的化学反应第六节环烷烃的命名第七节环烷烃的结构与构象第八节环烷烃的物理性质第九节环烷烃的化学反应第十节烷烃和环烷烃的制备第三章不饱和烃:烯烃、炔烃和二烯烃第一节烯烃的结构第二节烯烃的异构和命名第三节烯烃的物理性质第四节烯烃的化学反应第五节炔烃的结构第六节炔烃的命名第七节炔烃的物理性质第八节炔烃的化学反应第九节二烯烃的分类和命名第十节共轭二烯烃的结构和共轭效应第十一节共轭二烯烃的化学反应第十二节烯烃和炔烃的制备第四章芳烃第一节芳烃的分类、异构和命名第二节苯的结构第三节芳烃的物理性质第四节单环芳烃的化学性质第五节芳烃亲电取代反应的定位规律第六节稠环芳烃第七节非苯芳烃第八节芳烃的来源及煤炭产业第五章对映异构第一节手性和对称性第二节含一个不对称碳原子的化合物第三节含两个及多个不对称碳原子的化合物第四节环状手性化合物第五节其他不含不对称碳原子的手性化合物第六节前(潜)手性碳和分子的前(潜)手性第七节不对称合成与拆分第八节手性与药物第九节异构体的分类第六章卤代烃、金属有机化合物第一节卤代烃的分类、异构、命名和结构第二节卤代烃的物理性质第三节卤代烃的化学反应第四节饱和碳原子上的亲核取代反应第五节影响亲核取代反应的因素第六节消除反应历程第七节影响消除反应发因素第八节取代反应与消除反应的竞争第九节其他卤代烃第十节卤代烃的制备第七章波谱分析在有机化学中的应用第一节电磁辐射第二节红外光谱第三节核磁共振第四节紫外光谱第五节质谱第八章醇、酚、醚第一节醇的分类、命名和结构第二节醇的物理性质与波谱特征第三节一元醇的化学性质第四节多元醇的特殊反应第五节醇的制备第六节酚的分类和命名第七节酚的物理性质与波谱特征第八节酚的化学性质第九节酚的制备第十节醚的分类和命名第十一节醚的物理性质和波谱特性第十二节醚的化学反应第十三节醚的制备第十四节环醚第十五节冠醚第九章醛、酮、醌第一节醛和酮的分类和命名第二节醛和酮的结构第三节醛和酮的物理性质和波普特性第四节醛和酮的亲核加成反应第五节醛和酮的α-H的反应第六节醛和酮的氧化和还原反应第七节 Cannizzaro反应第八节α,β-不饱和醛、酮第九节醛、酮的制备第十节醌的结构第十一节醌的化学性质第十二节醌与染料第十章羧酸及其衍生物第一节羧酸的分类、命名和结构第二节羧酸的物理性质和波谱特征第三节羧酸的化学性质第四节羧酸衍生物的命名第五节羧酸衍生物的物理性质和波谱特征第六节羧酸衍生物的化学性质第七节羟基酸的分类和命名第八节羟基酸的化学反应第九节β-二羰基化合物第十节羧酸的制备第十一章含氮化合物第一节硝基化合物的分类、命名和结构第二节硝基化合物的物理性质和波谱特征第三节硝基化合物的化学性质第四节胺的分类、命名和结构第五节胺的物理性质和波谱特征第六节胺的化学性质第七节季铵盐和季铵碱第八节胺的制备第九节芳香族重氮和偶氮化合物第十节腈和异腈第十二章含硫、含磷及含硅有机化合物第一节含硫有机化合物第二节含磷有机化合物第三节含硅有机化合物第十三章杂环化合物第一节杂环化合物的分类、命名和结构第二节五元杂环化合物第三节六元杂环化合物第四节杂环类药物第十四章类脂化合物第一节油脂第二节蜡第三节磷脂第四节萜类化合物第五节甾族化合物第十五章碳水化合物第一节碳水化合物的分类第二节单糖第三节二糖第四节多糖第十六章氨基酸、多肽、蛋白质及核酸第一节氨基酸第二节多肽第三节蛋白质第四节酶第五节核酸第六节生物技术和生物技术药物第十七章周环反应第一节前线轨道理论第二节电环化反应第三节环加成反应第四节 -迁移反应(一)教学方法与学时分配采用课堂多媒体讲授的方式开展教学活动。
第二章 有机含硫含磷含硅化合物
第一节 硫、磷原子的成键特性
电子层结构: O:1s22s22p4 S: 1s22s22p63s23p4 N: 1s22s22p3 P: 1s22s22p63s23p3 ROH: 醇 RSH: 硫醇 ROR:醚 RSR:硫醚
O、N可以与C形成平面型p-p 键化合物 (C=O、C=N等),它们的2p轨道形状和 能量相近。 S、P则不易形成C=S、C=P键,因为是2p- 3p 键。 但S、P可以利用3d空轨成d-p 反馈键(如S =O、P=O键),且很常见。 此外,S:sp3d2杂化,如SF6;P:sp3d杂化, 如PCl5 N、P:sp3杂化:如:R3N、R3P
O P OR
磷酸烷基酯
OR 磷酸三烷基酯
烷基膦的结构--与叔胺相似。
H3C P H3C H3C P CH 3 CH3 CH3
当磷原子与3个不同的烃基连接时,分子具有手性。
H3C P H2C=HCH2C Ph P Ph CH 2CH=CH2 CH3
有机磷化合物的性质
Ph3P Ph 3P CH3 Br+ CH3Br C4H9Li 苯 Ph3P CH3 BrPh3P CH 2
C2H5S 乙环己硫醚
SCH3 苯甲硫醚
S 二苯硫醚
一). 硫醚的制备
单硫醚(硫化钾、硫化钠与卤代烷反应)
CH3I + K2S
CH3SCH3 + KI
CH3OH
混硫醚:类似Williamson方法。
CH2=CHCH2Cl + CH3SNa CH2=CHCH2SCH3
完成反应
CH3CH2SH + (CH3)2CHCH2CH2CH2Br Na2S(1mol) + BrCH2CH2CH2CH2Br OH
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
过 氧 化 物 RCH2CH2SR ′
总目录
三、硫醚
1.亲核性
(CH3)2¨ S : + CH3 I
¨ S R
¨ R
(CH3 )3S I
+ -
碘化三甲锍
2.氧化反应
¨: (CH3)2S H2O2 HOAc
H3 C H3 C S O
H2O2 HOAc
H3C H3C
O S O
(DMSO,二甲亚砜) 优良的强极性非质子溶剂
总目录
第五节 含磷有机化合物(自学)
一、分类和命名
三价磷化合物:看作是PH3的烃基衍生物
伯膦
仲膦
叔膦
季鏻盐
三价磷(膦)酸及其酯:
亚磷酸 亚膦酸 次亚膦酸
总目录
亚磷酸酯
烃基亚膦酸酯
二烃基次亚膦酸酯
五价磷(膦)酸及其酯:
磷酸
膦酸
次膦酸
总目录
磷酸酯
膦酸酯
次膦酸酯
膦烷及亚甲基膦烷:
三苯膦
五苯膦
亚甲基三烃基膦
S—S键和S—H键之间的氧化还原是一
个极为重要的生理过程。
半胱氨酸
胱氨酸
总目录
3. 亲核性
OH ′ RSH + R X R S R′
H2 Ni R R
R C O R
HSCH2CH2SH
R R
+ H
C
S S
R′ △ RCH=CH2 + R′ SH RCHCH3
符合马氏规则
总目录
第一节 硫、磷和硅原子的成键特征
周期 ⅣA C Si ⅤA N P 价电子层电子排布 ⅥA O S
一 二
ⅣA
ⅤA
ⅥA
C: 2s2 2p2 N: 2s2 2p3 O: 2s2 2p4 Si: 3s2 3p2 3d0 P: 3s2 3p3 3d0 S: 3s2 3p4 3d0
总目录
1. 相似
价电子层构型类似,可形成类似共价键化合物: ROH 醇 R3N 胺 RSH 硫醇 R3P 膦 RH 烃 RSiH 硅醇
一、命名
总目录
二、硫醇、硫酚化学性质
1. 酸性
原因: 价电子处于不同能级,3p轨道比2p轨 道扩散,与H的1s轨道交盖不如2p有效, 因此易解离。
总目录
2. 氧化
R S H <O> [H] R S S R
(1)氧化剂: I2,稀H2O2,O2/Fe或Cu催化
(2)反应本质:自由基反应
总目录
(3)意义
命名:(自学)
总目录
二、膦和季鏻盐
1. 膦的制备 ⑴ 格氏反应制备叔膦
⑵ 傅-克反应 制备二氯苯膦,进而引入烃基
总目录
2.膦的氧化反应
3.形成季鏻盐的反应
总目录
叔膦与过渡金属所形成 的配合物,例如,三苯膦铑 氯配合物〔又叫威尔金逊 (Wilkinson)催化剂〕在 有机催化反应中具有特别重 要的意义。 4.维蒂希试剂及其反应
锍 盐
CH3
+
2
碳负离子的负电荷反馈到S的空d轨道而稳定。
总目录
1.硫醚碳负离子的反应
C6H5S(CH2)10CH3
亲核取代,烷基化
C6H5SCH2CHC6H5 OH
亲核加成
总目录
+ H δ + O C H SH 亲电性
SH
S S C RX H
H
+
S C S
R H
亲核性
H2O HgCl2 H O C H
总目录
第三节 有机硫试剂在有机合成上的应用
(自学)
一、瑞尼Ni的脱硫反应
总目录
二、含硫碳负离子在有机合成上的应用
硫醚 O 亚 砜 砜 CH3 S CH3 O CH3 S CH3 O CH3 CH3 S CH3
+
S CH3
¨ S CH2 O
碱 THF 或 DMSO
CH3 CH3
¨ S CH2 O ¨ S CH2 O CH3 ¨ S CH
H3C
H3C
S CH2 + R C R
O
O
DMSO
O H3C
OH R
S CH2 CR
总目录
H3C
S CH2 + R C OR
O H3C
O
O
H3C
CH S 2
Al-Hg S CH2 CR + H3O
O
O
O R C CH3
RX
O O
O Al-Hg H3O
H3C
S CH CR R
+
R C CH2R
总目录
O RX + HO S ONa RSO3H
H2SO4 C6H6 ClSO3H C6H5SO3H
总目录
二、磺酸的衍生物(自学)
1.磺酰氯 2.磺酸酯 特点:RSO2O—是很好的离去基团:如 TsO— 对甲苯磺酸基
ClO2S CH3
ROH 吡啶
ROSO2
CH3
ROTs
总目录
反应不重排
3.磺酰胺(自学)
3.硫叶立德(sulfur ylide)反应
硫叶立德
O
+ + CH2 S(CH3)2
O
O
CH2 S(CH3)2
+
分子内SN2反应, 形成环氧乙烷环
总目录
第四节 磺酸及其衍生物
磺酸
C12H25
硫酸
SO2Cl
硫酸二甲酯
SO2OR SO2NH2
SO3H
十二烷基苯磺酸 苯磺酰氯 苯磺酸酯
苯磺酰胺
总目录
一、磺酸的制备
瑞 尼 Ni H2 RCH2R
“亲电”的碳转变为“亲核”的碳,这种极性的 变换称“极性反转”。它已成为有机合成重要的 合成手段。
总目录
合成结构复杂的醛、酮或烃
HgCl2 CdCO3 乙二 醇 , 水
O
总目录
2.亚砜和砜碳负离子的反应
S CH2 + RX O SN2 O H3C S CH2 R + X -
2. 区别
① s和p的3p轨道较扩散,与C的2p轨道重叠程度低, p-pπ 键不稳定,S易二、三聚成只含σ键的化合物; ② P、S有空d轨道,可形成高价化合物(如PCl5、(C6H5)5P、 SF6),还可形成d-pπ键;
③ S、P常取sp3杂化态,未成键电子对对立体化学有重要影 响。
总目录
第二节 含硫有机化合物
