无机化工生产技术硫酸.pptx
合集下载
硫酸生产ppt课件

工业化学
●建国后我国的硫酸工业
1949年后,我国的硫酸工业发展较快。硫酸厂由建国前的几 家发展成数百家,硫酸产量也随之大幅度增长。
年
产量 / 万吨
1949 4.0
1952 19.0
1957 63.3
1966 225.0
1970 291.4
1975 484.7
1980 764.3
1987 983.0
工业化学
硫酸工业发展概况
Survey Of Develop Of The Industry Of Sulfuric Acid
硫酸工业 发展概述
●硫酸的发现
● 8世纪左右,阿拉伯人干馏绿矾得到硫酸
FeSO4·7H2 O
干馏
FeO+SO3 + H2O + H2 O
H2SO4
“矾油”
● 16世纪初,在波西米亚(Bohemia)用硫酸铁干馏得到
工业化学
硫酸应用
硫酸是基本化学工业中重要产品之一。它不仅作为许多化工产品的原料, 而且还广泛地应用于其他的国民经济部门。 用于肥料的生产硫酸铵(俗称硫铵或肥田粉)和过磷酸钙(俗称过磷酸 石灰或普钙)这两种化肥的生产都要消耗大量的硫酸。 用于冶金工业和金属加工在冶金工业部门,特别是有色金属的生产过程 需要使用硫酸。例如用电解法精炼铜、锌、镉、镍时,电解液就需要使 用硫酸,某些贵金属的精炼,也需要硫酸来溶解去夹杂的其他金属。在 钢铁工业中进行冷轧、冷拔及冲压加工之前,都必须用硫酸清除钢铁表 面的氧化铁。在轧制薄板、冷拔无缝钢管和其他质量要求较高的钢材, 都必须每轧一次用硫酸洗涤一次。另外,有缝钢管、薄铁皮、铁丝等在 进行镀锌之前,都要经过用硫酸进行酸洗手续。在某些金属机械加工过 程中,例如镀镍、镀铬等金属制件,也需用硫酸来洗净表面的锈。在黑 色冶金企业部门里,需要酸洗的钢材一般约占钢总产量的5%~6%,而每 吨钢材的酸洗,约消费98%的硫酸30kg~50kg。
●建国后我国的硫酸工业
1949年后,我国的硫酸工业发展较快。硫酸厂由建国前的几 家发展成数百家,硫酸产量也随之大幅度增长。
年
产量 / 万吨
1949 4.0
1952 19.0
1957 63.3
1966 225.0
1970 291.4
1975 484.7
1980 764.3
1987 983.0
工业化学
硫酸工业发展概况
Survey Of Develop Of The Industry Of Sulfuric Acid
硫酸工业 发展概述
●硫酸的发现
● 8世纪左右,阿拉伯人干馏绿矾得到硫酸
FeSO4·7H2 O
干馏
FeO+SO3 + H2O + H2 O
H2SO4
“矾油”
● 16世纪初,在波西米亚(Bohemia)用硫酸铁干馏得到
工业化学
硫酸应用
硫酸是基本化学工业中重要产品之一。它不仅作为许多化工产品的原料, 而且还广泛地应用于其他的国民经济部门。 用于肥料的生产硫酸铵(俗称硫铵或肥田粉)和过磷酸钙(俗称过磷酸 石灰或普钙)这两种化肥的生产都要消耗大量的硫酸。 用于冶金工业和金属加工在冶金工业部门,特别是有色金属的生产过程 需要使用硫酸。例如用电解法精炼铜、锌、镉、镍时,电解液就需要使 用硫酸,某些贵金属的精炼,也需要硫酸来溶解去夹杂的其他金属。在 钢铁工业中进行冷轧、冷拔及冲压加工之前,都必须用硫酸清除钢铁表 面的氧化铁。在轧制薄板、冷拔无缝钢管和其他质量要求较高的钢材, 都必须每轧一次用硫酸洗涤一次。另外,有缝钢管、薄铁皮、铁丝等在 进行镀锌之前,都要经过用硫酸进行酸洗手续。在某些金属机械加工过 程中,例如镀镍、镀铬等金属制件,也需用硫酸来洗净表面的锈。在黑 色冶金企业部门里,需要酸洗的钢材一般约占钢总产量的5%~6%,而每 吨钢材的酸洗,约消费98%的硫酸30kg~50kg。
《硫酸的制备和质》课件

《硫酸的制备和质》PPT 课件
本PPT介绍硫酸的制备与质,包括其化学式、用途,制备的工业与实验室方法, 质量控制的检测与标准,以及安全使用与储存的注意事项。
硫酸的化学式和性质
化学式
硫酸的化学式为H2SO4,是无色、无臭的液体。
性质
硫酸是强酸,具有强烈的腐蚀性和毒性。其密度大,沸点高,可与水剧烈反应。
Chemical Formula and Properties of Sulfuric Acid
Chemical Formula
The chemical formula of sulfuric acid is H2SO4. It is a colorless and odorless liquid.
Preparation of Sulfuric Acid
1
Industrial Preparation
Sulfuric acid is industrially prepared by reacting sulfur dioxide with oxygen. This reaction can be carried out in both gas and liquid phases.
Uses
Sulfuric acid is a widely used chemical, employed in the production of fertilizers, detergents, explosives, and various other industrial products.
Conclusion
This PPT provides in-depth information on the preparation and quality control of sulfuric acid, as well as the importance of its safe use and handling. By understanding these aspects, one can effectively apply sulfuric acid in practical applications.
本PPT介绍硫酸的制备与质,包括其化学式、用途,制备的工业与实验室方法, 质量控制的检测与标准,以及安全使用与储存的注意事项。
硫酸的化学式和性质
化学式
硫酸的化学式为H2SO4,是无色、无臭的液体。
性质
硫酸是强酸,具有强烈的腐蚀性和毒性。其密度大,沸点高,可与水剧烈反应。
Chemical Formula and Properties of Sulfuric Acid
Chemical Formula
The chemical formula of sulfuric acid is H2SO4. It is a colorless and odorless liquid.
Preparation of Sulfuric Acid
1
Industrial Preparation
Sulfuric acid is industrially prepared by reacting sulfur dioxide with oxygen. This reaction can be carried out in both gas and liquid phases.
Uses
Sulfuric acid is a widely used chemical, employed in the production of fertilizers, detergents, explosives, and various other industrial products.
Conclusion
This PPT provides in-depth information on the preparation and quality control of sulfuric acid, as well as the importance of its safe use and handling. By understanding these aspects, one can effectively apply sulfuric acid in practical applications.
典型化工工艺-硫酸工艺课件

• 生成的氧化钙与物料中的氧化硅成分在窑中反应生 成水泥熟料,通常烟气中的二氧化硫浓度为7~10 %
4.以硫磺为原料 当原料为液态硫磺时,可直接用液硫泵将其输入焚
硫炉;若原料为固态硫磺,则需在熔硫槽中以蒸汽间 接加热熔融,滤除杂质后,用泵送入焚硫炉。
硫磺燃烧时的反应为: S + O2─→ SO2 + 297 kJ
典型化工工艺学
. 第一部分:合成氨工艺 . 第二部分:硫酸工艺 . 第三部分:纯碱与烧碱工艺
第二部分 硫酸工艺
• Chp1: 概述 • Chp2: 硫铁矿焙烧制二氧化硫炉气 • Chp3:炉气的净化与干燥 • Chp4:二氧化硫氧化制三氧化硫 • Chp5: 三氧化硫吸收 • Chp6: 三废治理与综合利用
硫酸工业“十二五”发展规划要点*
• 指导思想
“十二五”期间将进一步促进行业可持续健康发展,满 足国民经济对硫酸及相关硫产品需要;加快企业结构、原料 结构调整,努力转变产业增长方式;继续发展循环经济,对各 种硫资源进行综合与循环利用;坚持硫资源多样化供应,充 分利用国际国内两种资源;加快技术进步,促进节能减排;提 高硫酸生产中余热回收利用率,将硫酸生产企业变成副产或 回收能源的工厂。
1.3 硫酸生产方法
• 硫酸的工业生产主要有接触法和亚硝基法。 • 亚硝基法分为铅室法和塔式法。 • 接触法是目前硫酸生产主流生产工艺。基本原理
是在催化剂存在下,以空气中的氧氧化二氧化硫 变为三氧化硫,再与水结合得到硫酸。
• 生产过程主要分三部进行 • 1)从含硫原料制造二氧化硫气体; • 2)将二氧化硫氧化为三氧化硫; • 3)三氧化硫与水结合生产硫酸。
3. 以石膏(磷石膏)为原料
• 用油、煤或天然气作燃料,在回转窑中使石膏与焦 炭于约1400℃下进行还原热解产生氧化钙,继而再 与添加剂起矿化作用生成水泥熟料。同时窑内产生 的二氧化硫气体则送去制酸,其工艺流程同硫铁矿 制酸系统。
4.以硫磺为原料 当原料为液态硫磺时,可直接用液硫泵将其输入焚
硫炉;若原料为固态硫磺,则需在熔硫槽中以蒸汽间 接加热熔融,滤除杂质后,用泵送入焚硫炉。
硫磺燃烧时的反应为: S + O2─→ SO2 + 297 kJ
典型化工工艺学
. 第一部分:合成氨工艺 . 第二部分:硫酸工艺 . 第三部分:纯碱与烧碱工艺
第二部分 硫酸工艺
• Chp1: 概述 • Chp2: 硫铁矿焙烧制二氧化硫炉气 • Chp3:炉气的净化与干燥 • Chp4:二氧化硫氧化制三氧化硫 • Chp5: 三氧化硫吸收 • Chp6: 三废治理与综合利用
硫酸工业“十二五”发展规划要点*
• 指导思想
“十二五”期间将进一步促进行业可持续健康发展,满 足国民经济对硫酸及相关硫产品需要;加快企业结构、原料 结构调整,努力转变产业增长方式;继续发展循环经济,对各 种硫资源进行综合与循环利用;坚持硫资源多样化供应,充 分利用国际国内两种资源;加快技术进步,促进节能减排;提 高硫酸生产中余热回收利用率,将硫酸生产企业变成副产或 回收能源的工厂。
1.3 硫酸生产方法
• 硫酸的工业生产主要有接触法和亚硝基法。 • 亚硝基法分为铅室法和塔式法。 • 接触法是目前硫酸生产主流生产工艺。基本原理
是在催化剂存在下,以空气中的氧氧化二氧化硫 变为三氧化硫,再与水结合得到硫酸。
• 生产过程主要分三部进行 • 1)从含硫原料制造二氧化硫气体; • 2)将二氧化硫氧化为三氧化硫; • 3)三氧化硫与水结合生产硫酸。
3. 以石膏(磷石膏)为原料
• 用油、煤或天然气作燃料,在回转窑中使石膏与焦 炭于约1400℃下进行还原热解产生氧化钙,继而再 与添加剂起矿化作用生成水泥熟料。同时窑内产生 的二氧化硫气体则送去制酸,其工艺流程同硫铁矿 制酸系统。
《工业制硫酸》课件

工业制硫酸
工业制硫酸是一项重要的工业制造过程,不仅具有广泛的应用,同时也带来 了环境问题。本课件将介绍硫酸的生产过程、应用以及相关的环境保护措施。
硫酸生产过程
1
采Байду номын сангаас原材料
从矿石或废弃物中提取硫元素。
制备浓硫酸
2
通过吸收二氧化硫、去除杂质和蒸馏等
步骤制备浓硫酸。
3
生产浓硫酸
包括冷凝、焙烧和蒸馏等过程。
硫酸生产会释放大量的二氧化硫,对大气环 境造成污染。
2 废水处理
硫酸生产过程中产生的废水需要经过处理才 能排放。
3 酸雨的影响
硫酸的排放可能导致酸雨,对环境、植物和 土壤造成损害。
4 环境保护改善措施
加强污染治理、提高资源利用率和推广清洁 生产技术等。
总结
工业制硫酸是一项重要的工业制造过程,它的应用广泛,但同时也带来了环境问题。需要加强环保措施,以减 少对大自然的影响。
硫酸的应用
作为化工原料
用于生产肥料、塑料、纤维 等化学品。
作为酸性催化剂
加速化学反应,常用于石油 精炼和合成材料的制造。
用于电池制造
用于制造铅酸电池、锂离子 电池等。
用于金属加工
用于腐蚀金属表面、清除氧化物等。
用于清洗和消毒
硫酸具有杀菌、杀毒等效果,常用于清洗和消 毒。
硫酸生产的环境问题
1 二氧化硫的排放
工业制硫酸是一项重要的工业制造过程,不仅具有广泛的应用,同时也带来 了环境问题。本课件将介绍硫酸的生产过程、应用以及相关的环境保护措施。
硫酸生产过程
1
采Байду номын сангаас原材料
从矿石或废弃物中提取硫元素。
制备浓硫酸
2
通过吸收二氧化硫、去除杂质和蒸馏等
步骤制备浓硫酸。
3
生产浓硫酸
包括冷凝、焙烧和蒸馏等过程。
硫酸生产会释放大量的二氧化硫,对大气环 境造成污染。
2 废水处理
硫酸生产过程中产生的废水需要经过处理才 能排放。
3 酸雨的影响
硫酸的排放可能导致酸雨,对环境、植物和 土壤造成损害。
4 环境保护改善措施
加强污染治理、提高资源利用率和推广清洁 生产技术等。
总结
工业制硫酸是一项重要的工业制造过程,它的应用广泛,但同时也带来了环境问题。需要加强环保措施,以减 少对大自然的影响。
硫酸的应用
作为化工原料
用于生产肥料、塑料、纤维 等化学品。
作为酸性催化剂
加速化学反应,常用于石油 精炼和合成材料的制造。
用于电池制造
用于制造铅酸电池、锂离子 电池等。
用于金属加工
用于腐蚀金属表面、清除氧化物等。
用于清洗和消毒
硫酸具有杀菌、杀毒等效果,常用于清洗和消 毒。
硫酸生产的环境问题
1 二氧化硫的排放
硫酸的制备 PPT
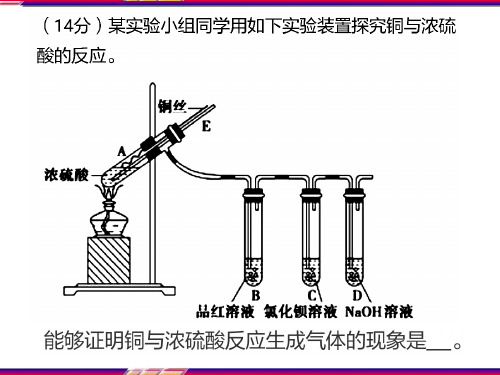
液;明矾可做净水剂;重晶石在医疗上可用做“钡
餐”,绿矾制农药,在医疗上可用于治疗贫血。
含硫化合物的相互转化
在通常状况下,A是固体单质。根据如图所示的转 化关系,回答下列问题: (1)写出A~E的化学式: A__S_,B__H_2_S_,C__S_O__2 ,D__S_O_3_,E_H_2_S_O_ 4 (2)写出下列指定反应的化学方程式: B→C:
②还原性
a. 与O2反应:SO2+Cl2+2H2O===2Cl-+4H++SO42-
b. 通入氯水中离子方程式: 现象: 溶液颜色褪去 。
c. 能使酸性KMnO4溶液褪色。
2KMnO4+5SO2+2H2O = 2MnSO4+ K2SO4+2H2SO4
③氧化性
(Ⅰ)与硫化氢的反应为:SO2+2H2S=3S↓+2H2O。
(Ⅱ)镁能在SO2气体中燃烧,其方程式为:
SO2+2Mg=点=燃==2MgO+S
S+
点燃 Mg ==== MgS
④漂白性 ---暂时性 通入品红溶液,一段时间后再加热。 现象为:品红溶液先褪色,加热后又恢复原色 原理:与有色物质化合生成不稳定的无色物质。 品红溶液的红色褪去;加热后,溶液又恢复红色 这是检验SO2的方法之一。 选择性: 不能使紫色石蕊试液褪色(石蕊变红)
SO3 + H2O == H2SO4
一.硫酸的工业制备(接触法)
1)造气及净化—沸腾炉
原 料
硫磺(S)或黄铁矿(FeS2)
炉气
高温
4FeS2+11O2===2Fe2O3+8SO2
粉 碎
净 化
点燃 ( S + O2 === SO2 )
空气
净化:防止催化剂中毒
餐”,绿矾制农药,在医疗上可用于治疗贫血。
含硫化合物的相互转化
在通常状况下,A是固体单质。根据如图所示的转 化关系,回答下列问题: (1)写出A~E的化学式: A__S_,B__H_2_S_,C__S_O__2 ,D__S_O_3_,E_H_2_S_O_ 4 (2)写出下列指定反应的化学方程式: B→C:
②还原性
a. 与O2反应:SO2+Cl2+2H2O===2Cl-+4H++SO42-
b. 通入氯水中离子方程式: 现象: 溶液颜色褪去 。
c. 能使酸性KMnO4溶液褪色。
2KMnO4+5SO2+2H2O = 2MnSO4+ K2SO4+2H2SO4
③氧化性
(Ⅰ)与硫化氢的反应为:SO2+2H2S=3S↓+2H2O。
(Ⅱ)镁能在SO2气体中燃烧,其方程式为:
SO2+2Mg=点=燃==2MgO+S
S+
点燃 Mg ==== MgS
④漂白性 ---暂时性 通入品红溶液,一段时间后再加热。 现象为:品红溶液先褪色,加热后又恢复原色 原理:与有色物质化合生成不稳定的无色物质。 品红溶液的红色褪去;加热后,溶液又恢复红色 这是检验SO2的方法之一。 选择性: 不能使紫色石蕊试液褪色(石蕊变红)
SO3 + H2O == H2SO4
一.硫酸的工业制备(接触法)
1)造气及净化—沸腾炉
原 料
硫磺(S)或黄铁矿(FeS2)
炉气
高温
4FeS2+11O2===2Fe2O3+8SO2
粉 碎
净 化
点燃 ( S + O2 === SO2 )
空气
净化:防止催化剂中毒
硫酸的生产工艺 ppt课件

硫酸的工艺流程图
硫铁矿的陪烧
炉气的净化
气体的干燥
二氧化硫的转化
三氧化硫的吸收
一、硫酸的生产方法
硫酸是三氧化硫和水化合后的产物 即: SO3+H2O=H2SO4 制取SO3是 由于硫磺及硫化物在空气中易于燃烧,同时
生成SO2,即: S+O2=SO2
使二氧化硫催化氧化可得三氧化硫
即: 2SO2+O2=2SO3
从沸腾炉焙烧硫铁矿得到的炉气中,除了 SO2 和O2是转化工序所需的有用气体、N2是惰性气体外, 还含有哪些有害物质?
矿尘
As Se H2O+SO3
阻塞管道和设备,增大流体阻力,降 低钒催化剂的活性。
As2O3 SeO2
使钒催化剂中毒
生成硫酸雾
腐蚀设备、管道,降 低钒催化剂的活性。
●旋风除尘 此方法主要是排出0.1~0.2μm以上的矿尘颗粒。
•硫酸生产方法的简介 •硫酸的工艺流程图 •反应设备的简介 •催化剂的选用 •硫酸生产工艺路线及分析 •内容小结
硫酸生产方法的简介
硫酸的生产方法有:塔式法、铅室法 和接触法。本次采用以硫铁矿为原料 的接触法生产工艺。它的主要工序包 括1、硫铁矿的陪烧 2、炉气的净化3、 气体的干燥 4、二氧化硫的转化5、三 氧化硫的吸收。
硫酸的生产工艺
硫酸简介
硫酸,化学式为H2SO4。是一种无色无味油状液体, 是一种高沸点难挥发的强酸,易溶于水,能以任意比 与水混溶。硫酸是基本化学工业中重要产品之一。它 不仅作为许多化工产品的原料,而且还广泛地应用于 其他的国民经济部门。硫酸作为化学六大无机强酸之 一,同时也作为所有酸中最常见的强酸之一,硫酸在 工业生产和人们的日常生活中有着广泛的应用。例如 石油和冶金工业、土壤改良、化肥生产等方面的应用。
硫酸生产过程ppt课件

46.55%
硫铁矿按其晶体的结构的不同又分为黄铁矿白
铁矿磁黄铁矿或称磁硫铁矿
硫铁矿按其来源不同分为:普通硫铁矿浮选硫铁
矿和尾砂含煤硫铁矿
Page 3
二、硫磺 制酸原料用硫磺与硫铁矿相比,炉气中的SO2与O2的含
量都可相应提高,有利于提高设备的生产能力。 三、其他含硫原料 硫酸盐 先将硫酸盐还原得SO2气体,然后再加工成硫酸。 冶炼烟气 冶炼有色金属过程中产生大量含有二氧化硫烟
多元醇:有效降低水的蒸汽压,使水分较难蒸发,又可以 增加硬脂酸的可塑性,使雪花膏能轻易的在皮肤上抹展开 。
十六醇:是滋润皮肤的油性组分,又能防止乳化粒子变粗 。
单硬脂酸甘油酯: 助乳化剂,使乳化体系保持稳定
Page 23
此课件下载可自行编辑修改,供参考! 感谢您的支持,我们努力做得更好!
24
硫
Page 11
(2)分解产物中的硫燃烧,生成二氧化硫;硫化亚铁氧 化为三氧化二铁和二氧化硫
影响硫化亚铁焙烧反应速率的因素包括: 1.温度 2.硫铁矿的粒度 3.氧浓度
Page 12
二、炉气的净化与干燥 1.湿法 2.干燥法
水洗净化流程及设备 流程:用大量的冷水喷淋高温炉气,使其温度由850~ 950℃迅速冷却至70℃以下,炉气中的 As2S3、SeO2、HF和 酸雾等有害杂质进入洗涤水中,矿尘被水洗掉,再将水沫 与炉气分离。由于炉气中含饱和水蒸气,经干燥塔利用浓 硫酸的吸水性将炉气干燥,除去炉气中的水气,达到炉气 净化之目的要求。
Page 22
成分分析
硬脂酸:作为雪花膏的主要成分,以遮盖作用减缓皮肤水 分的蒸发,对皮肤还有一定的柔滑作用。
碱:配制雪花膏时,以脂肪酸皂或其它表面活性剂为乳化 剂。在本实验中,钾皂和钠皂的质量,约为中和后剩余硬 脂酸是35%,钾皂和钠皂按10:1的用量来搭配,可以制 得分散状良好的,稠度适中的稳定乳化体。
无机化工工艺学硫酸

第三章 硫 酸
第3章 硫 酸
❖3.1 绪论 ❖3.2 从硫铁矿制二氧化硫炉气 ❖3.3 炉气的净化与干燥 ❖3.4 二氧化硫的催化氧化 ❖3.5 三氧化硫的吸收 ❖3.6 三废治理与综合利用
2
3.1 绪 论
一、性质 二、用途 三、生产方法 四、硫酸工业发展概况
3
一、性质
❖ 纯硫酸 (H2SO4)是一种无色透明的油状液体,相对密度为1.8269, 几乎比水重一倍。工业生产的硫酸系指SO3和H2O以一定比例混合的 溶液。
25
一、原料及其预处理
❖ 硫铁矿的筛分:
矿石破碎后,其中只有一部分达到粒度要求,因此在破碎过程中要 进行筛分,将合格的矿石通过震动筛与粗粒度矿石分离。筛下台格部分 选至成品矿贮仓或焙烧炉矿斗。筛上部分重新返回破碎。
❖ 硫铁矿的配矿
硫铁矿产地不同,其组成有较大差别。为使焙烧炉操作易于控制、 炉气成分均一,应采用恒定品位的矿料。因此常采取多种矿石搭配使用 的办法,亦即配矿。配矿不仅可充分合理利用资源,且对稳定生产、降 低有害杂质,以及提高硫的烧出率都十分重要。 ▪ 配矿的原则:
15
一、性质
(二)化学性质 4、与金属盐类发生反应
16
二. 用途
❖ 硫酸是无机化工、有机化工中用量最大、用途最广的化 工产品。
❖ 主要用于生产磷肥(在我国占硫酸总量的65-75%);此外 还可用于生产无机盐、无机酸、有机酸、化纤、塑料、 农药、颜料、染料、硝化纤维、TNT、硝化甘油及中间 体等;石油、冶金行业也都大量使用。
21
(二) 接触法原理
❖生产硫酸的原料
▪ 硫铁矿:主要成份是FeS2。 ▪ 磁硫铁矿:主要成份为Fe7S8。含S量越高,锻烧
时放热越多。 两种矿含S量相同时,磁硫铁矿锻烧放热量比普 通硫铁矿高30%左右。自然开采的硫铁矿都含有很 多杂质,使矿呈灰、褐、黄铜等不同颜色。通常含 硫量只有30%~50%。 ▪ 硫磺:使用天然硫磺生产硫酸最好,但我国矿少。 ▪ 其它原料:硫酸盐、冶炼烟气、含硫工业废料等。
第3章 硫 酸
❖3.1 绪论 ❖3.2 从硫铁矿制二氧化硫炉气 ❖3.3 炉气的净化与干燥 ❖3.4 二氧化硫的催化氧化 ❖3.5 三氧化硫的吸收 ❖3.6 三废治理与综合利用
2
3.1 绪 论
一、性质 二、用途 三、生产方法 四、硫酸工业发展概况
3
一、性质
❖ 纯硫酸 (H2SO4)是一种无色透明的油状液体,相对密度为1.8269, 几乎比水重一倍。工业生产的硫酸系指SO3和H2O以一定比例混合的 溶液。
25
一、原料及其预处理
❖ 硫铁矿的筛分:
矿石破碎后,其中只有一部分达到粒度要求,因此在破碎过程中要 进行筛分,将合格的矿石通过震动筛与粗粒度矿石分离。筛下台格部分 选至成品矿贮仓或焙烧炉矿斗。筛上部分重新返回破碎。
❖ 硫铁矿的配矿
硫铁矿产地不同,其组成有较大差别。为使焙烧炉操作易于控制、 炉气成分均一,应采用恒定品位的矿料。因此常采取多种矿石搭配使用 的办法,亦即配矿。配矿不仅可充分合理利用资源,且对稳定生产、降 低有害杂质,以及提高硫的烧出率都十分重要。 ▪ 配矿的原则:
15
一、性质
(二)化学性质 4、与金属盐类发生反应
16
二. 用途
❖ 硫酸是无机化工、有机化工中用量最大、用途最广的化 工产品。
❖ 主要用于生产磷肥(在我国占硫酸总量的65-75%);此外 还可用于生产无机盐、无机酸、有机酸、化纤、塑料、 农药、颜料、染料、硝化纤维、TNT、硝化甘油及中间 体等;石油、冶金行业也都大量使用。
21
(二) 接触法原理
❖生产硫酸的原料
▪ 硫铁矿:主要成份是FeS2。 ▪ 磁硫铁矿:主要成份为Fe7S8。含S量越高,锻烧
时放热越多。 两种矿含S量相同时,磁硫铁矿锻烧放热量比普 通硫铁矿高30%左右。自然开采的硫铁矿都含有很 多杂质,使矿呈灰、褐、黄铜等不同颜色。通常含 硫量只有30%~50%。 ▪ 硫磺:使用天然硫磺生产硫酸最好,但我国矿少。 ▪ 其它原料:硫酸盐、冶炼烟气、含硫工业废料等。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
焙烧反应的总反应式:
4FeS2 + 11O2 = 2Fe2O3 +8SO2 当空气过剩量小时,则生成Fe3O4,固态物质呈黑色; 总反应式:
3FeS2 + 8O2 = Fe3O4 +6SO2
14
一、硫铁矿焙烧的基本原理
上述反应中硫与氧反应生成的二氧化硫及过量氧、 氮和水蒸气等气体统称为炉气
铁与氧生成的氧化物及其他固态物质统称为烧渣。
铅室法和塔式法因其各自的缺点,而逐步被接触法取 代。
主要介绍接触法制硫酸工艺
8
1 概述
接触法制硫酸工艺
由于硫磺及硫化物在空气中易于燃烧,并生成SO2,即 S + O2→SO2
并在此基础上,使SO2催化氧化,即可获得SO3,即 2 SO2 + O2→2SO3
硫酸是SO3和H2O化合后的产物,即 2SO3 + H2O→H2SO4
6
第一节 概述
二、硫酸的生产方法
硫酸的工业生产方法主要有两种方法,即亚硝基法和接触法。
亚硝基法又称硝化法:以硫璜或含硫矿石(如黄铁矿)为 原料,在焚矿炉中燃烧成二氧化硫,除去尘埃,再和硝酸蒸 气(氮的氧化物)相混,借助氮的氧化物的交替氧化作用和 还原作用使二氧化硫氧化成三氧化硫,最后被水(或稀硫酸) 吸收而成硫酸成品。
16
一、硫铁矿焙烧的基本原理
9
1 概述
由反应式可知,接触法硫酸生产过程分为三个工序: ⑴由含硫原料制取二氧化硫气体,实现这一过程需将含硫 原料焙烧,故工业上称为“焙烧工序”; ⑵将含二氧化硫和氧的气体催化转化为三氧化硫,工业上 称为“转化工序”; ⑶将三氧化硫与水结合成硫酸,实现这一过程需将转化所 得三氧化硫气体用硫酸吸收,工业上称为“吸收工序”。
11
1 概述
硫化氢制酸是一典型的无辅助工序的过程,硫化氢燃烧后 得到无催化剂毒物的二氧化硫气体,可直接进入后续转化 和吸收工序。
硫磺制酸,如使用高纯度硫磺作原料,整个制酸过程只设 空气干燥一个辅助工序。
冶炼烟气制酸和石膏制酸,焙烧处于有色冶金和水泥制作 过程之中,所得二氧化硫气体含有矿尘、杂质等,因而需 在转化前设置气体净化工序。
S O2( 高温 ) SO2 SO2 NO2 SO3 NO SO3 H 2O H 2SO4
7
第一节 概述
亚硝基法有铅室法和塔式法两种
铅室法始于18世纪,因设备庞大,生产强度低,需用 大量铅,成品酸浓度仅达65%。
塔式法是在铅室法的基础上发展起来的,也因与铅室 法一样,制备的硫酸浓度低(产品浓度达75%) 、杂质 含量高。
及工艺流程;二氧化硫催化氧化的基本原理、工艺条件的 选择及工艺流程;三氧化硫吸收工艺条件的选择及工艺流 程。
2.理解:沸腾焙烧工艺条件的选择及工艺流程;沸腾焙烧 炉及二氧化硫转化器的基本结构;二氧化硫转化器的操作 分析。
3.了解:硫酸的性质、生产方法;三氧化硫吸收尾气处理 的方法。
4
第一节 概述
一、硫酸性质
2FeS2=2FeS+S2 第二步:硫蒸气的燃烧和硫化亚铁的氧化反应,分解得到硫 蒸汽与氧反应,即瞬间生成二氧化硫
S2 + O2 = SO2
13
一、硫铁矿焙烧的基本原理
硫铁矿分解出硫后,剩下的硫化亚铁逐渐变成多孔性物 质,继续焙烧,当空气过剩量大时,最后生成红棕色的固态 物质三氧化二铁。
4FeS + 7O2 = 2Fe2O3 +4SO2
纯硫酸(H2SO4)为无色透明油状液体,几乎比水重一 倍,相对密度1.8269,不易挥发,溶于水时放热,有比较 强的腐蚀性和脱水性。
硫酸是重要的基本化学工业原料。在化肥、冶金、国防、 有机合成、石油炼制等工业都有广泛用途。
工业生产的硫酸指SO3和以H2O一定比例混合的溶液, 而发烟硫酸是其中SO3和H2O摩尔比大于1的溶液,发烟硫 酸由于SO3蒸气压较大,暴露在空气中能释放出SO3,和 空气中的水蒸气迅速结合并凝聚成酸雾而得名。硫酸浓度 以含的H2SO4质量分数表示,而发烟硫酸浓度以所含游离 SO3或总SO3的质量分数表示。
5
第一节 概述
➢ 1.结晶温度:
93.3%硫酸:-38℃(最低) 99%硫酸:+5.5℃(最高)
➢ 2.硫酸密度:
硫酸水溶液的密度随硫酸含量的增加而增大,于 98.3%时达到最大,过后则递减。
➢ 3.硫酸的沸点:
硫酸水溶液的沸点随硫酸含量的增加而增大,于 98.3%时达到最高(383.3℃),过后则递减。
15
一、硫铁矿焙烧的基本原理
2.焙烧速率
硫铁矿的焙烧是气-固非均相反应过程,反应是在气固 两相的接触表面上进行,整个反应过程由一系列反应步 骤组成:FeS2的分解;氧向硫铁矿表面扩散;氧与FeS反 应;生成的SO2由矿粒表面向气流主体扩散。另外还存在 着硫磺蒸汽向外扩散及氧与硫的反应等。
由前述硫铁矿的焙烧反应分两步进行的,为了提高 焙烧的反应速率,应该研究上列反应中哪一步反应是整 个过程的控制步骤。根据实验测得的结果,硫化亚铁的 焙烧反应速率是整个焙烧过程的控制步骤。
工业硫酸简易流程图
除去杂质气体、 粉尘、水
硫铁矿 制取二 氧化硫 原料气
二氧化 硫炉气 净化与
干燥
二氧化 硫的催 化氧化
尾气处理
三氧化 硫的吸 收
硫酸
1
硫酸
1 认识硫酸工业 2 硫铁矿制取二氧化硫炉气 3 炉气的净化与干燥 4 二氧化硫的催化氧化 5 三氧化硫的吸收及气净化与干燥的原理
硫铁矿制酸是辅助工序最多且最有代表性的化工过程。前 述的原料加工、焙烧、净化、吸收、三废处理,成品酸贮 存和计量工序在该过程中均有。
12
2 硫铁矿制取二氧化硫炉气
一、硫铁矿焙烧的基本原理 1.焙烧反应
硫铁矿的焙烧主要是矿石中的FeS2与空气中的氧反应, 生成SO2炉气。焙烧反应分两步进行: 第一步:硫铁矿在高温下受热分解为硫化亚铁和硫
10
1 概述
不论采用何种原料、何种工艺和设备,以上三个工序 必不可少,除三个基本工序外,再加上原料的贮存与加工, 含二氧化硫气体的净化,成品酸的贮存于计量,三废处理等 工序才构成一个接触法硫酸生产的完整系统。
实现上述这些工序所采用的设备和流程随原料种类、 原料特点、建厂具体条件的不同而变化,主要区别在于辅助 工序的多少及辅助工序的工作原理。
4FeS2 + 11O2 = 2Fe2O3 +8SO2 当空气过剩量小时,则生成Fe3O4,固态物质呈黑色; 总反应式:
3FeS2 + 8O2 = Fe3O4 +6SO2
14
一、硫铁矿焙烧的基本原理
上述反应中硫与氧反应生成的二氧化硫及过量氧、 氮和水蒸气等气体统称为炉气
铁与氧生成的氧化物及其他固态物质统称为烧渣。
铅室法和塔式法因其各自的缺点,而逐步被接触法取 代。
主要介绍接触法制硫酸工艺
8
1 概述
接触法制硫酸工艺
由于硫磺及硫化物在空气中易于燃烧,并生成SO2,即 S + O2→SO2
并在此基础上,使SO2催化氧化,即可获得SO3,即 2 SO2 + O2→2SO3
硫酸是SO3和H2O化合后的产物,即 2SO3 + H2O→H2SO4
6
第一节 概述
二、硫酸的生产方法
硫酸的工业生产方法主要有两种方法,即亚硝基法和接触法。
亚硝基法又称硝化法:以硫璜或含硫矿石(如黄铁矿)为 原料,在焚矿炉中燃烧成二氧化硫,除去尘埃,再和硝酸蒸 气(氮的氧化物)相混,借助氮的氧化物的交替氧化作用和 还原作用使二氧化硫氧化成三氧化硫,最后被水(或稀硫酸) 吸收而成硫酸成品。
16
一、硫铁矿焙烧的基本原理
9
1 概述
由反应式可知,接触法硫酸生产过程分为三个工序: ⑴由含硫原料制取二氧化硫气体,实现这一过程需将含硫 原料焙烧,故工业上称为“焙烧工序”; ⑵将含二氧化硫和氧的气体催化转化为三氧化硫,工业上 称为“转化工序”; ⑶将三氧化硫与水结合成硫酸,实现这一过程需将转化所 得三氧化硫气体用硫酸吸收,工业上称为“吸收工序”。
11
1 概述
硫化氢制酸是一典型的无辅助工序的过程,硫化氢燃烧后 得到无催化剂毒物的二氧化硫气体,可直接进入后续转化 和吸收工序。
硫磺制酸,如使用高纯度硫磺作原料,整个制酸过程只设 空气干燥一个辅助工序。
冶炼烟气制酸和石膏制酸,焙烧处于有色冶金和水泥制作 过程之中,所得二氧化硫气体含有矿尘、杂质等,因而需 在转化前设置气体净化工序。
S O2( 高温 ) SO2 SO2 NO2 SO3 NO SO3 H 2O H 2SO4
7
第一节 概述
亚硝基法有铅室法和塔式法两种
铅室法始于18世纪,因设备庞大,生产强度低,需用 大量铅,成品酸浓度仅达65%。
塔式法是在铅室法的基础上发展起来的,也因与铅室 法一样,制备的硫酸浓度低(产品浓度达75%) 、杂质 含量高。
及工艺流程;二氧化硫催化氧化的基本原理、工艺条件的 选择及工艺流程;三氧化硫吸收工艺条件的选择及工艺流 程。
2.理解:沸腾焙烧工艺条件的选择及工艺流程;沸腾焙烧 炉及二氧化硫转化器的基本结构;二氧化硫转化器的操作 分析。
3.了解:硫酸的性质、生产方法;三氧化硫吸收尾气处理 的方法。
4
第一节 概述
一、硫酸性质
2FeS2=2FeS+S2 第二步:硫蒸气的燃烧和硫化亚铁的氧化反应,分解得到硫 蒸汽与氧反应,即瞬间生成二氧化硫
S2 + O2 = SO2
13
一、硫铁矿焙烧的基本原理
硫铁矿分解出硫后,剩下的硫化亚铁逐渐变成多孔性物 质,继续焙烧,当空气过剩量大时,最后生成红棕色的固态 物质三氧化二铁。
4FeS + 7O2 = 2Fe2O3 +4SO2
纯硫酸(H2SO4)为无色透明油状液体,几乎比水重一 倍,相对密度1.8269,不易挥发,溶于水时放热,有比较 强的腐蚀性和脱水性。
硫酸是重要的基本化学工业原料。在化肥、冶金、国防、 有机合成、石油炼制等工业都有广泛用途。
工业生产的硫酸指SO3和以H2O一定比例混合的溶液, 而发烟硫酸是其中SO3和H2O摩尔比大于1的溶液,发烟硫 酸由于SO3蒸气压较大,暴露在空气中能释放出SO3,和 空气中的水蒸气迅速结合并凝聚成酸雾而得名。硫酸浓度 以含的H2SO4质量分数表示,而发烟硫酸浓度以所含游离 SO3或总SO3的质量分数表示。
5
第一节 概述
➢ 1.结晶温度:
93.3%硫酸:-38℃(最低) 99%硫酸:+5.5℃(最高)
➢ 2.硫酸密度:
硫酸水溶液的密度随硫酸含量的增加而增大,于 98.3%时达到最大,过后则递减。
➢ 3.硫酸的沸点:
硫酸水溶液的沸点随硫酸含量的增加而增大,于 98.3%时达到最高(383.3℃),过后则递减。
15
一、硫铁矿焙烧的基本原理
2.焙烧速率
硫铁矿的焙烧是气-固非均相反应过程,反应是在气固 两相的接触表面上进行,整个反应过程由一系列反应步 骤组成:FeS2的分解;氧向硫铁矿表面扩散;氧与FeS反 应;生成的SO2由矿粒表面向气流主体扩散。另外还存在 着硫磺蒸汽向外扩散及氧与硫的反应等。
由前述硫铁矿的焙烧反应分两步进行的,为了提高 焙烧的反应速率,应该研究上列反应中哪一步反应是整 个过程的控制步骤。根据实验测得的结果,硫化亚铁的 焙烧反应速率是整个焙烧过程的控制步骤。
工业硫酸简易流程图
除去杂质气体、 粉尘、水
硫铁矿 制取二 氧化硫 原料气
二氧化 硫炉气 净化与
干燥
二氧化 硫的催 化氧化
尾气处理
三氧化 硫的吸 收
硫酸
1
硫酸
1 认识硫酸工业 2 硫铁矿制取二氧化硫炉气 3 炉气的净化与干燥 4 二氧化硫的催化氧化 5 三氧化硫的吸收及气净化与干燥的原理
硫铁矿制酸是辅助工序最多且最有代表性的化工过程。前 述的原料加工、焙烧、净化、吸收、三废处理,成品酸贮 存和计量工序在该过程中均有。
12
2 硫铁矿制取二氧化硫炉气
一、硫铁矿焙烧的基本原理 1.焙烧反应
硫铁矿的焙烧主要是矿石中的FeS2与空气中的氧反应, 生成SO2炉气。焙烧反应分两步进行: 第一步:硫铁矿在高温下受热分解为硫化亚铁和硫
10
1 概述
不论采用何种原料、何种工艺和设备,以上三个工序 必不可少,除三个基本工序外,再加上原料的贮存与加工, 含二氧化硫气体的净化,成品酸的贮存于计量,三废处理等 工序才构成一个接触法硫酸生产的完整系统。
实现上述这些工序所采用的设备和流程随原料种类、 原料特点、建厂具体条件的不同而变化,主要区别在于辅助 工序的多少及辅助工序的工作原理。
