新华制药克拉霉素片通过仿制药一致性评价
仿制药行业:一致性评价审批端进入加速期 即将迎来业绩兑现

仿制药行业:一致性评价审批端进入加速期即将迎来业
绩兑现
事件:
7 月26 日,国家药监局公布第五批通过仿制药质量和疗效一致性评价审评审批的名单。
本批共有8 个品种(16 个品规),其中属于289 目录的有5 个品种(11 个品规)。
为进一步提高工作效率,药监局对于后续品规不再分批公布,而是及时
收载入《中国上市药品目录集》,即动态公布。
点评:
目前共有65 个品规正式通过。
第五批通过一致性评价名单如期公布,本次16 个品规均符合我们7 月23 日周报《建议关注低估值、预期改善的医药流通板块》中的预测名单。
目前,共57 个品规通过补充申请形式完成一致性评价,有8
个品规通过其他路径完成一致性评价。
另有两个品规(普利制药的注射用阿奇霉素、正大天晴的富马酸替诺福韦二吡呋酯片)大概率即将收录进《中国上市药品目录集》。
目前,已有5 个注射剂品规正式通过了一致性评价,注射剂的一致性评
价已悄然进行。
一致性评价申请和审批端进入加速期。
自5 月份起,每月一致性评价新受理品规数量几乎是之前每月的3 倍。
众多品种在完成药学和BE 后(至少近一年
周期),进入到了申报环节。
我们认为,药监局调整公布方式是与时俱进的体现,标
志着一致性评价申请和审批端进入加速期。
支持政策陆续执行,即将迎来业绩兑现。
目前针对通过一致性评价品种的
支持配套政策如招标、采购、使用、医保等正陆续出台。
目前,已经有14 个省市出台了挂网采购政策,明确通过一致性评价的品种可以直接挂网采购。
其中,7 个。
一年17个药品过一致性评价的背后——齐鲁制药

一年17个药品过一致性评价的背后——齐鲁制药一致性评价过评数量作为衡量药企综合实力的重要标准,一直备受业内关注。
据国家药监局数据显示,2019年齐鲁制药集团通过一致性评价的药品为17个,过评数领跑行业。
值得关注的是,在17个通过一致性评价的产品中,12个为国内首家,6个目前为国内独家,最多的过审数、最具创新性的产品力再次擦亮了“齐鲁制药齐鲁造”的先进本色。
发力一致性评价,彰显齐鲁担当长期以来,看病难、用药贵困扰着众多患者,许多家庭为此背负了沉重的负担,特别是一些一线类药物长期被国外药企垄断,更让百姓用不起药。
在国家发布仿制药一致性评价政策后,齐鲁制药集团积极响应,加强科技攻关,持续加大对吉非替尼、利培酮、阿托伐他汀、奥氮平等受众广泛类药物的研究,力求减轻更多患者的负担。
在齐鲁制药人的共同努力下,各项研究取得了丰硕的成果。
截至目前,齐鲁制药共开展了70余个药物的一致性评价研究,已获批17个,其中12个为国内首家,已申报33个,其中22个为国内首家。
在国内制药企业一致性评价工作中,齐鲁制药项目的申报数量、速度和获批数量均遥遥领先。
助力建设美丽健康中国为顺应民众对美好生活的向往和期待,国家已经对建设健康中国作出全面部署。
为响应政府号召,齐鲁制药一方面加大对急难药物的科研攻关,另一方面对集团旗下产品实行“降价不降质”,如推动5000元一盒的吉非替尼片降价到500元一盒,受到社会各界好评。
在2019年第一轮国家药品集中采购中,齐鲁制药的吉非替尼、替诺福韦酯等几大明星产品凭借过硬的质量和较低的价格全部中标。
在近日公布的第二批国家集采名单中,齐鲁制药阿德福韦酯片、盐酸曲美他嗪缓释片、琥珀酸索利那新片、他达拉非片、替吉奥胶囊和注射用紫杉醇6款药物入围谈判竞标资格名单,相信齐鲁制药会在新一轮医药谈判中带给社会更多惊喜,为患者减轻更多负担。
当前医药体制改革仍然在不断深化,“4+7”带量集中采购等政策影响力开始显现,这对医药企业既是机遇也是挑战。
2024年克拉霉素片市场发展现状

2024年克拉霉素片市场发展现状引言克拉霉素片是一种常用的抗生素药物,广泛用于临床治疗各种感染性疾病。
随着人口增长、健康意识提高和医疗水平不断提高,克拉霉素片市场需求也在不断增加。
本文将对2024年克拉霉素片市场发展现状进行分析和总结,并展望未来的发展趋势。
市场现状分析市场规模扩大随着人口数量的增长和疾病的频发,克拉霉素片的市场需求不断扩大。
据市场调研数据显示,过去五年内,克拉霉素片市场的销售额年均增长率超过10%。
这主要得益于医疗技术的进步和人们对健康的关注度提高。
市场竞争加剧随着市场规模扩大,越来越多的企业涌入克拉霉素片市场。
当前市场上已经存在多家知名制药企业和品牌,竞争激烈。
这种竞争不仅表现在价格上的竞争,还表现在品质、效果和营销等方面。
品牌影响力差异明显在克拉霉素片市场上,一些知名制药企业和品牌具有较高的知名度和品牌影响力。
消费者普遍认为这些品牌的产品质量和疗效更可靠,因此愿意购买这些品牌的产品。
然而,同时也有一些中小型企业和品牌在市场中积极崛起,采取差异化的策略,通过研发新产品和市场定位来提升竞争力。
市场发展趋势展望创新研发是关键在竞争激烈的市场中,企业需要通过创新研发来提升产品品质和疗效。
克拉霉素片市场的发展趋势将更加注重产品的创新和改进,以满足不同消费者的需求。
同时,不断推出新产品和开展临床试验也是企业获取市场份额的关键。
健康管理需求崛起随着人们对健康的关注度提高,健康管理正逐渐成为一种趋势。
克拉霉素片作为一种常用的抗生素药物,在减少疾病传播和控制感染方面发挥着重要作用。
因此,未来市场发展趋势将包括见解健康管理和预防措施,提高人们对克拉霉素片的认知和使用。
线上销售渠道成为重要途径随着互联网的普及和快速发展,线上销售渠道成为了许多行业的重要途径,克拉霉素片市场也不例外。
越来越多的消费者倾向于在网上购买药品,因为这种方式灵活、方便、价格相对较低。
因此,未来市场发展趋势将更加强调线上销售渠道的建设和营销策略。
仿制药质量和疗效一致性评价工作介绍

阿托伐他汀钙片 阿莫西林胶囊
苯磺酸氨氯地平片 蒙脱石散
阿法骨化醇片 阿奇霉素片 奥氮平片
厄贝沙坦氢氯噻嗪片 恩替卡韦分散片
富马酸替诺福韦二吡呋酯片 卡托普利片 赖诺普利片
硫酸氢氯吡格雷片 氯沙坦钾片
马来酸依那普利片 恩替卡韦胶囊 福辛普利钠片
富马酸比索洛尔片 格列美脲片 吉非替尼片
BE 试验
受理 立卷审查
基于审 评需要 检查
技术 审评
基于审 评需要 检验
综合 审评
纳入 橙皮书
研究
审评
信息公开
工作程序1——药学研究
工作程序2——BE试验
伦理审查
BE试验合同
BE试验备案
信息登记
开展BE试验
719家药物 临床试验 机构
工作程序3-受理
2016年第105号公告
2017年第100号公告
17
《关于阿莫西林胶囊等7个品种规格
通过仿制药质量和疗效一致性评价的 7
公告(第三批)》(2018年第6号)
《关于蒙脱石散等16个品种通过仿制
药质量和疗效一致性评价的公告(第 五批)》(2018年第49号)
16
《关于瑞舒伐他汀钙片等5个品种通过仿制
5 药质量和疗效一致性评价的公告(第二
批)》(2018年第20号)
关于仿制药质量和疗效一 致性评价工作有关事项的 公告(2017年第100号)
关于规范使用“通过一致 性评价”标识的通知
关于阿托伐他汀钙片等12 个品种规格通过仿制药质 量和疗效一致性评价的公 告(第四批)(2018年第 24号) 附件2关于“通过一致性评 价”标识使用有关事宜的 说明
工作成效——推动供给侧结构性改革
仿制药一致性评价【范本模板】

仿制药一致性评价定义仿制药一致性评价是指对已经批准上市的仿制药,按与原研药品质量和疗效一致的原则,分期分批进行质量一致性评价,就是仿制药需在质量与药效上达到与原研药一致的水平。
药学研究是指通过体外溶出等分析方法对药物进行药学分析,其目的在于考察制剂的生产工艺及处方是否有需要变更,初步确认制剂与原研药的一致性。
生物等效性(bioequivalency , BE )是指在同样试验条件下试验制剂和对照标准制剂在药物的吸收程度和速度的统计学差异。
当吸收速度的差别没有临床意义时,某些药物制剂其吸收程度相同而速度不同也可以认为生物等效。
一站式服务我司作为提供专业的医药科技公司,能够提供包括:1、药学研究(CMC):包括:制剂处方工艺、质量研究(杂质及溶出曲线等)、稳定性考察等完整的药学研究过程2、生物等效性(BE):包括:寻找合作临床机构、招募受试者采血、生物样品测试及分析、数据管理及统计分析等全过程的服务3、需要进行大临床试验的品种,按照2017年已经颁布的指导原则,参照Ⅱ期、Ⅲ期临床试验的经验,提供整个临床试验的组织及监查管理服一致性评价(CMC&BE)的主要工作内容第一阶段:项目评估◆项目的市场价值◆竞争品种的多少◆是否有参比制剂◆评估需要的费用和周期◆咨询相关官员与专家◆项目立项确定进行BCSⅠ类或者Ⅲ类豁免BE的申请:高渗透性的数据与文献支持材料、体外溶出曲线数据的提供与分析,如果能够满足CFDA的2016年87号文《人体生物等效性试验豁免指导原则》就可以豁免BE研究。
第二阶段:药学研究(CMC)◆参比制剂的选择及备案◆购买参比制剂◆与参比制剂的质量对比(主要包含溶出曲线和杂质)◆药学等效判定◆处方工艺等的二次开发◆溶出曲线的对比◆处方工艺的确定及中试放大◆三批中试产品的工艺验证◆中试样品的质量和参比制剂的一致◆API的溶解性和渗透性研究(限BCS Ⅰ和BCS Ⅲ类)◆制剂稳定性和包装考察◆申报资料的撰写及整理,提供原始记录第三阶段:BE研究API的BCS分类属于Ⅱ和Ⅳ的产品必须进行BE研究,不能够豁免;BCSⅠ类或者Ⅲ类,符合豁免BE的条件可以不进行BE研究,否则就必须进行BE研究.◆BE研究方案的制定◆统计分析计划的制定◆Ⅰ期临床基地、生物样品测试单位等的确定◆伦理委员会的审核◆在CDE的BE备案◆生物样品分析方法的验证◆招募受试者◆服用药物及生物样品的采集◆生物样品的分析◆数据管理及统计分析◆撰写总结报告。
通过(视同通过)质量和疗效一致性评价仿制药(第三批)审
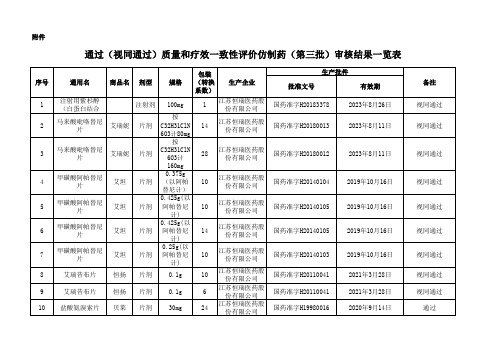
2023年5月22日
视同通过
1
海南普利制药股 份有限公司 石药集团欧意药 业有限公司 广东东阳光药业 有限公司 广东东阳光药业 有限公司
国药准字H20173261
2022年7月25日
通过
46 47 48
1 3 3
国药准字H20183044 国药准字H20183226 国药准字H20183246
2023年2月1日 2023年6月27日 2023年7月5日
56
盐酸舍曲林片
50mg
14
国药准字H20051076
2020年3月12日
通过
57 58 59 60 61 62
盐酸舍曲林片 恩替卡韦胶囊 苯磺酸氨氯地平 片 恩替卡韦分散片 恩替卡韦分散片 恩替卡韦分散片 安内真
50mg 0.5mg 5mg 0.5mg 0.5mg 0.5mg
28 7 21 7 14 28
3
艾瑞妮
片剂
28
国药准字H20180012
2023年8月11日
视同通过
4
艾坦
片剂
10
国药准字H20140104
2019年10月16日
视同通过
5
艾坦
片剂
10
国药准字H20140105
2019年10月16日
视同通过
6
艾坦
片剂
14
国药准字H20140105
2019年10月16日
视同通过
7 8 9 10
艾坦 恒扬 恒扬 贝莱
视同通过 视同通过 视同通过
序号 49 50 51 52 53 54 55
通用名 阿托伐他汀钙片 注射用还原型谷 胱甘肽 注射用还原型谷 胱甘肽 盐酸二甲双胍片 盐酸二甲双胍片 盐酸二甲双胍片 阿莫西林胶囊
新华制药:关于布洛芬片(0.1g和0.2g)通过仿制药一致性评价的公告

证券代码:000756 证券简称:新华制药公告编号:2020-23山东新华制药股份有限公司关于布洛芬片(0.1g和0.2g)通过仿制药一致性评价的公告本公司及董事会全体成员保证信息披露内容的真实、准确和完整,没有虚假记载、误导性陈述或重大遗漏。
近日,山东新华制药股份有限公司(“新华制药”或“本公司”)收到国家药品监督管理局核准签发的布洛芬片(0.1g和0.2g)(“该产品”)《药品补充申请批件》,该产品通过仿制药质量和疗效一致性评价(“仿制药一致性评价”)。
本公司成为国内布洛芬片0.2g第一家、0.1g第二家通过仿制药一致性评价的企业。
现将相关情况公告如下:一、基本情况1.药品名称:布洛芬片剂型:片剂规格:0.1g和0.2g药品分类:非处方药注册分类:化学药品申请人:山东新华制药股份有限公司申请事项:仿制药质量和疗效一致性评价受理号:CYHB1950333、CYHB1950334药品批准文号:国药准字H37020387、国药准字H37020386批件号:2020B02994、2020B02995审批结论:通过仿制药质量和疗效一致性评价2.其他相关信息2019年4月新华制药向国家药品监督管理局递交布洛芬片(0.1g和0.2g)仿制药一致性评价注册申报资料并获受理,同年10月31日CDE发出补充研究通知,2020年1月公司完成补充资料的递交,2020年5月通过仿制药质量和疗效一致性评价审评并获得《药品补充申请批件》。
布洛芬片为解热镇痛类非处方药品,是医保甲类药品,用于缓解轻至中度疼痛如头痛、关节痛、偏头痛、牙痛、肌肉痛、神经痛、痛经,也用于普通感冒或流行性感冒引起的发热。
布洛芬是世界卫生组织、美国FDA共同推荐的儿童退烧药,是公认的儿童抗炎药。
据Insight数据库统计,目前于中国境内上市的布洛芬片企业305家,申请仿制药一致性评价的企业6家。
新华制药生产的0.2g布洛芬片为国内首家通过一致性评价产品。
通过视同通过质量和疗效一致性评价仿制药第三批
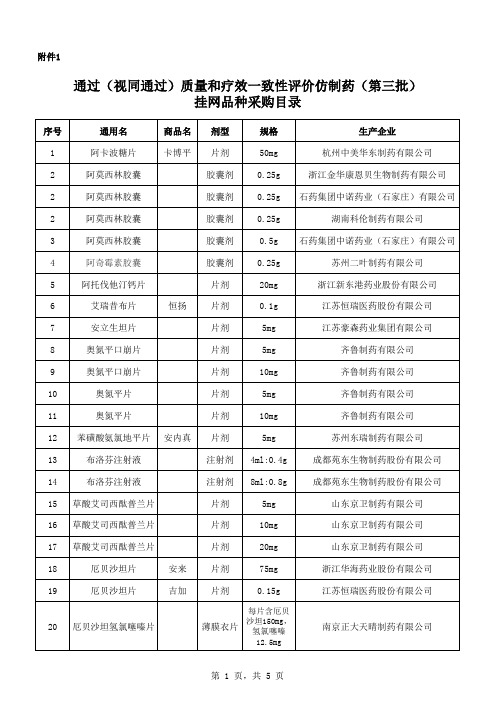
胶囊剂 0.15g
浙江华海药业股份有限公司
浙江华海药业股份有限公司 江苏恒瑞医药股份有限公司
山东裕欣药业有限公司 浙江华海药业股份有限公司
浙江华海药业股份有限公司
江苏德源药业股份有限公司 广东华南药业集团有限公司 上海上药中西制药有限公司 重庆药友制药有限责任公司 四川科伦药业股份有限公司 重庆药友制药有限责任公司 四川科伦药业股份有限公司
齐鲁制药有限公司
江苏恒瑞医药股份有限公司
江苏恒瑞医药股份有限公司
江苏恒瑞医药股份有限公司
四川科伦药业股份有限公司 广东东阳光药业有限公司
浙江华海药业股份有限公司 深圳信立泰药业股份有限公司 浙江华海药业股份有限公司
第 2 页,共 5 页
附件1
通过(视同通过)质量和疗效一致性评价仿制药(第三批) 挂网品种采购目录
浙江华海药业股份有限公司
51
缬沙坦片
片剂
以缬沙坦 (C24H29N5 O3)计80mg
52
缬沙坦片
53
盐酸氨溴索片
贝莱
53
盐酸氨溴索片
54
盐酸多奈哌齐片
55
盐酸多奈哌齐片
56 盐酸二甲双胍缓释片
片剂 片剂 片剂 片剂
片剂
片剂
以缬沙坦 (C24H29N5
O3)计 160mg
30mg
30mg
按 C24H29NO3 ·HCl计
咀嚼片
上海安必生制药有限公司(药品上市许
4mg
可持有人);杭州民生滨江制药有限公
司(受托生产企业)
41 孟鲁司特钠咀嚼片
咀嚼片
上海安必生制药有限公司(药品上市许
5mg
可持有人);杭州民生滨江制药有限公
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
新华制药克拉霉素片通过仿制药一致性评价
作者:梁晴袁星辉
来源:《山东国资》 2020年第7期
本刊记者梁晴/通讯员袁星辉
本刊讯记者从新华制药股份有限公司(以下简称“新华制药”)了解到,近日,新华制药又一重点抗感染药物——克拉霉素片(0.25g)通过仿制药质量和疗效一致性评价。
至此,新华制药已有10个品规的固体口服制剂通过了仿制药一致性评价。
这标志着新华制药“大研发战略”取得又一项重要科研成果,为公司新旧动能转换、做大做强抗感染药物体系奠定了坚实基础。
新华制药于2017年初启动该品种一致性评价工作,和有关部门及车间密切配合,从信息查阅、实验室研究、中试生产,到生物等效性研究、资料申报等多环节严格把关,稳扎稳打,确
保了公司生产的克拉霉素片与原研药质量和疗效的一致性,实现了临床可替代。
据了解,克拉霉素是大环内酯类抗生素类重要药物,因其酯环的6位羟基为甲基取代,不
仅克服了红霉素副作用大和耐受性差的缺陷,还对敏感菌的抗菌活性有显著提高,对多种需氧和厌氧的革兰阳性、革兰阴性菌也具有抗菌作用。
临床上适用于克拉霉素敏感菌所引起的感染有:鼻炎感染、呼吸道感染、皮肤软组织感染、急性中耳炎、支原体肺炎、沙眼衣原体引起的尿道
炎及宫颈炎等,也用于军团菌感染或与其他药物联合用于鸟分枝杆菌感染、幽门螺旋杆菌感染
的治疗。
新华制药副总经理、研究院院长郑忠辉告诉记者:“此次产品能够通过一致性评价,标志
着该产品质量和疗效具备了最高水准,将完全实现临床替代。
在极大提升市场竞争力的同时,也为后续仿制药一致性评价产品的研发工作积累了宝贵经验,为企业进一步调整产品结构和转型发展提供了有力支撑。
”
记者了解到,2016年3月,国家启动药品医疗器械审评审批制度改革,其中推进仿制药质
量和疗效一致性评价是改革的重点任务之一。
只要是化学药品新注册分类实施前批准上市的仿
制药,无论是国产仿制药,还是进口仿制药、原研药品地产化品种,凡未按照与原研药品质量
和疗效一致性原则审批的,均须开展一致性评价。
此举可以使仿制药在质量和疗效上与原研药
一致,在临床上可替代原研药,不仅可以节约医疗费用,也可提升我国的仿制药质量和制药行
业的整体发展水平,保证公众用药安全有效。
“新华制药力争让百姓吃上放心药、便宜药。
目前公司一致性评价工作正处于收获期,通
过数量在全国位居前列。
现在还有30个产品正在进行全力攻关。
下一步,公司将围绕全球重大研制方向、重大疾病进展和重大技术平台,密切跟进国际制药研发进程,推进化学小分子、生
物大分子以及新型给药系统的仿制和创新产品线的战略布局。
”郑忠辉对记者说。
责任编辑张小杰。
