难点4 电解质溶液曲线分析(原卷版)
微专题 四大平衡常数的计算与应用(原卷版)--2025年高考化学微专题
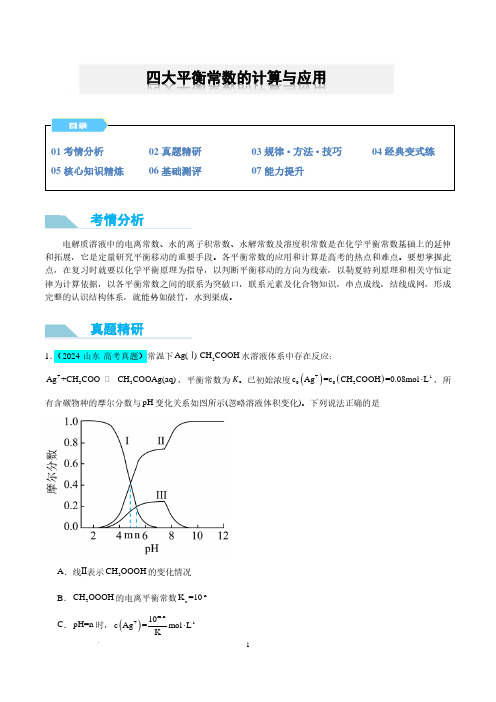
四大平衡常数的计算与应用考情分析真题精研D .pH=10时,()()+-13c Ag+c CH COOAg =0.08mol L⋅2.(2024·安徽·高考真题)环境保护工程师研究利用2Na S 、FeS 和2H S 处理水样中的2+Cd 。
已知25℃时,2H S 饱和溶液浓度约为-10.1mol L ⋅,()-6.97a12K H S =10,()-12.90a22K H S =10,-17.20sp K (FeS)=10,-26.10sp K (CdS)=10。
下列说法错误的是A .2Na S 溶液中:()()()()()+--2-c H+c Na =c OH +c HS +2c S +B .-120.01mol L Na S ⋅溶液中:()()()()+2---c Na >c S >c OH >c HSC .向()2+-1c Cd=0.01mol L⋅的溶液中加入FeS ,可使()2+-8-1c Cd <10mol L ⋅D .向()2+-1c Cd=0.01mol L⋅的溶液中通入2H S 气体至饱和,所得溶液中:()()+2+c H >c Cd注意:(1)四大平衡的基本特征相同,包括逆、动、等、定、变,其研究对象均为可逆变化过程。
(2)溶解平衡有放热反应、吸热反应,升高温度后K sp 可能变大或变小;而电离平衡、水解平衡均为吸热过程,升高温度K a (或K b )、K h 均变大。
规律·方法·技巧A .pH=6.5时,溶液中()()2-2+3c CO <c PbB .()()2+3δPb=δPbCO 时,()2+c Pb <1.010×()-1M lg c /mol L ⋅(M 代表+Ag 、-Cl 或2-4CrO )随加入NaCl 溶液体积(V)的变化关系如图所示(忽略溶液体积变化)。
下列叙述正确的是经典变式练核心知识精炼(1)A、C、B三点均为中性增大(2)D点为酸性溶液,E点为碱性溶液(1)a、c点在曲线上,a→c Na2SO4固体,但K sp不变基础测评1.(2024·陕西商洛·模拟预测)室温下,用-10.1mol L ⋅的二甲胺()32CH NH 溶液(二甲胺在水中的电离与一水合氨相似)滴定-110.00mL0.1mol L ⋅盐酸溶液。
备考突破 高三化学专题强化集训——弱电解质溶液中的曲线问题分析(含解析)

备考突破2020高三化学专题强化集训——弱电解质溶液中的曲线问题分析(含解析)1.向等物质的量浓度的HCl、、、混合溶液中逐滴加入的NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示。
下列有关说法正确的是A. 在~段加入的NaOH溶液与反应B. 在~段加入NaOH溶液发生反应的离子方程式为C. 在~段加入NaOH溶液发生反应的离子方程式为D. 在滴加NaOH溶液全过程中主要粒子参与反应的先后顺序是、、、、2.下列离子方程式,书写正确的是A. 盐酸与石灰石反应B. 硫酸铜溶液中滴加氢氧化钡溶液C. 硝酸银溶液中加入铜粉D. 铁与稀盐酸反应3.下列有关物质的性质和应用对应正确的是A. 炭在常温下化学性质不活泼,因此在埋木桩前,可将埋入地下的一段表面用火微微烧焦B. 碳酸钠的水溶液呈碱性,医学上能用于治疗胃酸过多C. 盐酸与苛性钠可自发进行反应,该反应可以设计成原电池D. 次氯酸具有强氧化性,可以起到除去水中悬浮的杂质和杀菌消毒作用4.工业上用铝土矿主要成分,含、等杂质冶炼铝的主要流程如图:注:碱溶时转变为铝硅酸钠沉淀下列叙述错误的是A. 操作I增大NaOH溶液用量可提高的浸取率B. 操作Ⅱ、Ⅲ为过滤,操作Ⅳ为灼烧C. 通入过量的离子方程式为D. 加入的冰晶石目的是降低的熔融温度5.过氧化钠与碳酸氢钠固体混合后,在密闭容器中加热充分反应,排出气体物质后冷却,残留的固体物质是A. B.C. D. NaOH6.有铜和氧化铁的混合物a g,当慢慢滴入的HCl溶液、边滴边振荡,至50mL时混合物恰好完全溶解.若将a g该混合物在CO气流中加热并充分反应,冷却后剩余固体中铜的质量可能为A. 等于B. 大于C. 大于D. 等于7.常温下,用溶液滴定新配制的溶液,应用手持技术测定溶液的pH与时间的关系,结果如图所示。
下列说法错误的是A. ab段,溶液中发生的主要反应:B. bc段,溶液中C. d点,溶液中的离子主要有、、D. 滴定过程发生了复分解反应和氧化还原反应8.室温下,向溶液中逐滴加入盐酸,溶液含R微粒的物质的量分数与pH关系如图所示不稳定,易转化为气体逸出溶液,气体逸出未画出,忽略因气体逸出引起的溶液体积变化。
(新高考新教材)2024届高考化学一轮复习 电解质溶液中的图像及分析 教学课件

c(HgCl2)=c(HgCl
),则有
c(Cl
)+3c(HgCl
)>c(H
)-c(OH
),C 正确。若 P 点
4
3
4
pH=7,根据电荷守恒 c(Cl-)+c(NO-3 )=2c(Hg2+)+c(HgCl+)+c(Na+),P 点
+
(HgCl
)·
(Cl
)
-6.74
=10 ,K3=
=10-6.48,
C.当 V(NaOH 溶液)=25 mL
2时,草酸溶液中:c(HC2O4 )>c(H2C2O4)>c(C2O4 )
D.当 V(NaOH 溶液)=50 mL 时,磷酸溶液中:
-
+
c(OH )-c(H
3)=2c(H3PO4)+c(H2PO4 )-c(PO4 )
答案 C
1 2 3 4 5 6 7 8 9
解析 当加入的NaOH溶液达到50 mL时,曲线X、Y的pH发生两次突变,Z发
L-1,此时
错误。
1 2 3 4 5 6 7 8 9
=10-1,
=10-6.74,在 X 点
(Hg2+ )
(HgCl+ )
=
10-6.74
-0.26
=10
,B
-6.48
10
根据电荷守恒,在 Q 点:c(Cl-)+2c(HgCl2)+c(HgCl
)+c(OH
)+c(NO
4
3
3)
=c(H+)+c(Na+),Hg2+平均配位数约为 3,所以 c(NO-3 )<c(Na+),
新教材2024高考化学二轮专题复习专题9电解质溶液考点2电解质溶液曲线分析教师用书
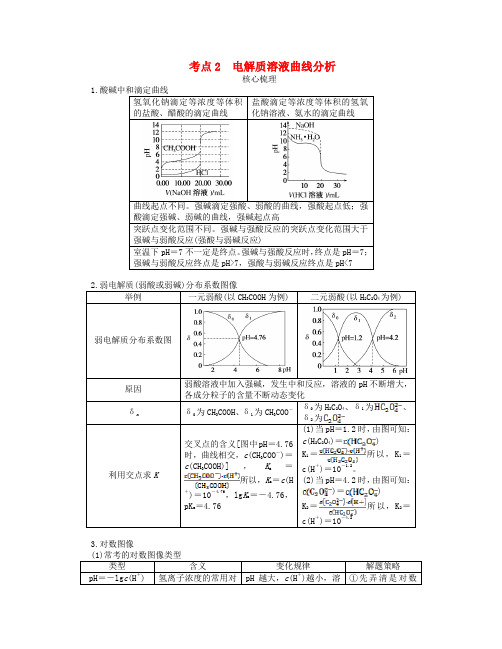
考点2 电解质溶液曲线分析核心梳理1.酸碱中和滴定曲线氢氧化钠滴定等浓度等体积的盐酸、醋酸的滴定曲线盐酸滴定等浓度等体积的氢氧化钠溶液、氨水的滴定曲线曲线起点不同。
强碱滴定强酸、弱酸的曲线,强酸起点低;强酸滴定强碱、弱碱的曲线,强碱起点高突跃点变化范围不同。
强碱与强酸反应的突跃点变化范围大于强碱与弱酸反应(强酸与弱碱反应)室温下pH=7不一定是终点。
强碱与强酸反应时,终点是pH=7;强碱与弱酸反应终点是pH>7,强酸与弱碱反应终点是pH<72.弱电解质(弱酸或弱碱)分布系数图像举例一元弱酸(以CH3COOH为例) 二元弱酸(以H2C2O4为例) 弱电解质分布系数图原因弱酸溶液中加入强碱,发生中和反应,溶液的pH不断增大,各成分粒子的含量不断动态变化δnδ0为CH3COOH、δ1为CH3COO-δ0为H2C2O4、δ1为、δ2为利用交点求K 交叉点的含义[图中pH=4.76时,曲线相交,c(CH3COO-)=c(CH3COOH)],K a=所以,K a=c(H+)=10-4.76,lg Ka=-4.76,pK a=4.76(1)当pH=1.2时,由图可知:c(H2C2O4)=)K1=所以,K1=c(H+)=10-1.2。
(2)当pH=4.2时,由图可知:)=)K2=所以,K2=c(H+)=10-4.23.对数图像类型含义变化规律解题策略pH=-lg c(H+) 氢离子浓度的常用对pH越大,c(H+)越小,溶①先弄清是对数数负值液的碱性越强还是负对数②弄清楚是什么的对数,如浓度对数、浓度比对数、体积比对数等③弄清楚对数变化所表示的意义 pC =-lg c (C) C 离子浓度的常用对数负值pC 越大,c (C)越小lg生成物与反应物粒子浓度比的常用对数 lg 越大,反应向正反应方向进行的程度越大lg 稀释后与稀释前体积比的常用对数 lg 越大,稀释程度越大 AG =lg氢离子与氢氧根离子浓度比的常用对数AG 越大,酸性越强,中性时,=1,AG =0(2)对数图像分析示例 lg c (x )与pH 关系图当弱电解质的成分粒子的浓度c (x )经对数处理后,就得到lg c (x )与pH 的直线关系图。
04考向4电解质溶液的图像分析酸碱中和滴定曲线(附答案解析)-2023年高考化学大二轮专题突破

电解质溶液的图像分析——酸碱中和滴定曲线【研析真题•明方向】1.(2018·浙江卷)常温下,分别取浓度不同、体积均为20.00mL的3种HCl溶液,分别滴入浓度为1.000mol·L1,0.1000mol·L1和0.01000mol·L1的NaOH溶液,测得3个反应体系的pH随V(NaOH)的变化的曲线如图,在V(NaOH)=20.00mL前后出现突跃。
下列说法不正确...的是()A.3种HCl溶液的c(HCl):最大的是最小的100倍B.曲线a、b、c对应的c(NaOH):a>b>cC.当V(NaOH)=20.00mL时,3个体系中均满足:c(Na+)=c(Cl)D.当V(NaOH)相同时,pH突跃最大的体系中的c(H+)最大2.(2016·全国卷Ⅰ)298 K时,在20.0 mL 0.10 mol·L-1氨水中滴入0.10 mol·L-1的盐酸,溶液的pH与所加盐酸的体积关系如图所示。
已知0.10 mol·L-1氨水的电离度为1.32%,下列有关叙述正确的是()A.该滴定过程应该选择酚酞作为指示剂B.M点对应的盐酸体积为20.0 mLC.M点处的溶液中c(NH+4)=c(Cl-)=c(H+)=c(OH-) D.N点处的溶液中pH<123.(2016·天津卷)室温下,用相同浓度的NaOH溶液,分别滴定浓度均为0.1 mol·L-1的三种酸(HA、HB和HD)溶液,滴定曲线如图所示,下列判断错误的是()A.三种酸的电离常数关系:K HA>K HB>K HDB.滴定至P点时,溶液中:c(B-)>c(Na+)>c(HB)>c(H+)>c(OH-)C.pH=7时,三种溶液中:c(A-)=c(B-)=c(D-)D.当中和百分数达100%时,将三种溶液混合后:c(HA)+c(HB)+c(HD)=c(OH-)-c(H+)4.(2015·山东卷)室温下向10 mL 0.1 mol·L-1NaOH溶液中加入0.1 mol·L-1的一元酸HA,溶液pH的变化曲线如图所示。
高考化学一轮复习专题突破--电解质溶液中的图像分析(中高难度)

2022届高考化学一轮复习专题突破--电解质溶液中的图像分析(中高难度)一、单选题(本大题共15小题,共60.0分)1.常温下,向浓度均为0.1mol·L−1、体积均为100mL的两种一元酸HX、HY的溶液中分别加入NaOH固体,lg c(H+)随加入NaOH的物质的量的变化情况如图所c(OH−)示。
下列叙述正确的是()A. HX的酸性弱于HY的酸性B. a点由水电离出的c(H+)=1×10−12mol·L−1C. c点溶液中:c(Y−)>c(HY)D. b点时酸碱恰好完全中和2.向7.5mL0.03mol·L−1的H3PO4溶液中,逐滴加入相同浓度的NaOH溶液,溶液pH与NaOH溶液体积关系如图所示,已知K a1>K a2>K a3,下列说法错误的是()A. H3PO4第一级电离平衡常数K a1的数量级为10−3B. 水的电离程度:b<cC. b点溶液中离子浓度:c(Na+)>c(H2PO4−)>c(HPO42−)>c(PO43−)>c(H+)>c(OH−)D. c点溶液中:2c(H3PO4)+c(H2PO4−)+c(H+)=c(OH−)+c(PO43−)3.常温时,0.1mol⋅L−1的H3AsO4溶液用NaOH调节pH得到一组c(H3AsO4)+c(H2AsO4−)+c(HAsO42−)+c(AsO43−)=0.1mol⋅L−1的溶液,各含砷微粒的物质的量的分布分数如图所示,下列说法错误的是()A. M点时,pH=−lgK a1B. 0.1mol⋅L−1的NaH2AsO4溶液中:c(H2AsO4−)>c(HAsO42−)>c(H3AsO4)C. N点时,c(Na+)>0.3mol⋅L−1−3c(HAsO42−)−3c(H3AsO4)D. P点时,c(Na+)>c(H2AsO4−)+5c(AsO43−)4.如图表示水中c(H+)和c(OH−)的关系.下列判断正确的是()A. 图中T1>T2B. XZ线上任意点均有pH<7C. 两条曲线间任意点均有c(H+)×c(OH+)=K w=1×10−13D. M区域内任意点对应的溶液中下列离子均可大量共存:S2−、SO42−、Na+、Cl−5.丙三酸(用H3A表示)是一种三元有机中强酸。
高考化学热点电解质溶液图像分析
高考电解质溶液中的图像分析1、弱酸H2A 溶液中,存在H2A、HA-和A2-三种形态的粒子,其物质的量分数δ(X)随溶液pH变化的关系如图所示[已知δ(X) = ],下列说法不正确的是(图中:a=1.25、b=4.27)()A. 已知pK a=-lgK a,则pK a1=1.25B. 0.1mol·L-1的NaHA溶液显碱性C. 0.1mol·L-1Na2A溶液中:2c(H2A)+c(HA-)=c(OH-)-c(H+)D. 0.1mol·L-1NaHA溶液中:c(Na+)+c(A2-)+c(H2A)+c(HA-)=0.2mol·L-12、常温下,向20mL0.2 mol·L-1H2A溶液中滴加0.2 mol·L-1NaOH溶液。
有关微粒的物质的量变化如图所示(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-),根据图示判断,下列说法正确的是()A. 当V( NaOH )= 20mL时,pH<7B. 当V(NaOH)= 20mL时,溶液中离子浓度大小关系为c(Na+)>c(A2-)>c(OH-)>c(HA-)>c(H+)C. 当V(NaOH)= 10mL时,有c(Na+)=2[c(HA-)+c(A2-)+c(H2A)]D. 当V(NaOH)= 30mL时,2c(H+)+3c(H2A)+c(HA-)= 2c(OH-)+c(A2-)3、25℃时,向H2CO3溶液中滴入NaOH溶液,溶液中H2CO3、HCO3-及CO32-的物质的量分数δ(X)随溶液pH 的变化如图所示{δ(X)=[c(X)/c(H2CO3)+c(HCO3-)+c(CO32-)]×100%}。
下列说法错误的是()A. H2CO3的一级电离平衡常数的对数值lgK1(H2CO3)=-6.38B. pH=13时,c(Na+)十c(H+)=c(OH-)+2c(CO32-)C. 25℃时,反应CO32-+H2O HCO3-+OH-的平衡常数对数值1gK=-3.79D. pH=7时,c(HCO3-)>c(H2CO3)> c(CO32-)4、室温下,1mol·L-l的某二元酸H2A溶液中,存在的HA-、A2-的物质的量分数随pH变化的关系如图所示,下列说法不正确的是( )A. H2A的电离方程式为:H2A==H++HA-HA-A2-+H+B. 室温下,电离平衡HA-A2-+H+的平衡常数Ka=10-3C. 等物质的量浓度NaHA和Na2A溶液等体积混合,离子浓度大小关系为:c(Na+)>c(HA-)>c(A2-)D. 在Na2A溶液中存在c(Na+)=2c(A2-)+2c(HA-)5、室温下,用0.1000mol/L盐酸分别滴定20.00mL浓度均为0.1000mol/L氢氧化钠溶液和氨水,滴定过程中溶液pH随加入盐酸体积V[HCl(aq)]的变化关系如图所示。
选择题题型03 电解质溶液图像分析
题型03 电解质溶液图像分析1.电解质溶液中的三大平衡分析判断电离平衡CH3COOH CH3COO-+H+水解平衡(如CH3COONa溶液)CH3COO-+H2OCH3COOH+OH-沉淀溶解平衡AgCl(s)Ag+(aq)+Cl-(aq)2.强酸(碱)和弱酸(碱)稀释图像(1)同体积、相同浓度的盐酸、醋酸(2)相同体积、相同pH 的盐酸、醋酸(3)pH 与稀释倍数的线性关系3.酸碱中和滴定曲线 (1)滴定曲线特点(2)滴定曲线上的特殊点的分析示例:常温下,用0.100 0 mol·L-1 NaOH溶液滴定20.00 mL 0.100 0 mol·L-1 CH3COOH溶液所得滴定曲线如图。
①pH—V图各特殊点对水电离程度的影响根据图中pH数据,图中A、B、C、D、E、F各点对应的溶液中水的电离程度大小顺序图示:②pH —V 图 各特殊点粒子大小关系及变化趋势4.根据图形节点求算弱电解质电离平衡常数 (1)由图形起点计算平衡常数示例:常温下,向20 mL 0.1 mol/L 氨水中滴加一定浓度的稀盐酸,溶液中水电离的氢离子浓度随加入盐酸体积的变化如图所示。
分析:由图中a 点可知,常温下0.1 mol/L 的氨水中c (H +)=1.0×10-11mol/L ,c (OH-)=K w /c (H +)=1.0×10-3mol/L ,所以K b =c (NH +4)·c (OH -)c (NH 3·H 2O )≈10-3×10-30.1 mol/L =1×10-5 mol/L 。
(2)由图形交点计算平衡常数示例:常温下,向某浓度的草酸溶液中逐滴加入一定物质的量浓度的KOH 溶液,所得溶液中H 2C 2O 4、HC 2O -4、C 2O 2-4三种微粒的物质的量分数(δ)与溶液pH 的关系如图所示分析:由图像可知:pH =1.2时,c (HC 2O -4)=c (H 2C 2O 4),则K a1=c (HC 2O -4)·c (H +)c (H 2C 2O 4)=c (H +)=10-1.2,pH =4.2时,c (HC 2O -4)=c (C 2O 2-4),K a2=c (H +)·c (C 2O 2-4)c (HC 2O -4)=c (H +)=10-4.2。
高考化学复习专题电解质溶液中的曲线问题
NH
4
c NH3 H2O ]。下列判断正确的是(
)
A.曲线 L1 代表δ(NH4+)与 pH 的变化关系
B.NH3∙H2O 的电离常数 Ka(NH3∙H2O)=1.0×10-4.7
C.水的电离程度:P>M
D.P 点时混合溶液中存在:c(Cl-)=c(NH4+)+c(NH3∙H2O)
7.草酸(H2C2O4)是一种二元弱酸,在菠菜、苋菜、甜菜等植物中含量较高。25℃时,
C.0.1mol/LNaHC2O4 溶液中:c(Na+)>c(HC2O4-)>c(H2C2O4)>c(C2O42-)
D.已知:碳酸的 Ka1=4.3×10-7,Ka2=5.6×10-11,则向 Na2CO3 溶液中加入等物质的量的
草酸溶液,反应的离子方程式为 CO32-+H2C2O4==C2O42-+H2O+CO2↑
A.X 是 HA,M 是 HB B.常温下 pH:NaA 溶液>NaB 溶液
cR C.常温下,对于 cHR c OH 的值(R 代表 A 或 B),一定存在 HA>HB
D.若常温下浓度均为 0.1mol/L 的 NaA 和 HA 的混合溶液的 pH>7,则 c(A-)>c(HA) 15.室温时,用 0.100mol/L 盐酸滴定 50.0mL Na2CO3 溶液(不考虑 CO2 从溶液中逸出), 滴定曲线如图所示,下列说法错误的是
试卷第 6页,总 13页
INPUT COMPANY NAME
A.a 点溶液中:c(Na2CO3)=0.020mol/L B.b 点溶液中:c(Na+)>c(HCO3-)>c(CO32-) C.c 点溶液中:c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-) D.室温时,H2CO3 的一级电离平衡常数 Ka1 的数量级为 10-7 16.室温下,向 10mL0.2000mol/LNaOH 溶液中滴加 0.2000mol/L 的一元酸 HA,溶液
高中化学高考复习课件:电解质溶液图像类题目分析
D.b点:c(Cl-)>c(Br-)>c(I-)>c(Ag+)
3.(2021·山东,15)赖氨酸[H3N+(CH2)4CH(NH2)COO-,用 HR 表示]是人体必需氨基酸,
其 盐 酸 盐 (H3RCl2) 在 水 溶 液 中 存 在 如 下 平 衡 : H3R2 + K1 H2R +
电解质溶液图像类题目分析
滴定曲线的分析与应用
滴定曲线的分析与应用
1.巧抓“四点”,突破溶液中的粒子浓度关系 (1)抓反应“一半”点,判断是什么溶质的等量混合。 (2)抓“恰好”反应点,生成的溶质是什么?判断溶液的酸碱性。 (3)抓溶液的“中性”点,生成什么溶质,哪种物质过量或不足。 (4)抓反应的“过量”点,溶液中的溶质是什么?判断哪种物质过量。
[实例2] 25 ℃时,向某浓度的H3PO4溶液中逐滴加入一定浓度的NaOH溶液,所得 溶液中四种微粒H3PO4、H2PO- 4 、HPO24-、PO34-的物质的量分数(δ)与pH的 关系如图所示: 回答下列问题: (1)δ0、δ1、δ2、δ3分别代表的微粒是 _H__3_P_O_4__、__H__2P_O__-4__、__H__P_O_24_-__、 ___P_O_34_-__。
cH2A+ccHAA2--+cA2-]与溶液
pH
关系如图。下列说法错误的是
NH3+CH2COOH NH3+CH2COO-
A.甘氨酸具有两性 B.曲线 c 代表 NH2CH2COO-
NH2CH2COO-
C.NH+ 3 CH2COO-+H2O NH+ 3 CH2COOH+
OH-的平衡常数 K=10-11.65
•D. 曲线Ⅱ代表的是MD nS
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
难点4 电解质溶液曲线分析
【命题规律】
本专题的考查点主要是弱电解质的电离平衡和盐类水解相结合,进行综合考察。
为高考的中频考点,命题形式以选择题为主,试题难度中等。
考查的核心素养以证据推理与模型认知为主。
【备考建议】
2020年高考备考应重点关注数形结合与分析推理型选择题。
【限时检测】(建议用时:30分钟)
1.(2019·安徽省六安市第一中学高考模拟)常温下用NaOH溶液滴定H2C2O4溶液溶液中﹣lg
() ()
224
H
H C O
c
+
和
﹣lg c(HC2O4-)[或-lg
()
()
24
H
HC O
c
c
+
-
和﹣lgc(C2O42-)]的关系如图所示。
下列说法正确的是()
A. 曲线N表示-lg
()
()
24
c H
c HC O
+
-
和﹣lgc(C2O42-)的关系
B. K a1(H2C2O4)的数量级为10﹣1
C. 向NaHC2O4溶液中加少量NaOH至c(HC2O4﹣)和c(C2O42﹣)相等,此时溶液pH约为4
D. 在Na2C2O4和NaHC2O4物质的量为1:1的混合溶液中c(Na+)>c(C2O42﹣)>c(HC2O4﹣)>c(H2C2O4)>
c(OH-)>c(H+)
2.(2019·黑龙江省大庆一中高考模拟)用0.1 mol·L-1 NaOH溶液滴定40 mL 0.1 mol·L-1 H2SO3溶液,所得
滴定曲线如图所示(忽略混合时溶液体积的变化)。
下列叙述错误的是()
A. K a2(H2SO3)的数量级为10-8
B. 若滴定到第一反应终点,可用甲基橙作指示剂
C. 图中Z点对应的溶液中:c(Na+)>c(SO32-)>c(HSO3-)>c(OH-)
D. 图中Y点对应的溶液中:3c(SO32-)=c(Na+)+c(H+)-c(OH-)
3.(2019·东北育才学校科学高中部高考模拟)常温下向20mL 0.1mol/L氨水中通入HCl气体,溶液中由水
电离出的氢离子浓度随通入HCl气体的体积变化如图所示。
则下列说法正确的是
A. b点通入的HCl气体,在标况下为44.8mL
B. b、c之间溶液中c(NH4+)>c(Cl-)
C. 取10mL的c点溶液稀释时:c(NH4+)/c(NH3·H2O)减小
D. d点溶液呈中性
4.(2019·山东省济南外国语学校高考模拟)已知HA的酸性弱于HB的酸性。
25℃时,用NaOH固体分别改
变物质的量浓度均为0.1 mol•L-1的HA溶液和HB溶液的pH(溶液的体积变化忽略不计),溶液中A-、B-的物质的量浓度的负对数与溶液的pH的变化悄况如图所示。
下列说法正确的是( )
A. 曲线Ⅰ表示溶液的pH 与-lgc (A -)的变化关系
B.
100
()
a a K HB K HA ()= C. 溶液中水的电离程度:M>N
D. N 点对应的溶液中c (Na +)>Q 点对应的溶液中c (Na +)
5.(2019·四川省成都市石室中学高考模拟)向等物质的量浓度Na 2S 、NaOH 混合溶液中滴加稀盐酸至过量。
其中主要含硫各物种(H 2S 、HS -、S 2-)的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与滴加盐酸体积的关系如图所示(忽略滴加过程H 2S 气体的逸出)。
下列说法不正确的是
A. X 、Y 为曲线两交叉点。
由X 点处的pH ,可计Ka 1(H 2S)
B. Y 点对应溶液中c(Na +)与含硫各微粒浓度的大小关系为:c(Na +)=3[c(H 2S)+c(HS -)+c(S 2-)]
C. X 、Y 点对应溶液中水的电离程度大小关系为:X > Y
D. 已知NaHS 呈碱性,若向溶液中加入CuSO 4溶液至恰好完全反应,所得溶液呈强酸性。
其原因是
Cu 2++HS -=CuS↓+H +
6.(2019·山东省德州市高考联考模拟)25℃时,用0.10mol·
L 的氨水滴定10.00mL0.05mol·L -1H 2A 溶液,加入氨水的体积(V)与溶液中lg ()()
+
-
c H c OH 的关系如图所示(忽略溶液体积变化)。
下列说法不正确的是
A. A 点溶液的pH 等于1
B. 由图中数据可知,H 2A 为弱酸
C. B 点水电离出的H +离子浓度为1.0×10-6mol·L -1
D. C 点溶液中(
)()()()+
2--+
4c NH >c A
>c OH >c H
7.(2019·东北三省三校(辽宁实验中学、东北师大附中、哈师大附中)高考联考模拟)关于下列各图的叙
述,正确的是
A. 向饱和溶液中加入硫酸钠固体
B. 与发生反应过程中的能量变化,则的燃烧热为483.6kJ·mol
C. 25℃时,用0.1盐酸滴定20mL0.1氨水,溶液的pH随加入盐
酸体积的变化
D. 表示一定条件下进行的反应各成分的物质的量变化,
时刻改变的条件可能是降低温度有时间
8.(2019·福建省莆田一中、四中高考模拟)生产上用过量烧碱溶液处理某矿物(含Al2O3、MgO),过滤后得
到滤液用NaHCO3溶液处理,测得溶液pH和Al(OH)3生成的量随加入NaHCO3溶液体积变化的曲线如下:
下列有关说法不正确的是
A. 原NaHCO3溶液中c(H2CO3)+c(HCO3-)+c(CO32-)=0.8moL/L
B. a 点水的电离程度小于c 点水的电离程度
C. a 点溶液中存在:c(Na +)+c(H +)=c(AlO 2-)+(OH -)
D. 生成沉淀的离子方程式为:HCO 3-+AlO 2-+H 2O=Al(OH)3↓+CO 32-
9.(2019·山东省德州市高考联考模拟)25℃时,用0.10mol·L 的氨水滴定l0.00mL0.05mol·L -1H 2A 溶液,加入氨水的体积(V)与溶液中lg
()()
+
-
c H c OH 的关系如图所示(忽略溶液体积变化)。
下列说法不正确的是
A. A 点溶液的pH 等于1
B. 由图中数据可知,H 2A 为弱酸
C. B 点水电离出的H +离子浓度为1.0×10-6mol·L -1
D. C 点溶液中(
)()()()+
2--+
4c NH >c A >c OH >c H。
