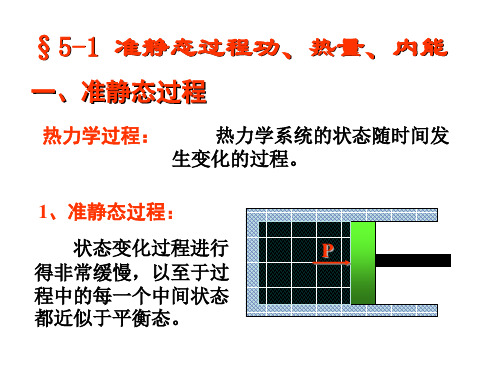
7-1内能 功和热量 准静态过程
热力学第一定律

例4.3 P.183
已知T1 =300 K, p2/p1 =10和p2 /p1 =100,则T=?
m x x=0(平衡位置)
例4.4 P.184
Q是系统所吸收的能量,W是外界对系统所
U2U1QW作的功
d U d Q d或 W d Q d U pd V
热力学第一定律12
一、定体热容与内能
定体比热容cv ,定压比热容cp
p
b
d
定体摩尔热容Cv,m, 定压摩尔热容 Cp,m
c
a
e
等体过程a—b, dV=0
T+dT
T
(ΔQ)v = ΔU
0 V
c V lT i0( m m Q T )V lT i0 (m T u)V ( T u)V
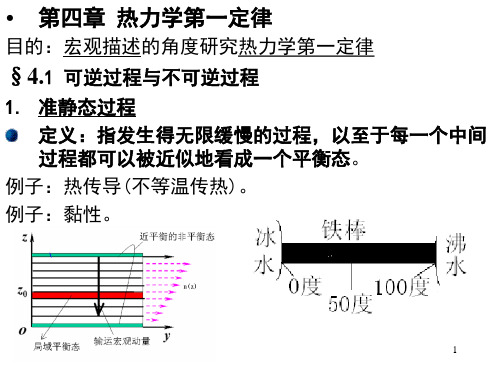
三、可逆与不可逆过程
系统从初态出发经历某一过程变到末态,若可以找到一个能使系统和外界都复原的过程(这时系统回到 初态,对外界也不产生任何影响),则原过程是可逆的。若总是找不到一个能使系统与外界同时复原的过程, 则原过程是不可逆的。
例如:气体向真空自由膨胀就是一个不可逆过 程。
判断条件
真空
•系统回到初态 •对外界也不产生任何影响
一、理想气体内能
热力学第一定律12 1、自由膨胀过程
C
A
B
焦耳实验 理想气体宏观特性:
U1 (T1 ,V 1) =U2 (T2 ,V2)=常量
证明:理想气体内能仅是状态的函数,与体积 无关,称为焦耳定律
满足pV=νRT关系;满足道尔顿分压定律; 满足阿伏加德罗定律;满足焦耳定律U=U(T)。
第18章 热力学第一定律

22
结果为正,表示气体从外界吸了热。得 气体内能增加了1.90×105J。 对于a→2的等压过程
∆E)1a =νCV ,m (Ta −T ) = Q a =1.90×105 ( J ) ( 1 1
Aa2 = ∫ pdV = p2 (V2 −V ) = −0.81×105 ( J ) 1
V2 V 1
等温过程中气体对外做功 等温过程 V2 V2 ν RT V2 dV =ν RT ln A = ∫ pdV = ∫ V V 1 1 V V 1 说明等温膨胀过程(V2>V1)时,气体对外界做正 功;等温压缩(V2<V1)时, 外界对气体做功。 12
理想气体的内能公式 i E = ν RT 2 等温过程中,由于温度T不变,∆E=0,根据热力 学第一定律可得气体从外界吸收的热量为 V2 Q = ∆E + A = A =ν RT ln V 1 此结果说明,气体膨胀时,Q>0,气体从外界 吸热;气体等温压缩时,Q<0,气体对外界放热。
负号表示气体内能减少了0.13×105J.
5 5
Q =∆E + A =−0.13×10 −0.51×10 =−0.64×10 ( J )
5
是气体向外界放了热。
26
18.4 绝热过程
如果系统在整个过程中始终不和外界交换热 则这种过程称为绝热过程。 量,则这种过程称为绝热过程。
1. 准静态绝热过程
特征: 特征:dQ=0,Q=0 , 过程方程:由 过程方程 由 pV=νRT 全微分 pdV+Vdp=νRdT (1) ) 由热一律 dQ=νCVdT+pdV=0 (2) ) 消去dT (1)(2)联立 得 消去 ) )
等温线 绝热线
p
热力学第一定律热力学第二定律

★符号法则: 系统吸热, Q为正。 系统放热, Q为负。
★ 摩尔热容量Cm:一摩尔物质温度升高1K时系 统从外界吸取的热量。
1 dQ
Cm
( dT
)
7
四、内能
★特点:状态量 (只与始末两态有关,与中间 过程无关)
★气体的内能 E m i RT
1
是内能减少。 (温度减少)
内能变化: E cV T
22
(4)绝热线与等温线的比较
等温线 斜率
PV C
K等温
dP dV
P V
绝热线 斜率
PV C1
K绝热(P0,V0,T0)斜率之比
K绝热
K等温
K绝热
K等温
P0
V0 P0
V0
P
a 等温
结论:绝热线比等温线陡峭
2
(2)按过程的特性分类:
等容过程: dV = 0 等压过程: dP = 0
等温过程: 绝热过程: 循环过程:
dT = 0 dQ = 0,Q = 0
dE = 0 E终态 = E初态
3
3.过程曲线
P
PV 图上一种点,表达一种平衡状态。
PV 图上一条线,表达一种平衡过程。
V
非平衡态,非平衡过程不能在PV 图上表达!!
V1
V2
V
Q E A 意义: 系统吸取的热量,
dQ
dE
dA
一部分对外作功,一部分 增加本身的内能。
作功: dA PdV d(PV ) d( RT ) RdT
( A)P P(V2 V1 ) R(T2 T1 )
内能增量: dE CV dT
热学课件5热力学第1定律
4、等温过程
等温过程:气体在状态变 化过程中温度保持不变。 Q
T= 恒量 ,dE =0
P
Q=A
等温过程的热力学第一定律: P
dQT dA
V1
V2 V
A V2 PdV V1
P M RT
V
A V2 M RT dV M RT ln V2 M RT ln P1
V1
V
V1
P2
等温过程系统作功和吸热:
等压过程系统内能的增量:
E
M
i 2
R(T2
T1 )
等压过程系统作功:
A
P(V2
V1 )
M
R(T2
T1 )
等压比热容公式:
Cp
CV
R
i 2
R
R
比热容比:
Cp i 2
CV i
单原子气体: i =3 双原子气体: i =5 多原子气体: i =6
1.67 1.4 1.33
例:1mol的某理想气体,在等压下由温度T1变为 T2,则其内能增量E为:
E QV
M
i R(T 2
To )
i R(T 2
To )
T
2QV inR
To
2500 273 285K 5 28.31
(2)T不变,热量变为什么?氢的P,V各为多少?
Q=W,热量转变为功
Q W M RT ln Po
P
Q ln Po
RT P
Q
500
P Poe RT 1 e 28.31273 0.90atm
M
C p dT
Qp
dQ p
T2 T1
M
CpdT
M
C p (T2
热力学第一定律

= PdV
A=
∫
V2
V1
pdV
7
A =
∫ dA = ∫
V2
V1
pdV
dV > 0, dA > 0, 系统对外作正功;
dV < 0,dA < 0, 系统对外作负功;
dV = 0,dA = 0, 系统不作功。
A = ∫ pdV
V1
V2
由积分意义可知,功的大小等于p—V 图上过程 曲线p(V)下的面积。功的数值不仅与初态和末 态有关,而且还依赖于所经历的中间状态,功 8 与过程的路径有关.
QT 热源 Q V
等容过程
热源 QP
等压过程
T 恒温大 V
6
三、功 热量 内能 dx 1功 如图示的热力学系统: P S 若过程为无摩擦的准静 态过程 活塞迎着气体一侧的面积为S气体膨胀推动活塞对 外作功:
dA =
当系统体积从 V1→ V2,系统对外界作功:
F Fdx = S Sdx
在等温过程中,理想气体吸热全部用于对外作 功,或外界对气体作功全转换为气体放出的热。 22
四、绝热过程
系统在状态变化过程中始终与外界没有热交换。
绝热膨胀过程中,系统对外作的功,是靠内能减少实 现的,故温度降低;绝热压缩过程中,外界对气体作 功全部用于增加气体内能,故温度上升。 绝热过程方程: 气体绝热自由膨胀 Q=0, A=0,△E=0
14
Q=∫
V2
V1
i pdV + νR(T2 − T1 ) 2
Q = ( E 2 − E 1) + A = ∆ E + A
热力学第一定律,是包含热量在内的能量守恒定律。
Q>0 Q<0
热学学 第四章 热力学第一定律.
植物,通过氧化把化学能转化为热和机械能。
16
亥姆霍兹 德国 物理学家(1821~1894) 《力之守恒》 化学、力学、电磁学、热学
17
• 2 内能
内能:在热学参考系下,所有分子的无规则运动的能量之和。
热学参考系:使系统宏观静止的参考系
用的能量,在过程中保持为常数,因此可以省略。
• 内能具体包含哪些能量---普遍
分子的动能(包括平动、转动、振动)
+分子内部的振动势能
+分子间的势能
18
---原子核内的能量,不能被运用,省略。 ---系统整体运动的能量,不是内能,排除。 (系统的整体平动、转动的动能) ---对于理想气体,分子间势能在任何过程中始终保持为常数, 可以省略。 • 例子:单原子分子理想气体的内能。 每个分子的动能之和。---热学坐标系。 • 例子:刚性双(多)原子分子理想气体的内能。 每个分子的平动动能之和,每个分子的转动动能之和。 • 例子:非刚性双(多)原子分子理想气体的内能。 每个分子的平动动能之和,每个分子的转动动能之和。每个分 子的振动动能之和,每个分子的振动势能之和。 • 例子:前面的例子都为非理想气体时。 都要包含分子间的势能之和。
系统和外界在非功过程交换的能量,称为热量
注意:1)热量过程量。
2)系统和外界必须有温度差,才能交换热量。
3)系统和外界交换能量的方式只有两种:功,热量。
§4.3 热力学第一定律
本质:能量转化和守恒定律在热学系统的表现。
1 历史
14
焦耳(1818-1889),英国。 热功当量
w电=I 2Rt=JQ w重力=JQ Q cmT
《热学》第四章和第五章复习
第四章 热力学第一定律 基本要求一、 可逆和不可逆过程 (1)准静态过程(2)理解什么是可逆过程,什么是不可逆过程.知道只有无耗散的准静态过程才是可逆过程。
二、 功和热量 (1)明确功是在力学相互作用过程中能量转移,热量是在热学相互作用过程中的能量的转移,它们都是过程量,它们都是过程量。
知道“作功”是通过物体宏观位移来完成;而“热传递”是通过分子之间的相互作用来完成。
(2)知道功有正负,熟练掌握从体积膨胀功微分表达式pdV W d -=出发计算体积膨胀功。
从几何上理解功的大小等于p-V 图上热力学过程曲线下面的面积。
三、热力学第一定律(1)知道能量守恒与转化定律应用到热学中就是热力学第一定律。
明确热力学第一定律是把内能、功和热量这三个具有能量量纲的物理量结合在一个方程中:即 W Q U +=∆; (2)一微小过程中热力学第一定律表示为:W d Q d dU +=;对于准静态过程热力学第一定律表示为:pdV Q d dU -=(3)内能是态函数,内能一般应是温度和体积的函数。
内能应当包含分子的热运动动能和分子之间的相互作用势能,也应包括分子内部的能量;在热学中的内能一般不包括系统做整体运动的机械能。
四、热容和焓(1)知道热容的定义、热容是过程量、热容与物体的量有关。
(2)知道焓的定义pV U H +=;知道焓的物理意义。
五、热力学第一定律对理想气体的应用(1)知道焦耳定律;即理想气体的内能仅是温度的函数;知道理想气体的焓也只是温度的函数。
内能和焓的微分可分别表示为:dT C dU m V ,ν=;dT C dH m p ,ν=;这两个公式适用于理想气体任何过程。
(2)理想气体的准静态过程的热力学第一定律可表示为pdV dT C dQ m V +=,ν;利用上式可得迈耶公式:R C C m V m p =-,,ν;(3)会熟练利用热力学第一定律处理一些常见热力学过程。
(4)会推导准静态绝热过程方程,熟记并会熟练利用绝热过程方程,同时应知道绝热过程方程的适用条件。
热力学第一定律
p
绝热线
A
pV = c1
等温线
γ
pV = c
pV =ν RT
p = nkT
0
V 1
V2
V
等温 T 不变
γ −1
体积V 增加, 减小, 体积 增加,粒子数 n 减小,所以 p 减小 温度T也减小, 温度 也减小, 所以 p 更减小 也减小
p↓
绝热 体积 增加,粒子数 n 减小,同时由绝热方程 体积V 增加, 减小,
V
V1 V V+dV V2
系统通过热传递过程与外界交换能量的量度。 系统通过热传递过程与外界交换能量的量度。 热传递过程与外界交换能量的量度 热量(与功一样) 热量(与功一样)是过程量 Q > 0 系统从外界吸收热量 Q < 0 系统向外界放出热量
8
3. 内能 .
系统内所有粒子各种能量的总和
U = U (V , T )
三、准静态过程 功 热量
1.准静态过程(平衡过程) 1.准静态过程(平衡过程) 准静态过程
F 状态参量 p, V, T p
6
平衡态可用 pV 图中的一个“点”表示。 平衡态可用 图中的一个“ 表示。 准静态过程
Ⅰ(p1V1T1) Ⅱ(p2V2T2) V
0 准静态过程进行中的每一时刻 系统都处于平衡态 每一时刻, 平衡态。 准静态过程进行中的每一时刻,系统都处于平衡态。 准静态过程只有在“无限缓慢”的条件下才能实现。 准静态过程只有在“无限缓慢”的条件下才能实现。 准静态过程可用 曲线” 表示。 准静态过程可用 pV 图中的一条 “曲线” 表示。
5
4.热力学温标(绝对温标) .热力学温标(绝对温标) 在理想气体温标有效范围内, 在理想气体温标有效范围内,理想气体温标与热力学 温标完全一致。 温标完全一致。 摄氏温标
热力学基础
可得
p1V1 p2V2 Aa CV ,m ( ) R R
Aa
( p1V1 p2V2 )
Aa
p1V1 p2V2 1
绝热过程方程的推导
dQ 0 , dA dE
p1
p
1( p1,V1,T1 )
Q0
( p2 ,V2 ,T2 ) 2
2.热力学过程
当热力学系统(大量微观粒子组成的气体、固 体、液体)在外界影响下,从一个状态到另一个状 态的变化过程,称为热力学过程,简称过程。 准静态过程 非静态过程
热力学过程
A、非静态过程
系统从一平衡态到另一平衡态,过程中所有中
间态为非平衡态的过程。 当系统宏观变化比弛豫更快时,这个过程中每一 状态都是非平衡态。 系统从平衡态1到平衡态 2,经过一个过程,平 衡态 1 必首先被破坏,系统变为非平衡态,从非平 衡态到新的平衡态,所需的时间为弛豫时间。 即:弛豫时间 是系统从一个平衡态变到相邻平衡态 所经过的时间
p
等 p ( p,V2 ,T2 ) ( p,V1,T1 ) 2 1 压 压 W 缩 o V2 V1 V
p
Qp
E2
E1
W
Qp
E1
W
E2
(3) 等温过程
T 常量 过程方程 pV 常量 dE 0
特征
p p1
1 ( p1,V1, T )
p2
( p2 ,V2 ,T )
2
热力学第一定律
o
恒 温 热 源 T
分子热运动能量
热量
热量也是能量变化的量度 热量随时间变化,也是过程量
功与热量的异同
1)过程量:与过程有关;
热力学第一定律
热 力 学第一章 热力学第一定律§1 热力学第一定律 一.准静态过程系统的状态发生变化时—系统在经历一个过程。
过程进行的任一时刻,系统的状态并非平衡态.热力学中,为能利用平衡态的性质,引入准静态过程的概念。
性质:1.准静态过程:是由无数个平衡态组成的过程即系统的每个中间态都是平衡态。
2.准静态过程是一个理想化的过程,是实际过程的近似。
实际过程仅当进行得无限缓慢时才可看作是准静态过程 。
·拉动活塞,使系统由平衡态1 →状态2,过程中系统内各处的密度(压强、温度)并不完全相同,要过一会儿时间,状态 2才能达到新的平衡。
所以,只有过程进行得无限缓慢,每个中间态才可看作是平衡态。
☆怎样判断“无限缓慢”?弛豫时间τ:系统由非平衡态到平衡态所需时间。
准静态过程条件: ∆t 过程进行 >> τ例如,实际汽缸的压缩过程可看作准静态过程, ∆t 过程进行 = 0.1秒τ = 容器线度/分子速度= 0.1米/100米/秒 = 10-3秒3.过程曲线:准静态过程可用P -V 图上 一条线表示。
状态1状态2二.功、内能、热量1.功 ·通过作功可以改变系统的状态。
·机械功(摩擦功、体积功)2.内能·内能包含系统内:(1)分子热运动的能量;(2)分子间势能和分子内的势能;(3)分子内部、原子内部运动的能量; (4)电场能、磁场能等。
·内能是状态的函数*对于一定质量的某种气体,内能一般是T 、V 或P 的函数; *对于理想气体,内能只是温度的函数 E = E (T )*对于刚性理想气体分子, i :自由度; ν :摩尔数 ·通过作功改变系统内能的实质是:分子的有规则运动能量和分子的无规则运动能量的转化和传递。
3.热量·传热也可改变系统的状态,其条件是系统和外界的温度不同。
·传热的微观本质:是分子的无规则运动能量从高温物体向低温物体传递。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
外
界
系统吸收的热量为正 若计算结果 则表示系统放热。
若改用摩尔热容 即1mol的物质温度升 高1K时所吸收的热量 则
2013年4月19日星期五
热量必须与过程相联系,只有发生 过程才有吸收或放出热量可言。
系统从某一状态变到另一状态,若其 过程不同,则吸或放的热量也会不同。 故
热量也是过程量
第5页
/phy
§7-1 内能 功和热量 准静态过程
internal energy
广义上的内能,是指某物体系统由其内部状态所决定的能量。
第七章
某给定理想气体系统的内能,是组成该气体系统的全部
分子的动能之和,其值为 E
决定,内能
,是状态参量
i M RT M 2 mol
,由状态参量
的单值函数。
真实气体的内能除了其全体分子的动能外还包括分子之间 的引力势能。实验证明人,真实气体的内能,是状态参量
2013年4月19日星期五
/phy
第7页
§7-1 内能 功和热量 准静态过程
第七章
四 准静态过程(quasi-static process)
热力学系统从一个状态变化到另一个状态 , 称为热力学过程(简称“过程”)。 过程进行的任一时刻系统的状态并非平衡态。 始平衡态 一系列非 平衡态
三 热 量(过程量)
第七章
通过传热方式传递能量的量度,系统和外界之间 存在温差而发生的能量传递 . 功与热量的异同
T1 T 2
T1 T2
Q
1)过程量:与过程有关;
2)等效性:改变系统热运动状态作用相同; 1卡 = 4.18 J , 1 J = 0.24 卡
3)功与热量的物理本质不同 . 功 宏观运动 热量 分子热运动
§7-1 内能 功和热量 准静态过程
第七章
内能 功
状态量
是构成系统的全部分子 的平均能量之和。 是系统的宏观有序机械 运动与系统内大量分子无 规热运动的相互转化过程。 是外界物质分子无规热 运动与系统内物质分子无 规热运动的相互转化过程。
的国际标准单位都是 焦耳 ( J )
/phy 第6页
和 (或
)的函数,即
或
。
总之,某给定气体系统的内能。只由该系统的状态所决定, 在热力学中内能是一个重要的状态量。
2013年4月19日星期五 /phy 第2页
§7-1 内能 功和热量 准静态过程
二 功(过程量)宏观运动能量 状态的变化 .
准静态过程功的计算
第七章 热运动能量
功是能量传递和转换的量度,它引起系统热运动
dA F dl Fdl pSdl
dA pdV
A
V2
pdV
V1
注意:作功与过程有关 .
2013年4月19日星期五 /phy 第3页
§7-1 内能 功和热量 准静态过程
t过程 > : 过程就可视为准静态过程 所以无限缓慢只是个相对的概念。
2013年4月19日星期五 /phy 第10页
第七章 §7-1 内能 功和热量 准静态过程 例如分析内燃机气缸内的气体经历的过程:
气体压强的弛豫时间:
p
L v
Hale Waihona Puke 容器的线度 分子热运动平均速率
2013年4月19日星期五 /phy
分子热运动
分子热运动
第4页
§7-1 内能 功和热量 准静态过程
heat
第七章 热量是系统与外界仅由于 温度不同而传递的能量。
系统由温度 T1 变到温度 T2 的过程中所吸收的热量
质量 比热 吸收热量 温度升高
M c dQ dT
末平衡态
热力学中,为能利用平衡态的性质,引入 准静态过程的概念。
2013年4月19日星期五 /phy 第8页
第七章 §7-1 内能 功和热量 准静态过程 准静态过程: 系统的每一状态都无限接近于
平衡态的过程。即准静态过程是由一系列平衡 态组成的过程。
准静态过程是一个理想化的过程,是实际 过程的近似。
←快 ←缓慢
非平衡态 非准静态过程
2013年4月19日星期五
接近平衡态 准静态过程
/phy 第9页
第七章 §7-1 内能 功和热量 准静态过程 平衡即不变 矛盾 统一于“无限缓慢” 过程即变化 只有过程进行得无限缓慢,每个中间态才可
看作是平衡态。 如何判断“无限缓慢”? 引入弛豫时间(relaxation time) : 平衡破坏 恢复平衡
p
( p1 ,V1) (p ,V ) (p2 ,V2) V
第七章
一个点代表一个平衡态 过程曲线
O
改变系统状态的方法:1.作功
2.传热
2013年4月19日星期五 /phy 第12页
过程量
热量
过程量
内能 功 热量
2013年4月19日星期五
§7-1 内能 功和热量 准静态过程
第七章
传递能量的两种方式 做功 传热 说明:做功与传热虽然有等效的一面,但本质上有着 区别。
区别
做功:通过物体作宏观位移完成。作用是机械运动 与系统内分子无规则运动之间的转换。从而改变内能。 传热:通过分子间相互作用完成。作用是外界分子 无规则热运动与系统内分子无规则热运动之间的转换。 从而改变了内能。
§7-1 内能 功和热量 准静态过程
第七章
学习热力学的意义
1.掌握自然界的基本规律 热力学第一定律:能量守恒 热力学第二定律:自然过程的方向 2.学习唯象的研究方法 以实验为基础的逻辑推理的研究方法 3.熵(S)的概念与“信息技术”密切相关
4.热能是重要的能源,也是维持生命的主要来源。
2013年4月19日星期五 /phy 第1页
气缸线度: L ~ 10-1 m
分子平均速率: v ~ 102 m/s
p
~ 10-3 s
内燃机活塞运动周期 t ~ 10-2 s > p(10 -3s)
所以汽缸的压缩过程可认为是准静态过程。
2013年4月19日星期五 /phy 第11页
§7-1 内能 功和热量 准静态过程 准静态过程可以用过程曲线来表示:
