常考易错的36个离子方程式书写再落实
高三化学常考易错离子方程式汇编-教学文档

常考易错离子方程式汇编一、化学式容易拆分不当1.Mg(OH)2和稀盐酸的反应:________________________________________________________________________。
2.硅酸钠溶液与醋酸溶液混合:________________________________________________________________________。
3.Al2(SO4)3溶液中加入过量氨水:________________________________________________________________________。
4.小苏打与NaOH溶液混合:________________________________________________________________________。
5.CuSO4溶液吸收H2S气体:________________________________________________________________________。
6.氯气通入水中:________________________________________________________________________。
7.Ca(HCO3)2溶液滴加稀盐酸:________________________________________________________________________。
二、各类守恒关系容易处理不当1.Na投入水中:________________________________________________________________________。
2.CuSO4溶液与Ba(OH)2溶液反应:________________________________________________________________________。
高中化学方程式书写

常考易错的12个离子方程式书写1.CuSO 4溶液与过量Ba(OH)2反应:Cu 2++SO 2-4+Ba 2++2OH -===Cu(OH)2↓+BaSO 4↓。
2.向AgCl 悬浊液中滴加Na 2S 溶液:2AgCl(s)+S 2-(aq)Ag 2S(s)+2Cl -(aq)。
3.向NaHCO 3溶液中加入过量澄清石灰水:HCO -3+Ca 2++OH -===CaCO 3↓+H 2O 。
4.向NH 4HCO 3溶液中加少量NaOH 溶液并加热:HCO -3+OH -=====△CO 2-3+H 2O 。
5.向NaAlO 2溶液中通入过量CO 2:AlO -2+CO 2+2H 2O===Al(OH)3↓+HCO -3。
6.等体积、等浓度的Ca(HCO 3)2溶液和NaOH 溶液混合: Ca 2++HCO -3+OH -===CaCO 3↓+H 2O 。
7.向明矾溶液中加入过量的Ba(OH)2溶液:Al 3++2SO 2-4+2Ba2++4OH -===AlO -2+2BaSO 4↓+2H 2O 。
8.小苏打与NaOH 溶液混合:HCO -3+OH -===CO 2-3+H 2O 。
9.等体积、等浓度的Ba(OH)2溶液与NH 4HCO 3溶液混合:Ba 2++2OH -+NH +4+HCO -3===BaCO 3↓+H 2O +NH 3·H 2O 。
10.淀粉-碘化钾溶液在空气中变蓝:4I -+O 2+2H 2O===2I 2+4OH -。
11.FeSO 4溶液中加入用H 2SO 4酸化的H 2O 2溶液:2Fe 2++2H ++H 2O 2===2Fe 3++2H 2O 。
12.在强碱溶液中NaClO 与Fe(OH)3反应生成Na 2FeO 4: 3ClO -+4OH -+2Fe(OH)3===3Cl -+5H 2O +2FeO 2-4。
钠及其重要化合物①Na 和H 2O 的反应2Na +2H 2O===2Na ++2OH -+H 2↑; ②Na 在空气中燃烧 2Na +O 2=====点燃Na 2O 2; ③Na 2O 2和H 2O 的反应2Na 2O 2+2H 2O===4Na ++4OH -+O 2↑;2Na2O2+2CO2===2Na2CO3+O2;⑤向NaOH溶液中通入过量CO2OH-+CO2===HCO-3;⑥将Na2CO3溶液与石灰乳混合CO2-3+Ca(OH)2===CaCO3↓+2OH-;⑦向Na2CO3稀溶液中通入过量CO2CO2-3+CO2+H2O===2HCO-3;⑧将NaHCO3溶液和NaOH溶液等物质的量混合HCO-3+OH-===CO2-3+H2O;⑨将NaHCO3溶液与澄清石灰水等物质的量混合HCO-3+Ca2++OH-===CaCO3↓+H2O;⑩将NaHCO3溶液与少量澄清石灰水混合2HCO-3+Ca2++2OH-===CaCO3↓+CO2-3+2H2O。
离子方程式的书写及正误判断
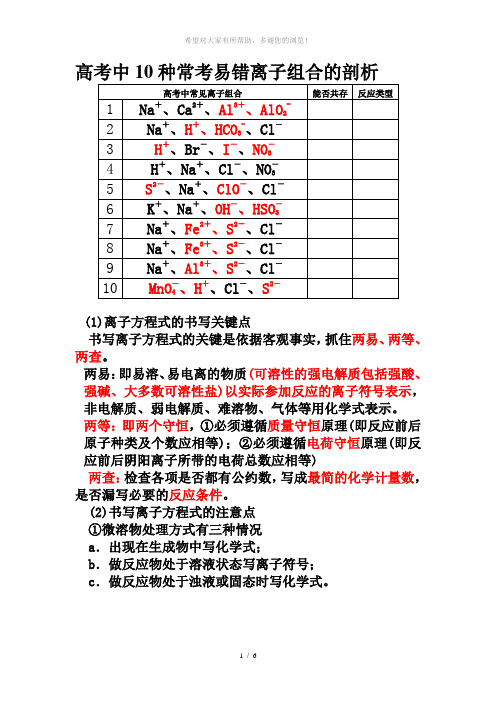
高考中10种常考易错离子组合的剖析(1)离子方程式的书写关键点书写离子方程式的关键是依据客观事实,抓住两易、两等、两查。
两易:即易溶、易电离的物质(可溶性的强电解质包括强酸、强碱、大多数可溶性盐)以实际参加反应的离子符号表示,非电解质、弱电解质、难溶物、气体等用化学式表示。
两等:即两个守恒,①必须遵循质量守恒原理(即反应前后原子种类及个数应相等);②必须遵循电荷守恒原理(即反应前后阴阳离子所带的电荷总数应相等)两查:检查各项是否都有公约数,写成最简的化学计量数,是否漏写必要的反应条件。
(2)书写离子方程式的注意点①微溶物处理方式有三种情况a.出现在生成物中写化学式;b.做反应物处于溶液状态写离子符号;c.做反应物处于浊液或固态时写化学式。
②盐类水解的离子方程式不要忘记“”。
③溶液中铵盐与碱反应加热放出NH3↑,不加热写NH 3·H2O。
④浓HCl、浓HNO3在离子方程式中写离子符号,浓H2SO4不写离子符号。
⑤HCO-3、HS-、HSO-3等弱酸的酸式酸根不能拆开写。
离子反应中的多重反应两种电解质溶液混合,至少电离出两种阴离子和两种阳离子,这四种(或更多种)之间都能两两结合成难电离(或难溶)的物质。
这样的离子反应称为多重反应。
在写这类反应的离子方程式时易丢其中的一组反应。
【例题】完成下列反应的离子方程式:(1)Ba(OH)2溶液与(NH4)2SO4溶液混合:(2)NH4HCO3与过量NaOH溶液混合:(3)Fe2O3溶于HI溶液中:(4)FeBr2溶液中通入过量Cl2:用分类思想突破跟量有关的离子方程式的书写1.连续型(1)可溶性多元弱酸(或其酸酐)与碱溶液反应。
如CO2通入NaOH溶液中:①碱过量:______________________________②碱不足:___________________________(2)多元弱酸盐与强酸反应。
如Na2CO3溶液与稀盐酸:盐酸不足:_______________________________;盐酸过量:_______________________________。
离子方程式书写易错点

是难 点 , 更是各 地高 考 的热点 , 也 是 同学们 必须 掌握 的 基 其他特殊 因素 , 如溶解 度 、 物质 的聚集状态 等。
对 同学们 学好 这部分知识能够 不 同
( 3 ) 硫酸氢铵溶液遇足量 的 a a ( O H ) : 溶液反应 。
。华雪 莹
正确地离子方 程式 的书写 , 既 是高 中化 学 的重点 . 也
本技 能 , 同学们在 书 写离 子方程 式 时 , 一定 要注 意 以下几 个方 面的问题 , 否则 就很 容 易 出错。下 面举例 说 明 , 希望
这类反应除考虑反应 中各物 质量 的关 系外 , 还要 考虑 例 5 写出下述 反应的离子方程式 ( 1 ) Mg ( HC O , ) : 溶液与过量 N a O H溶液 反应 ;
件下 对应 的离 子方 程式 。 答案 2 C 1 2 + 2 O i t 一 - 3 C 1 一+C l O一+ H2 O
C I 一+C I O3 +3 H2 O
答案 3 H 2 P O 4 -+ 3 B a +6 O H一 "
B a 3 ( P O 4 ) 2 0+
( 1 ) 石灰乳 与 N H H C O , 浓溶液混合加热 ;
( 2 ) 稀C a ( O H) 溶液与稀 N H 4 H C O , 溶液混合 。
( 2 ) 足量 B a ( H C O 3 ) 2 溶液 与 N a H S O 4溶液混合。
答案
( 1 ) 2 H’ + s 0 i 一 + B a 2 + 2 H C O 3- - B a S O 4 』
6 H 2 O+ P o : 一
常考易错离子方程式汇总98页PPT

谢谢!
98
常考易错离子方程式汇总
36、“不可能”这个字(法语是一个字 ),只 在愚人 的字典 中找得 到。--拿 破仑。 37、不要生气要争气,不要看破要突 破,不 要嫉妒 要欣赏 ,不要 托延要 积极, 不要心 动要行 动。 38、勤奋,机会,乐观是成功的三要 素。(注 意:传 统观念 认为勤 奋和机 会是成 功的要 素,但 是经过 统计学 和成功 人士的 分析得 出,乐 观是成 功的第 三要素 。
39、没有不老的誓言,没有不变的承 诺,踏 上旅途 ,义无 反顾。 40、对时间的价值没有没有深切认识 的人, 决不会 坚韧勤 勉。
▪
26、要使整个人生都过得舒适、愉快,这是不可能的,因为人类必须具备一种能应付逆境的态度。——卢梭
▪
27、只有把抱怨环境的心情,化为上进的力量,才是成功的保证。——罗曼·罗兰
▪
28、知之者不如好之者,好之者不如乐之者。——孔子
▪
29、勇猛、大胆和坚定的决心能够抵得上武器的精良。——达·芬奇
▪
30、意志是一个强壮的盲人,倚靠
化学方程式书写的常见错误

化学中方程式书写的常见错误化学离不开反应,反应离不开方程式,正确书写方程式是化学教和学的一个重要成分,尽管年年岁岁学生不同,但在书写某些方程式时错误大致相同,且是一错再错,现将经常出现的典型错误,略做归纳。
化学方程式的书写1、实验室制氯气错例:MnO2+4HCl==MnCl2+Cl2↑+2H2O分析:HCl后应标明“(浓)”,稀盐酸不能制氯气;漏反应条件“Δ”,不加热不反应。
2、氯气与铁反应错例:Fe+Cl2点燃FeCl2分析:氯气有较强的氧化性,能把铁氧化成+3价,所以应写成FeCl33、碘与铁反应错例:2Fe+3I2==2FeI3分析:碘的氧化性较弱,只能把Fe氧化成+2价,应写成FeI2。
4、氢气与氯气反应错例:H2+Cl2==2HCl分析:漏写反应条件“Δ”或“点燃”。
5、钠与盐酸反应错例:2Na+2H2O==2NaOH+H2↑分析:钠与盐酸反应常错误地认为钠先与水反应,生成的氢氧化钠再与盐酸反应。
实质上是钠与H+反应,盐酸电离出的H+比水电离出的H+多得太多,应写成2Na+2HCl==2NaCl+H2↑6、镁与水反应错例:Mg+2H2O==Mg(OH)2↓+H2↑分析:漏写“Δ”,没有该条件不会反应7、氨与水反应错例:NH3+H2O==NH4OH分析:应用“”;生成物应写NH3•H2O。
8、氮气与氧气反应错例:N2+O2==2NO分析:空气中的氮气和氧气能“和平共处”,放电时才会反应,该反应条件也易错写成“加热”、“点燃”,“光照”等。
9、铝与氢氧化钠溶液反应错例:2Al+2NaOH==2NaAlO2+H2↑分析:该方程式最易把反应物水丢掉,应为2Al+2NaOH+2H20==2NaAlO2+3H2↑。
10、铝热反应错例:2Al+Fe2O3==2Fe+Al2O32Al+3MgO==Al2O3+3Mg分析:铝热反应“不热”是不会反应的,经常漏反应条件“高温”,或错写成“加热”,“点燃”;通过铝热反应不可能制出来比铝活泼的镁。
高考化学难点汇总13《较难离子方程式的书写》(共36个)
高考化学难点汇总13 较难离子方程式的书写某些离子方程式因受规定条件的限制,也就给书写带来了一定的困难,有的甚至很难写出。
●难点突破请试做下列题目,然后自我界定学习本篇是否需要。
1.将Al 2(SO 4)3(aq)逐滴滴入Ba(OH)2(aq)中,写出可发生反应的离子方程式。
(1)__________________________________;(2)__________________________________;(3)__________________________________(可不写满,也可补充)。
●案例探究[例题]已知Br 2水与FeCl 2(aq)发生如下反应:3Br 2+6FeCl 2====4FeCl 3+2FeBr 3现将112 mL(标准状况)Cl 2通入10.0 mL 1.0 mol ·L-1的FeBr 2(aq)中,写出发生反应的离子方程式__________________。
命题意图:考查学生离子方程式的书写及比较物质还原性强弱的能力。
知识依托:①物质氧化性(或还原性)强弱的比较。
②Cl 2的氧化性。
③离子方程式的书写。
错解分析:不进行定量分析,误写出下列离子方程式:2Fe 2++4Br -+3Cl 2====2Fe 3++2Br 2+6Cl -不进行还原性比较,误写出下列离子方程式:2Br -+Cl 2====2Cl -+Br 2解题思路:通过题给反应可比较出Fe 3+与Br 2的氧化性强弱(Br 2强),从而明确Cl 2通入FeBr 2(aq)中先与Fe 2+反应,若Cl 2还有剩余再与Br -发生反应。
n (Cl 2)=1-molL 22.4L 112.0 =5.00×10-3 mol n (FeBr 2)=10.0×10-3 L ×1.0 mol ·L-1=1.0×10-2 mol这样,Fe 2+可失去1.0×10-2 mol 的电子,而Cl 2最多得1.0×10-2 mol 的电子,得失电子应守恒,故Br -不失电子。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
常考易错的36个离子方程式书写再落实
1.CuSO4溶液与过量Ba(OH)2反应:Cu2++SO2-4+Ba2++2OH-===Cu(OH)2↓+BaSO4↓
2.碳酸氢铵溶液和过量NaOH溶液反应:NH+4+HCO-3+2OH-===NH3·H2O+CO2-3+H2O。
3.向AgCl悬浊液中滴加Na2S溶液:2AgCl(s)+S2-(aq)Ag2S(s)+2Cl-(aq)。
4.向NaHCO3溶液中加入过量澄清石灰水:HCO-3+Ca2++OH-===CaCO3↓+H2O。
5.Al2(SO4)3溶液中加入过量氨水:Al3++3NH3·H2O===Al(OH)3↓+3NH+4。
6.向NH4HCO3溶液中加少量NaOH溶液并加热:HCO-3+OH-=====△CO2-3+H2O。
7.将过量SO2气体通入冷氨水中:SO2+NH3·H2O===HSO-3+NH+4。
8.硅酸钠溶液与醋酸溶液混合:SiO2-3+2CH3COOH===H2SiO3↓+2CH3COO-。
9.0.01 mol·L-1 NH4Al(SO4)2溶液与0.02 mol·L-1 Ba(OH)2溶液等体积混合:NH+4+Al3++
2SO2-4+2Ba2++4OH-===2BaSO4↓+Al(OH)3↓+NH3·H2O。
10.醋酸溶液与水垢中的CaCO3反应:2CH3COOH+CaCO3===Ca2++2CH3COO-+H2O+
CO2↑。
11.向NaAlO2溶液中通入过量CO2:AlO-2+CO2+2H2O===Al(OH)3↓+HCO-3。
12.用Na2S去除废水中的Hg2+:S2-+Hg2+===HgS↓。
13.向污水中投放明矾,生成能凝聚悬浮物的胶体:Al3++3H2OAl(OH)3(胶体)+3H+。
14.少量SO2通入苯酚钠溶液中:2C6H5O-+SO2+H2O===2C6H5OH+SO2-3。
15.等体积、等浓度的Ca(HCO3)2溶液和NaOH溶液混合:
Ca2++HCO-3+OH-===CaCO3↓+H2O。
16.用NaOH溶液除去铝表面的氧化膜:Al2O3+2OH-===2AlO-2+H2O。
17.向明矾溶液中加入过量的Ba(OH)2溶液:Al3++2SO2-4+2Ba2++4OH-===AlO-2+2H2O
+2BaSO4↓。
18.小苏打与NaOH溶液混合:HCO-3+OH-===CO2-3+H2O。
19.将Al片放入NaOH溶液中:2Al+2OH-+2H2O===2AlO-2+3H2↑。
20.CuSO4溶液吸收H2S气体:Cu2++H2S===2H++CuS↓。
21.等体积、等浓度的Ba(OH)2溶液与NH4HCO3溶液混合:
Ba2++2OH-+NH+4+HCO-3===BaCO3↓+H2O+NH3·H2O。
22.铁和过量稀硝酸反应:Fe+4H++NO-3===Fe3++NO↑+2H2O。
23.铜溶于稀硝酸:3Cu+8H++2NO-3===3Cu2++2NO↑+4H2O。
24.用浓盐酸与MnO2反应制取少量Cl2:4H++2Cl-+MnO2=====△2H2O+Cl2↑+Mn2+。
25.用稀NaOH溶液吸收NO2:2NO2+2OH-===NO-3+NO-2+H2O。
26.用惰性电极电解熔融NaCl:2Na++2Cl-=====电解2Na+Cl2↑。
27.淀粉-碘化钾溶液在空气中变蓝:4I-+O2+2H2O===2I2+4OH-。
28.漂白粉溶液在空气中失效:Ca2++2ClO-+CO2+H2O===CaCO3↓+2HClO、2HClO=====
光
2HCl+O2↑。
29.将Cl2溶于水制备HClO:Cl2+H2OH++Cl-+HClO。
30.FeSO4溶液中加入用H2SO4酸化的H2O2溶液:2Fe2++2H++H2O2===2Fe3++2H2O。
31.用稀硝酸洗涤试管内壁的银镜:3Ag+4H++NO-3===3Ag++NO↑+2H2O。
32.用KIO3氧化酸性溶液中的KI:IO-3+5I-+6H+===3I2+3H2O。
33.FeCl3溶液与Cu反应:2Fe3++Cu===2Fe2++Cu2+。
34.NO2与H2O的反应:3NO2+H2O===2H++2NO-3+NO。
35.Na2O2和H2O的反应:2Na2O2+2H2O===4Na++4OH-+O2↑。
36.在强碱溶液中NaClO与Fe(OH)3反应生成Na2FeO4:
3ClO-+4OH-+2Fe(OH)3===3Cl-+5H2O+2FeO2-4。
