4aa-4湿品批生产记录2
《原料药管理制度》

《原料药管理制度》2.内容: 2.1原料药购进管理: 2.1.1坚持“按需进货、择优选购、质量第一”的采购原则,应从具有生产、经营原料药范围的药品生产、经营企业购进。
2.1.2对首次经营的原料药,应要求供货方提供生产批准证明文件和法定的质量标准。
对首次购进的原料药,按首营品种审核制度的要求进行先审批、后购进。
2.2原料药收货管理: 2.2.1收货员应严格按公司收货管理制度、收货与验收操作规程收货。
2.2.2收货员应检查运输方式、随货同行单是否符合要求,并对照随货同行单(票)和采购记录核对药品,符合收货要求的方可收货,对不符合规定的,应予以拒收。
2.3.2验收原料药时,每批均应要求供货方提供加盖其质量管理机构原印章的药品出厂检验报告书,对无药检合格报告书的原料药,应予以拒收。
验收结束后,应当将抽取的完好样品放回原包装箱,加封并标示:“验讫”字样。
2.3.3验收进口原料药应当有加盖供货单位质量管理专用章原印章的相关证明文件:《进口药品注册证》或《医药产品注册证》;《进口药品检验报告书》或注明“已抽样”的《进口药品通关单》。
2.3.4一般情况下原料药到货后二个日内验收完毕。
2.3.5验收要做好验收记录。
记录内容应符合公司验收管理制度相关要求。
2.4.原料药储存保管管理: 2.4.1按其贮藏条件的要求(常温库:10-30℃;阴凉库不高于20℃;冷库:2-8℃;相对湿度:35%-75%),将验收合格的原料药存放于相应的库区中,原料药应专区存放,并有明显标识。
2.5.原料药养护管理: 2.5.1加强对原料药的储存养护,严格控制温湿度条件。
为缩短原料药的在库储存时间,应适当控制其库存,按需购进。
2.5.2养护员根据库房条件、外部性质、在库原料药的性质及流转情况,按公司药品养护管理制度及操作规程养护和质量检查,并按规定填写养护档案。
2.5.3养护过程中发现质量可疑的药品应当立即采取停售措施,并挂待处理标识牌;在计算机系统中锁定,同时报公司质管部确认处理。
安瓿检验操作规程

1.目的建立低硼硅玻璃安瓿的标准检验操作规程。
2.范围本规程适用于检验公司各药品品种用的低硼硅玻璃安瓿是否符合规定。
3.责任3.1.本文件由质量部QC负责起草,质量部部长审核,质量副总批准。
3.2.QC负责实施。
3.3.QA负责监督检查。
4.内容4.1.先检查供应厂家低硼硅玻璃安瓿的检验报告书,并核对批号、产品标志、标记及包装。
4.2.规格尺寸低硼硅玻璃安瓿的规格尺寸用精度为0.01mm的游标卡尺检查,应符合表2的规定。
4.3.外观质量用目检测,安瓿内外应清洁无污染,必要时辅以10倍放大镜。
4.3.1裂纹任何部位不应有裂纹。
4.3.2.气泡线不应有宽度大于0.10mm的气泡线。
4.3.3结石和节瘤——不应有直径大于0.50mm的结石——不应有直径大于1.00mm的节瘤。
4.3.4.点刻痕易折安瓿的色点应标记在刻痕上方中心,与中心线的编差不应超过±1.0mm。
5.内表面耐水性5. 1.操作方法:取本品适量,照药用玻璃容器的耐水性试验方法和分级(GB/T 12416.1-90)进行测定,应符合HC 1级的要求。
5. 2.结果判定:若符合Ⅰ级要求,则判为符合规定,否则判为不符合规定。
6.121℃颗粒法耐水性6.1.操作方法:取本品适量,照玻璃颗粒在121℃耐水性的试验方法和分级(GB/T 12416.2-90)进行测定,应符合Ⅰ级的要求。
6.2.结果判定:若符合Ⅰ级要求,则判为符合规定,否则判为不符合规定。
7.检验频次7.物料编码8.正常一次抽样判别(见表1)9.检验批量以一次进货量为一批。
10.判定标准(见表3)11.相关记录R-SOP08304-01 低硼硅玻璃安瓿检验记录R-SOP08304-02 低硼硅玻璃安瓿检验报告书R-SOP08304-03 低硼硅玻璃安瓿检验台账低硼硅玻璃安瓿检验记录(一)检验编号:1. 外型尺寸、外观质量检验:检验仪器:灭菌锅 (型号: 编号: ) 温度: ℃ 相对湿度: % 滴定管编号: 试药与试液取安瓿50支,洗净灌入注射用水至时限,121℃消毒1小时,放冷,合并浸取液,吸取25ml ,放在洁净干燥的三角烧瓶中加入2滴甲基红指示液,用0.01mol/L 盐酸溶液进行滴定,滴至产生的颜色与空白实验完全一致。
冻干制剂批生产记录(共26页)

批生产记录
批生产记录
批生产记录
生产记录
批生产记录
批生产记录
A:操作工签名(qiān míng) B:中控签名
批生产记录
批生产记录
批生产记录
批生产记录
批生产记录
批生产记录
批生产记录
批生产记录
批生产记录
批生产记录
批生产记录
批生产记录
批生产记录
批生产记录
批生产记录
包装材料中间流通(liútōng)记录
冻干机运行记录
备注(bèizhù):巡检仪A中1、2、4、5、6为制品温度,3为冷阱温度。
巡检仪B中1、2、3、4、5为制品温度,6为冷阱温度。
每1小时记录一次。
内容摘要
(1)每1小时记录一次。
猪生产学

名词解释泌乳力:21日龄时,全窝仔猪的总重量,衡量母猪泌乳能力的一个重要指标。
泌乳量:泌乳母猪在一个泌乳期内的泌乳量饲料转化率:也称耗料增重比或增重耗料比常用性能测定期间每单位增重所需的饲料来表示胴体重:屠宰后去头、蹄、尾及内脏,保留板油和肾脏的躯体重量为胴体重。
胴体长:在胴体倒挂时从耻骨联合前缘至第一肋骨与胸骨交界处的长度,称为胴体长或胴体斜长背膘厚:宰后胴体背中线肩部最厚处、胸腰椎结合处和腰荐椎结合处三点膘厚的平均值为平均背膘厚。
活体背膘厚:体重达100kg时,猪倒数第三至第四肋骨间4-6cm背膘厚度。
眼肌面积:胴体胸腰椎结合处背最长肌横截面的面积PSE肉:宰后45min和24h眼肌的PH分别低于和的肉,猪宰后呈现苍白颜色、质地松软和汁液渗出的征状DFD肉:宰后24h半膜肌的PH高于的肉,宰后肌肉外观呈暗红色、质地坚硬、肌肉表面干燥。
MAS(标记辅助选择):指通过分子标记技术,对生物有机体基因组进行标记,利用标记基因型准确地估计数量性状的育种值,并以该育种值进行选育日增重:=(结束重-开始重)/育肥天数SEW:隔离式早期断奶法。
母猪在分娩前按常规程序进行有关疾病的免疫注射,仔猪出生后保证吃到初乳,按常规免疫程序进行疫苗预防接种后,在10~21d断奶,然后把仔猪在隔离条件下保育饲养。
生产节律:相邻两群泌乳母猪转群的时间间隔全进全出制:同一批猪群同时转入、同时转出,按节律转群进行生产,全年不分季节均衡生产。
后效行为:指猪后天获得的行为,是猪出生后对新鲜事物的熟悉而建立起来的测定站测定:指把各核心群的被测种猪集中到中心站测定,在相对一致的环境条件下,按统一的的测定规程进行测定,测定后,统一公布测定结果,并进行平等分级和良种登记。
猪应激综合征:猪在应激条件下产生的恶性高热猝死以及肉质变劣等的综合症候群发情周期:从上次发情开始到下次发情开始的这段时间,约为21天。
大致分为发情前期、发情期、发情后、休情期。
日本化妆品生产日期怎么看

日本化妆品生产日期怎么看日本化妆品的生产日期日本的化妆品生产商是不会再批号上打上生产日期的,因为日本市场的回收机制很完善,不存在过期销售产品,护肤用品2年内不能卖出,则全部清架。
日本对于假货和一些化妆品,食品的打击力度很大的,市面上买不到假货,如果生产假货被发现,基本等于破产,所以日本的企业很注重东西的保质期,购买者完全不用担心化妆品会过期这种情况的发生。
【疑问2】由于没有生产日期。
要怎么计算是否过了3年不标生产日期其实是日本化妆品界的一条潜规则,没标生产日期的意思是“只要没开封,就算过了3年期限也能继续使用”【疑问3】较真的小伙伴,非要知道生产日期怎么办那你得是个懂日语的强迫症了。
找到产品(包装)上印着的那串数字和字母,打品牌的咨询电话,大部分日本品牌会告诉你这件商品的生产日期。
那么日本化妆品真的不需要标注生产日期当然答案是——NO!,只是你看不懂它!日本彩妆品牌没有统一公式对应商品的批号,品牌同一系列多个款式的,标识方法也不同,这里举出三个品牌给你参考。
查询答案仅供参考,不作为标准答案哦!头两位数字代表生产日期:11=11日第一个字母代表生产年份:H=2023 I=2023 J=2023 K=2023 L=2023 M=2023N=2023 O=2023 P=2023 Q=2023 R=2023 S=2023 T=2023 U=2023 V=2023第三个字母代表生产月份:A=1月 B=2月 C=3月 D=4月 E=5月 F=6月 G=7月H=8月 I=9月 J=10月 K=11月 L=12月图上照片生产批号:11VLCM,换算后生产日期是2023年12月11日,而日本的化妆品保质期一般为3年,所以不开封2023年12月11号到期。
开封的话三个月内。
HABA查生产日期:生产批号:21VECE生产日期是:2023年5月21日生产批号:01PMLW生产日期:2023年1月1日生产批号:05SQLR生产日期:2023年5月5日生产批号:19UJCJ生产日期:2023年10月19日生产批号:19UHJH生产日期:2023年8月19日以上仅适合HABA家的产品查询。
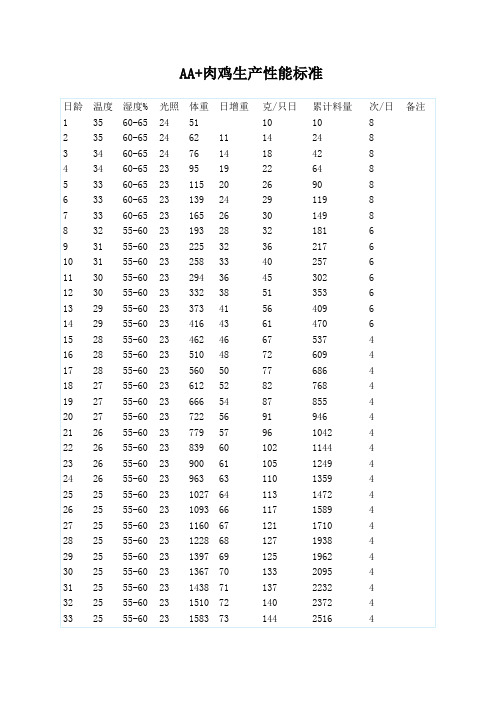
AA+肉鸡生产性能标准
4
21
26
55-60
23
779
57
96
1042
4
22
26
55-60
23
839
60
102
1144
4
23
26
55-60
23
900
61
105
1249
4
24
26
55-60
23
963
63
110
1359
4
25
25
55-60
23
1027
64
113
1472
4
26
25
55-60
23
1093
66
117
1589
4
27
6
14
29
55-60
23
416
43
61
470
6
15
28
55-60
23
462
46
67
537
4
16
28
55-60
23
510
48
72
609
4
17
28
55-60
23
560
50
77
686
4
18
27
55-60
23
612
52
82
768
4
19
27
55-60
23
666
54
87
855
4
20
27
55-60
23
722
56
91
A.A.肉仔鸡的生产性能
单唾液酸四己糖神经节苷脂钠
单唾液酸四己糖神经节苷脂钠注射液批生产审核单无菌准备岗位容器具处理及灭菌操作记录单唾液酸四己糖神经节苷脂钠注射液胶塞处理岗位生产指令单唾液酸四己糖神经节苷脂钠注射液胶塞处理岗位操作记录格式号:YL·Z02-02-038-03岗位负责人:工艺员:单唾液酸四己糖神经节苷脂钠注射液洗瓶岗位生产指令格式号:YL·G02-07-006-03-DT-02针剂洗瓶岗位操作记录岗位负责人:工艺员:单唾液酸四己糖神经节苷脂钠注射液灭菌烘干机监控记录岗位负责人:工艺员:针剂车间洗瓶岗位清洁记录单唾液酸四己糖神经节苷脂钠注射液配液岗位生产指令单唾液酸四己糖神经节苷脂钠注射液配液除菌岗位操作记录格式号:YL·Z02-02-035-04单唾液酸四己糖神经节苷脂钠注射液称量岗位操作记录格式号:YL·Z02-02-027-01针剂车间配液岗位清洁记录单唾液酸四己糖神经节苷脂钠注射液灌装、加塞、压盖岗位生产指令单唾液酸四己糖神经节苷脂钠注射液灌装、加塞岗位操作记录岗位负责人:工艺员:单唾液酸四己糖神经节苷脂钠注射液装量检查记录针剂车间灌封、加塞岗位清洁记录单唾液酸四己糖神经节苷脂钠注射液压盖岗位操作记录针剂车间轧盖岗位清洁记录单唾液酸四己糖神经节苷脂钠注射液灭菌岗位操作记录格式号:YL·Z02-02-043-02针剂车间中转岗位操作记录(三)格式号:YL·G02-02-043-010.9%氯化钠注射液灯检岗位生产指令针剂车间灯检岗位清洁记录单唾液酸四己糖神经节苷脂钠注射液包装岗位生产指令单唾液酸四己糖神经节苷脂钠注射液批包装记录单唾液酸四己糖神经节苷脂钠注射液贴签打码记录格式号:YL·Z02-02-098-02单唾液酸四己糖神经节苷脂钠注射液小盒印字记录岗位负责人:工艺员:0.9%NaCL注射液灌装、加塞、压盖岗位生产指令0.9%NaCL注射液灌装、加塞岗位操作记录岗位负责人:工艺员:0.9%NaCL注射液压盖岗位操作记录。
牡蛎生产工艺规程
1.目的:建立牡蛎饮片生产工艺规程,使其生产操作规范化、标准化,符合本公司生产实际和GMP 的管理要求,保证生产出的产品质量均一、稳定。
2.依据:《中国药典》2015年版一部;3.范围:本工艺规程适用于牡蛎饮片生产的全过程,是各部门共同遵循的技术准则。
4.责任:生产车间按该工艺规程组织生产和按该规程编制标准操作程序,生产技术部、质量管理部负责监督该规程的实施。
5. 产品概述:5.1产品名称:牡蛎5.2 汉语拼音:Muli5.3 拉丁语:OSTREAE CONCHA5.4 来源:本品为牡蛎科动物长牡蛎Ostrea gigas Thunberg、大连湾牡蛎Ostrea talienwhanensis Crosse 或近江牡蛎 Ostrea rivularis Gould的贝壳。
全年均可捕捞,去肉,洗净,晒干。
5.5 性状:本品为不规则的碎块。
白色。
质硬,断面层状。
气微,味微咸。
5.6 功能与主治:重镇安神,潜阳补阴,软坚散结。
用于惊悸失眠,眩晕耳鸣,瘰疬痰核,癥瘕痞块。
5.7 用法与用量:9~30g,先煎。
5.8 贮藏:置干燥处。
5.9 法定制法:取原药材,洗净,干燥,加工成小碎块。
5.10 包装规格:1.0kg/袋、30g/袋。
5.11 复验期:三年。
5.12产品代码:1.0kg/袋090182、30g/袋0903825.13产地:山东6、生产工艺流程图:工艺流程线★---关键工艺控制点主要质量控制点7、操作过程及工艺条件7.1 批量及投料量:按实际生产确定批量和投料量7.2操作过程及工艺条件7.2.1炮制过程7.2.1.1领料:由净选工序的操作员按批生产指令领取规定的数量,填写领料单,核对原料物料编码,确保使用的牡蛎原料为一批。
7.2.1.2净选:按照《挑选工序标准操作规程》(SOP-SCGW-004)进行操作。
将牡蛎原药材置操作间内拣选台上,去净杂质等不符合要求的部分。
置周转箱内,转入下一道工序。
药品稳定性考察报告
药品稳定性考察报告药品稳定性考察报告篇一:药品稳定性考察方案药品稳定性考察方案1.考察目的药品的稳定性是指原料药及其制剂保持其物理、化学、生物学和微生物学性质的能力。
考察药物制剂在温度、湿度、光线的影响下随时间变化的规律,为药品的生产、包装、贮存、运输条件提供科学依据,同时通过试验建立药品的有效期。
2.考察范围适用于公司所有成品及原液的考察。
药品稳定性考察包括:加速试验和长期(持续)稳定性试验。
长期(持续)稳定性考察主要针对市售包装产品,但也需兼顾待包装产品。
例如,当待包装产品在完成包装前,还需要长期贮存时,应当在相应环境条件下,评估其对包装后产品稳定性的影响。
此外,还应考虑到对贮存时间较长的中间产品进行考察。
加速试验主要针对批量放大及上市后变更(如生产设备变更、原辅料变更、工艺调整等)时生产的产品的稳定性试验。
3.考察依据依据《中国药典》2010版二部附录中《原料药与药物制剂稳定性试验指导原则》进行确认。
4.职责质保部部长负责稳定性考察方案与报告的起草。
质控部人员按照该方案完成实验并报告检验结果。
质保部部长负责检验结果的汇总。
质保部部长负责稳定性考察方案、检验结果、报告的审核。
质量授权人负责稳定性考察方案及报告的批准。
5.产品介绍(将做稳定性考察产品的介绍填在附表)内容:产品名称、代码、考察方法、批号、规格、包装规格、考察数量、生产数量、有效期至 6.考察方法 6.1加速试验此项实验在加速条件下进行,目的是通过加速药物制剂的化学或物理变化,探讨药物制剂的稳定性,为药品审评、包装、运输及贮存提供必要的资料。
6.1.1供试品要求3批,按市售包装,在温度40℃±2℃、相对湿度75%±5%的条件下放置6个月。
所用设备应能控制温度±2℃,相对湿度±5%,并能对真实温度与湿度进行监测。
在试验期间第1个月、2个月、3个月、6个月末取样一次,按稳定性重点考察项目检测(转载于: 厦门培训考试网:药品稳定性考察报告)。
无菌检查记录(薄膜过滤法)
品名:生产单位:批号:亚批号:规格:剂型:1.检验依据:《中华人民共和国药典》2015年版三部□本企业注册标准□其它:□2.检验方法:薄膜过滤法3.操作规程:SOP-04-13-4501《无菌检查SOP》4.判定标准:4.1 试验成立条件:阳性对照应生长良好,阴性对照不得有菌生长。
否则,试验无效。
4.2 供试品应澄清,或虽显浑浊但经确证无菌生长,判供试品符合规定;若供试品中任何一管显浑浊并确证有菌生长,判供试品不符合规定。
5.检验操作5.1供试品无菌检查5.1.1 材料及设施仪器5.1.1.1培养基及稀释液5.1.1.2设施品名:批号:5.1.1.3仪器5.1.1.4耗材5.1.2实验步骤5.1.2.1试验前环境检查5.1.2.1.1洁净室试验条件:温度18℃~26℃,湿度45%~65%,压差≥10Pa 是□否□5.1.2.1.2操作间工作台面是否有与本次操作无关的物品是□否□确认人:确认日期:5.1.2.2操作步骤品名:批号:5.1.2.3试验后清场5.1.2.4环境监测结果5.1.2.5 培养及观察:“-”表示无菌生长,“+”表示有菌生长无菌检查记录(薄膜过滤法)品名:批号:5.1.2.6结果:品名:批号:5.2阳性菌试验5.2.1 材料及设施仪器5.2.1.1 菌株5.2.1.2设施5.2.1.3 仪器5.2.2实验步骤5.2.2.1试验前环境检查5.2.2.1.1洁净室试验条件:温度18℃~26℃,湿度45%~65%,压差≥10Pa是□否□5.2.2.1.2 操作间内工作台面是否清除与本次操作无关的物品是□否□确认人:确认日期:品名:批号:5.2.2.2 操作步骤操作间:微生物限度区阳性菌室操作间编号:27145.2.2.3试验后清场品名:批号:5.2.2.4培养及观察:“-”表示无菌生长,“+”表示阳性菌生长。
5.2.2.5 结果:6.结论:结果符合规定□结果不符合规定□检验人:检验日期:复核人:复核日期:。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第 1 页 共 5 页
4湿品制备工序批生产记录
生产批号: 生产日期:
本批次经车间主任批准后得以进行生产。
车间主任签字: 日 期:
本版本为第一版,已经QA经理批准。
QA经理: 批准执行日期:
公司
第 2 页 共 5 页
代号 物料名称 批号 检测依据 数量(kg) 实际投料量(kg) 操作者 复核者
10411 保护物 CT·10411 350~390
10071 盐酸 CT·10071 190
20331 901-3甲苯溶液 CT·20331 220
10121 碳酸氢钠
CT·10121
45±5
10391 氯化钠 CT·10391 250
10531H1 回收甲苯 CT·10531H1 1200
10421 PE60
CT·10421
约30
产量: kg 操 作 者/日期:
车间审核/日期:
QA 审核/日期:
最终处理(结果打“√”): □ 合格; □ 不合格; □ 其它。
备注:
第 3 页 共 5 页
生产前现场检查确认表
检查项目 检查结果 备注
⑴核对准备投料的原辅料品名、数量是否符合要求 □是 □否
⑵检查设备是否完好,设备是否已清洁,是否在清洁的有效期内 □是 □否
⑶检查在用的计量器具是否完好,并在校准期内 □是 □否
⑷操作区域内与本批生产无关的物料与器具是否已清理 □是 □否
⑸是否在生产设备上挂上相应的生产批号牌和设备状态牌 □是 □否
⑹检查反应锅内料液是否已经放完,反应锅底阀是否已经关闭 □是 □否
检查者/日期:
复核者/日期:
第 4 页 共 5 页
操作指令 时间 温度 (℃) 真空度(MPa) 操作者 复核者
1.1在2000L干燥洁净的低温反应锅( ) 充氮
气保护(流速0.4~0.6m3/h) 后,抽入901-3甲苯溶液
220kg、回收甲苯900kg。
实用901-3甲苯溶液 kg,回收甲苯 kg。
/
1.2开搅拌,用氮气置换反应锅里的空气,通氮气下冷
却。
/
1.3冷却至-25℃,开始滴加已准备好的保护物甲苯溶
液,控制温度于-25~ -15℃,薄层控制反应终点。
实际滴加保护物甲苯溶液 kg。
/
/
/
2.1用氮气置换反应锅里的空气三次。
2.2通氮气(流速0.6~0.6m3/h)保护后,再将反应结束的
料液滴加至装有190kg工业盐酸和1000kg冰饮用水的
5000L搪玻璃洗涤锅( )中,滴加过程中保持
pH一直呈酸性。
实际用工业盐酸_______kg;实际用饮用水_______kg
/
2.3滴毕,搅拌20分钟。
/
2.4用碳酸氢钠调pH到7.0~7.5(约需40~50kg)。
实际用碳酸氢钠_______kg,实测pH= 。
/
2.5静止分层,水层分至另一萃取锅( )中。
/
2.6在水层中加入约250kg回收甲苯萃取搅拌20分钟。
实际用回收甲苯_______kg。
/
2.7静止分层,水层弃去,合并有机层至洗涤锅。
/
3.1有机层再用850kg饱和食
盐水洗涤一次,洗毕弃水层。
搅拌20~30分钟 /
静置20~30分钟 /
4.1将有机层转至脱水锅( )中,静置,弃水
层,有机层泵至四楼储罐( )。
/
5.1控制蒸馏锅水浴温度于35~45℃,真空度≤-0.098
MPa,蒸馏至基本无液滴流出后,结束蒸馏。
蒸馏过程每两小时记录一次参数。
开始时间: 结束时间:
共计时间: 小时 分
5.2蒸馏毕,加入85kg回收甲苯-PE60混合液,搅拌
均匀。 实际用回收甲苯 kg;PE60 kg。
/
5.3放至专用塑料圆桶,送冷冻房冷冻24小时以上。
/
第 5 页 共 5 页
操作指令 时间 温度 (℃) 真空度(MPa) 操作者 复核者
开始时间:_______ 结束时间:_______
共计______小时_______分钟
/
5.4冷冻毕离心,甩干得901湿品。
6.0偏差报告:
标题:
偏差情况:
结 论:
报告者: 复核者: 日期:
