独一味质量标准及检验操作规程
川楝子质量标准及检验操作规程
XXXXXXXXXXX有限公司原料质量标准及检验操作规程1 品名:1.1 中文名:川楝子1.2 汉语拼音:Chuanlianzi2 代码:3 取样文件编号:4 检验方法文件编号:5 依据:《中国药典》(2020年版一部)。
6 质量标准:7 检验操作规程:7.1 试药与试剂:甲醇、水、二氯甲烷、川楝子对照药材、川楝素对照品、二甲胺基本甲醛、乙腈、甲酸。
7.2 仪器与用具:显微镜、离心机、电子天平、水浴锅、超声波处理器、硅胶G薄层板、烘箱、马福炉、回流装置、高效液相色谱-质谱联用仪。
7.3 性状:取本品适量,自然光下目测色泽,嗅闻气味。
7.4 鉴别:7.4.1取本品横切面制片显微镜(10×10)观察组织结构特征。
7.4.2取本品粉末2g,加水80ml,超声处理1小时,放冷,离心,取上清液,用二氯甲烷振摇提取3次,每次25 ml,合并二氯甲烷液,蒸干,残渣加甲醇2 ml使溶解,作为供试品溶液。
另取川楝子对照药材2g,同法制成对照药材溶液。
再取川楝素对照品,加甲醇制成每1 ml含1mg的溶液,作为对照品溶液。
照薄层色谱法(附录7)试验,吸取上述三种溶液各10μl,分别点于同一硅胶G薄层板上,以二氯甲烷-甲醇(16:1)为展开剂,展开,取出,晾干,喷以对二甲胺基苯甲醛试液,在105℃加热至斑点显色清晰。
供试品色谱中,在与对照药材色谱和对照品色谱相应的位置上,显相同颜色的斑点。
7.5检查:7.5.1水分:不得过12.0%(附录15第二法)测定。
7.5.2总灰分:不得过5.0%(附录17)。
7.5.3二氧化硫残留量:照二氧化硫残留量测定法(附录58)测定,不得过150mg/kg。
7.6浸出物:照水溶性浸出物测定法(附录19)项下的热浸法测定,不得少于32.0%。
7.7 含量测定:照高效液相色谱-质谱法(附录8和二部附录51)测定。
色谱、质谱条件与系统适用性试验以十八烷基硅烷键合硅胶为填充剂;以乙腈-0.01%甲酸溶液(31:69)为流动相;采用单级四级杆质谱检测器,电喷雾离子化(ESI)正离子模式下选择质荷比(m/z)离子进行检测。
苦杏仁质量标准及检验操作规程

XXXX药业有限公司原料质量标准及检验操作规程1 品名:1.1 中文名:苦杏仁1.2 汉语拼音:Kuxingren2 代码:3 取样文件编号:4 检验方法文件编号:5 依据:《中国药典》(2015年版第一增补本)。
6 质量标准:7 检验操作规程:7.1 试药与试剂:二氯甲烷、水、甲醇、苦杏仁苷对照品、三氯甲烷、乙酸乙酯、磷钼酸、硫酸、乙腈。
7.2 仪器与用具:索氏提取器、水浴锅、三用紫外分析仪、恒温鼓风干燥箱、硅胶G薄层板、高效液相色谱仪。
7.3 性状:取本品适量,自然光下目测色泽,嗅闻气味。
7.4 鉴别:7.4.1取本品粉末2g,置索氏提取器中,加二氯甲烷适量,加热回流2小时,弃去二氯甲烷液,药渣挥干,加甲醇30ml,加热回流30分钟,放冷,滤过,滤液作为供试品溶液。
另取苦杏仁苷对照品,加甲醇制成每1ml含2mg 的溶液,作为对照品溶液。
照薄层色谱法(附录7)试验,吸取上述两种溶液各3μl,分别点于同一硅胶G薄层板上,以三氯甲烷-乙酸乙酯-甲醇-水(15 : 40 : 22 : 10)5~10℃放置12小时的下层溶液为展开剂,展开,取出,立即用0.8%磷钼酸的15%硫酸乙醇溶液浸板,在105℃加热至斑点显色清晰。
供试品色谱中,在与对照品色谱相应的位置上,显相同颜色的斑点。
7.5 检查:过氧化值不得过0.11(附录27)。
7.5.1二氧化硫残留量照二氧化硫残留量测定法(附录58)测定,不得过150mg/kg。
7.6 含量测定:照高效液相色谱法(附录8)测定。
色谱条件与系统适应性试验以十八烷基硅烷键合硅胶为填充剂;以乙腈-0.1%磷酸溶液(8 : 92)为流动相;检测波长为207nm。
理论板数按苦杏仁苷峰计算应不低于7000。
对照品溶液的制备取苦杏仁苷对照品适量,精密称定,加甲醇制成每1ml含40μg的溶液,即得。
供试品溶液的制备取本品粉末(过二号筛)约0.25g,精密称定,置具塞锥形瓶中,精密加入甲醇25ml,密塞,称定重量,超声处理(功率250W,频率50kHz)30分钟,放冷,再称定重量,用甲醇补足减失的重量,摇匀,滤过,精密量取续滤液5ml,置50ml量瓶中,加50%甲醇稀释至刻度,摇匀,滤过,取续滤液,即得。
中药材、中药饮片验收操作规程

中药材、中药饮片验收操作规程一、目的:阐述中药材饮片验收的操作程序,保证入库药材数量准确、质量完好、防止假冒、伪劣药材饮片入库。
二、适用范围:适用于中药材饮片验收操作全过程。
三、依据:《药品生产质量管理规范》(2010年版)。
四、责任者:仓储部保管员、中药验收专员。
五、内容:1、准备工作1.1检查到货中药饮片的送货凭单,供货单位必须是经质量部审计批准的中药材供应(商)单位。
1.2清洁收货平台、货位。
1.3仓库内待验货位应按清洁规程清理干净。
1.4检查、校正计量器具须符合规定,计量合格证应在有效期内。
2、验收依据验收依据三级标准:2.1一级标准(法定标准):《中国药典》(2010年版一部)、《部颁标准》、以及《省中药饮片炮制规范》等国家法规标准;2.2二级标准:公司内部质量标准:原药材、饮片质量标准;2.3三级标准:进货合同,入库凭证上所要求的各项质量规定。
3、验收条件3.1场所:分别在公司仓库及质检中心进行验收、检验。
3.2设备:水分测定仪、天平、白瓷盘、药匙、漏斗、刀子、剪刀、放大镜、紫外分析仪、研钵、以及必备的一些化学试剂、仪器设备。
4、中药材、中药饮片验收程序4.1中药材饮片初验:物料来货后,仓库保管员按来货通知单或来货清单初步验收:①检查装运中药材饮片的运输车是否为密封车或用苫布覆盖。
②检查进货中药材外包装的完整性,每件外包装有无受潮、水渍、虫蛀、霉变、以及有无破损及污染情况。
③检查进货不同品种的药材包装上有无明显的区别标记,标记上是否注明品名、质量、来源(产地)、装量、采收加工日期、发货单位。
④所进的中药饮片是否标明品名、生产企业、生产日期等。
实施批准文号管理的中药材、中药饮片,在包装上还应标明批准文号。
⑤以上初验准确无误后,方可寄库。
保管员对货单有不符,质量异常,标志不清等物料有权拒收。
4.2中药材饮片数量验收:①检查货物与原始凭证的货源单位,货物品名、数量是否相符,不符合的要查的原因。
何首乌、制何首乌质量标准及检验操作规程

XXXX药业有限公司成品质量标准及检验操作规程1 品名:1.1 中文名:何首乌制何首乌1.2 汉语拼音:Heshouwu Zhiheshouwu2 代码:何首乌制何首乌3 取样文件编号:4 检验方法文件编号:5 依据:《中国药典》(2015年版一部)。
6 质量标准:7检验操作规程:7.1试药与试剂:乙醇、何首乌对照药材、羧甲基纤维素钠、三氯甲烷、甲醇、水、乙腈、磷酸、盐酸、大黄素对照品、大黄素甲醚对照品、2,3,5,4′-四羟基二苯乙烯-2-O-β-D-葡萄糖苷对照品、盐酸、氢氧化钠滴定液、甲基红乙醇溶液指示剂。
7.2仪器与用具:显微镜、电子天平、超声波清洗器、水浴锅、回流装置、硅胶H薄层板、紫外光灯、烘箱、马弗炉、分液漏斗、高效液相色谱仪、二氧化硫测定仪。
7.3性状:取本品适量,自然光下目测色泽,嗅闻气味。
7.4鉴别:取本品粉末0.25g,加乙醇50ml,加热回流1小时,滤过,滤液浓缩至3ml,作为供试品溶液。
另取何首乌对照药材0.25g,同法制成对照药材溶液。
照薄层色谱法(附录7)试验,吸取上述两种溶液各2μl,分别点于同一以羧甲基纤维素钠为黏合剂的硅胶H薄层板上使成条状,以三氯甲烷-甲醇(7:3)为展开剂,展至约3.5cm,取出,晾干,再以三氯甲烷-甲醇(20:1)为展开剂,展至约7cm,取出,晾干,置紫外光灯(365nm)下检视。
供试品色谱中,在与对照药材色谱相应的位置上,显相同颜色的荧光斑点。
7.5检查:7.5.1何首乌水分:不得过10.0%(附录15第二法)。
总灰分:不得过5.0%(附录17)。
7.5.2制何首乌水分:不得过12.0%(附录15第二法)。
总灰分:不得过9.0%(附录17)。
7.5.3二氧化硫残留量照二氧化硫残留量测定法(附录58)测定,不得过150mg/kg。
7.6含量测定:7.6.1何首乌二苯乙烯苷避光操作。
照高效液相色谱法(附录8)测定。
色谱条件与系统适用性试验以十八烷基硅烷键合硅胶为填充剂;以乙腈-水(25:75)为流动相;检测波长为320nm。
薄荷检验标准操作规程

原药材检验标准操作规程目的:建立一个中药饮片原药材检验标准操作程序,确保检验结果准确可靠。
适用范围:中药原药材。
责任人:质量保证部主任、质量控制部主任、化验员。
标准来源:《中华人民共和国药典》2010年版一部、《安徽省中药饮片炮制规范》。
内容:1、性状取本品适量,放入白瓷盘中,用眼观察,可见以下性状特征:本品茎呈方柱形,有对生分枝,长15~40cm,直径0.2~0.4cm;表面紫棕色或淡绿色,棱角处具茸毛,节间长2~5cm;质脆,断面白色,髓部中空。
叶对生,有短柄;叶片皱缩卷曲,完整者展平后呈宽披针形、长椭圆形或卵形,长2~7cm,宽1~3cm;上表面深绿色,下表面灰绿色,稀被茸毛,有凹点状腺鳞。
轮伞花序腋生,花萼钟状,先端5齿裂,花冠淡紫色。
揉搓后有特殊清凉香气,味辛凉。
2、鉴别主要使用仪器:电子分析天平、电子显微镜等。
2.1显微鉴别:2.1.1 试液配制2.1.1.1 水合氯醛试液:取水合氯醛50克,加水15毫升与甘油10毫升使溶解,即得。
2.1.1.2 甘油醋酸试液:取甘油、醋酸及水各等份混匀,即得。
2.1.1.3 稀甘油:取甘油33毫升,加水稀释至100毫升,再加樟脑一小块或液化苯酚1滴,即得。
2.1.2 供试品制备2.1.2.1 取本品10g,研细后取少量粉末,置载玻片上,滴加水合氯醛搅拌均匀,置酒精灯上加热透化;加稀甘油数滴,搅拌均匀,分装2~3片,加盖玻片,即得。
2.1.2.2 取研细的粉末少量置载玻片上,加甘油醋酸试液,搅拌均匀,加盖玻片,即得。
2.1.2.3取研细后取少量粉末,置载玻片上,滴加水搅拌均匀,同时滴加少许稀甘油,加盖玻片,即得。
2.1.3 置显微镜下观察可见本品叶的表面观:腺鳞头部8细胞,直径约至90μm,柄单细胞;小腺毛头部及柄部均为单细胞。
非腺毛1~8细胞,常弯曲,壁厚,微具疣突,下表皮气孔多见。
直轴式。
2.2理化鉴别取本品叶的粉末少量,经微量升华得油状物,加硫酸2滴及香草醛结晶少量,初显黄色至橙黄色,再加水1滴,即变紫红色。
8076-2三叉苦检验标准操作规程
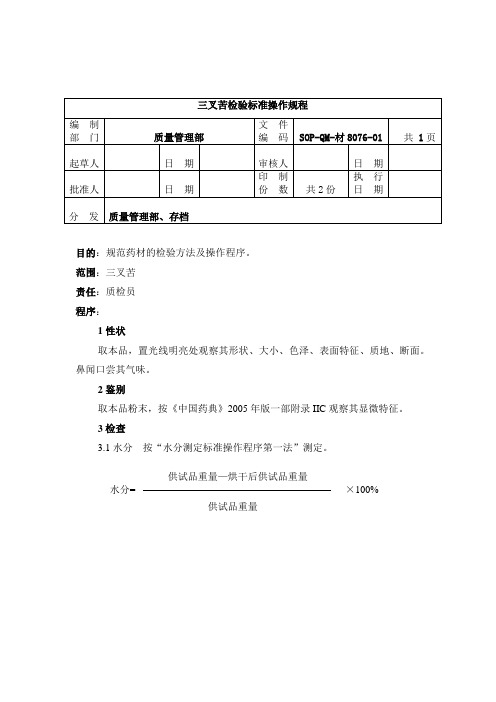
3.1水分按“水分测定标准操作程序第一法”测定。
供试品重量—烘干后供试品重量
水分=×100%
供试品重量
三叉苦检验标准操作规程
编制
部门
质量管理部
文件
编码
共1页
起草人
日期
审核人
日期
批准人
日期
印制
份数
共2份
执行
日期
分发
质量管理部、存档
目的:规范药材的检验方法及操作程序。
范围:三叉苦
责任:质检员
程序:
1性状
取本品,置光线明亮处观察其形状、大小、色泽、表面特征、质地、断面。鼻闻口尝其气味。
2鉴别
取本品粉末,按《中国药典》2005年版一部附录IIC观察其显微特征。
甘草片、炙甘草质量标准及检验操作规程
XXXXXXXXXX成品质量标准及检验操作规程1 品名:1.1中文名:甘草片炙甘草1.2 汉语拼音:Gancaopian Zhigancao2 代码:3 取样文件编号:4 检验方法文件编号:5 依据:《中国药典》(2020年版一部)。
6 质量标准:7净药材质量标准:8 检验操作规程:8.1 试药试剂:乙醚、甲醇、正丁醇、甘草对照药材、甘草酸铵对照品、1%氢氧化钠溶液、乙酸乙酯、甲酸、冰醋酸、10%硫酸乙醇溶液、0.2mol/L 醋酸铵溶液、甘草酸单铵盐对照品、乙腈、70%乙醇溶液、甘草苷对照品。
8.2 仪器设备:游标卡尺、显微镜、电子天平、回流装置、水浴锅、硅胶G薄层板、紫外灯、烘箱、原子吸收仪、马弗炉、超声波清洗器、高效液相色谱仪。
8.3 性状:取本品适量,自然光下目测色泽,嗅闻气味。
8.4 鉴别:8.4.1甘草片取本品制片置10×10显微镜下做显微观察。
8.4.2甘草片、炙甘草取本品粉末1g,加乙醚40ml,加热回流1小时,滤过,药渣加甲醇30ml,加热回流1小时,滤过,滤液蒸干,残渣加水40ml 使溶解,用正丁醇提取3次,每次20ml,合并正丁醇液,用水洗涤3次,弃去水液,正丁醇液蒸干,残渣加甲醇5ml使溶解,作为供试品溶液。
另取甘草对照药材1g,同法制成对照药材溶液。
再取甘草酸单铵盐对照品,加甲醇制成每1ml含2mg的溶液,作为对照品溶液。
照薄层色谱法(附录7)试验,吸取上述三种溶液各1~2µl,分别点于同一用1%氢氧化钠溶液制备的硅胶G薄层板上,以乙酸乙酯-甲酸-冰醋酸-水(15:1:1:2)为展开剂,展开,取出,晾干,喷以10%硫酸乙醇溶液,在105℃加热至斑点显色清晰,置紫外光灯(365nm)下检视。
供试品色谱中,在与对照药材色谱相应的位置上,显相同颜色的荧光斑点;在与对照品色谱相应的位置上,显相同的橙黄色荧光斑点。
8.5 检查:甘草片8.5.1水分:不得过11.0%(附录15第二法)。
艾叶检验操作规程
GMP管理文件
一.目的:为规范艾叶的检验标准和生产要求,特制定此标准。
二.适用范围:适用于中药材艾叶的质量检验。
三.责任者:质量检验员
四.正文:
检品名称:艾叶
检验依据:《艾叶内控质量标准》
检验仪器:显微镜
操作内容:
1.性状本品多皱缩、破碎,有短柄。
完整叶片展平后呈卵状椭圆形,羽状深裂,裂片椭圆状披针形,边缘有不规则的粗锯齿;上表面灰绿色或深黄绿色,有稀疏的柔毛及腺点;下表面密生灰白色绒毛。
质柔软。
气清香,味苦。
2.鉴别本品粉末绿褐色。
非腺毛有两种:一种为T字形毛,顶端细胞长而弯曲,两臂不等长,柄2~4细胞;另一种为单列性非腺毛,3~5细胞,顶端细胞特长而扭曲,常断落。
腺毛表面观鞋底形,由4、6细胞相对叠合而成,无柄。
草酸钙簇晶,直径3~7μm,存在于叶肉
细胞中。
何首乌质量标准及检验操作规程
XXXXXXX有限公司原料质量标准及检验操作规程1品名:1.1中文名:何首乌1.2汉语拼音:Heshouwu2代码:3取样文件编号:4检验方法文件编号:5依据:《中国药典》(2020年版一部)。
6质量标准:7检验操作规程:7.1试药与试剂:乙醇、何首乌对照药材、羧甲基纤维素钠、三氯甲烷、甲醇、水、乙腈、磷酸、盐酸、大黄素对照品、大黄素甲醚对照品、2, 3, 5, 4’ -四羟基二苯乙烯-2-O-B-D-葡萄糖苷对照品。
何首乌质量标准及检验操作规程7.2仪器与用具:显微镜、电子天平、超声波清洗器、水浴锅、硅胶H薄层板、三用紫外分析仪、恒温鼓风干燥箱、马福炉、分液漏斗、高效液相色谱仪。
7.3性状:取本品适量,自然光下目测色泽,嗅闻气味。
7.4鉴别:7.4.1取本品横切面制片显微镜(10X10)观察组织结构特征。
7.4.2取本品粉末0.25g,加乙醇50ml,加热回流1小时,滤过,滤液浓缩至3ml,作为供试品溶液。
另取何首乌对照药材0.25g,同法制成对照药材溶液。
照薄层色谱法(附录7)试验,吸取上述两种溶液各2〃,l分别点于同一以羧甲基纤维素钠为黏合剂的硅胶H薄层板上使成条状,以三氯甲烷-甲醇(7:3)为展开剂,展至约3.5cm,取出,晾干,再以三氯甲烷-甲醇(20:1)为展开剂,展至约7cm,取出,晾干,置紫外光灯(365nm)下检视。
供试品色谱中,在与对照药材色谱相应的位置上,显相同颜色的荧光斑点。
7.5检查:7.5.1水分:不得过10.0% (附录15第二法)。
7.5.2总灰分:不得过5.0% (附录17)。
7.5.3二氧化硫残留量照二氧化硫残留量测定法(附录58)测定,不得过150mg/kg。
7.6含量测定:7.6.1二苯乙烯苷避光操作。
照高效液相色谱法(附录8)测定。
色谱条件与系统适用性试验以十八烷基硅烷键合硅胶为填充剂;以乙腈-水(25:75)为流动相;检测波长为320nm。
理论板数按2, 3, 5, 4, -四羟基二苯乙烯-2-O- B -D-葡萄糖苷峰计算应不低于2000。
001人参饮片成品检验标准操作规程
目的建立人参饮片成品检验操作规程,规范检验规程,保证检验结果的准确性。
范围适用于人参饮片成品质量标准的检验。
责任化验室主任、化验员内容1 编订依据:中华人民共和国药典(2005年版一部)2 规程:2.1 性状:主根呈纺锤形或圆柱形,长3~15cm,直径1~2cm。
表面灰黄色,上部或全体有疏浅断续的粗横纹及明显的纵皱,下部有支根2~3条,并着生多数细长的须根,须根上常有不明显的细小疣状突出。
根茎(芦头)长1~4cm,直径0.3~1.5cm,多拘挛而弯曲,具不定根(艼)和稀疏的凹窝状茎痕(芦碗)。
质较硬,断面淡黄白色,显粉性,形成层环纹棕黄色,皮部有黄棕色的点状树脂道及放射状裂隙。
香气特异,味微苦、甘。
或主根多与根茎近等长或较短,呈圆柱形、菱角形或人字形,长1~6cm。
表面灰黄色,具纵皱纹,上部或中下部有环纹。
支根多为2~3条,须根少而细长,清晰不乱,有较明显的疣状突起。
根茎细长,少数粗短,中上部具稀疏或密集而深陷的茎痕。
不定根较细,多下垂。
2.2 鉴别:2.2.1 设备和仪器:显微镜、载玻片、盖玻片。
2.2.2 照“显微鉴别法标准操作规程”进行操作。
本品横切面木栓层为数列细胞。
栓内层窄。
韧皮部外侧有裂隙,内侧薄壁细胞排列较紧密,有树脂道散在,内含黄色分泌物。
形成层成环。
木质部射线宽广,导管单个散在或数个相聚,断续排列成放射状,导管旁偶有非木化的纤维。
薄壁细胞含草酸钙簇晶。
粉末淡黄白色,树脂道碎片易见,含黄色块状分泌物。
草酸钙簇晶直径20~68µm,棱角锐尖。
木栓细胞表面观类方形或多角形,壁细波状弯曲。
网纹导管及梯纹导管直径10~56µm。
淀粉粒甚多,单粒类球形、半圆形或不规则多角形,直径4~20µm,脐点点状或裂缝状;复粒由2~6分粒组成。
2.3 检查2.3.1 水分:照水分测定法(中国药典2005版附录ⅨH第一法)测定,不得过12.0%。
2.3.2 总灰分:照总灰分测定法(中国药典2005版附录ⅨK) 测定,总灰分不得过5.0%。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
XXXXXXXXXX有限公司原料质量标准及检验操作规程
标题 独一味质量标准及检验操作规程 第1页 共4页
文件号 起草人 起草日期
部门审阅 日期 QA审阅 日期
批准 日期 生效日期
颁发部门 分发部门
变更记录
文件修订号 变更版本 变更时间 变更原因
1品名:
1.1中文名:独一味
1.2汉语拼音:Duyiwei
2代码:
3取样文件编号:
4检验方法文件编号:
5依据:《中国药典》(2020年版一部)。
6质量标准:
项目 法定标准 内控标准
本品系藏族习用药材。为唇形科植物独一味Lamio-phlomisrotata(Benth.)
Kudo的干燥地上部分。秋季花果期采割,洗净,晒干。
性状 本品叶莲座状交互对生,卷縮,展平后呈扇形或三角状卵形,长4~12cm,宽5~15cm;先端钝或圆形,基部浅心形或下延成宽楔形,边缘具圆齿;上表绿褐色,下表面灰绿色;脉扇形,小脉网状,突起;叶柄扁平而宽。果序略呈塔形或短圆锥状,长3~6cm;宿萼棕色,管状钟形,具5棱线,萼齿5,先端具长刺尖。小坚果倒卵状三棱形。气微,味微涩、苦。 同法定标准
鉴别 (1)本品粉末棕褐色。非腺毛众多,2~3细胞组成,直径10~15µm,壁较厚,有疣状突起。叶肉细胞呈不规则形,内含众多草酸钙针晶,长7~10µm。气孔直轴式或不等式。纤维长梭形,壁孔横裂。 (2)取本品粉末lg,加乙醇10ml,加热回流15分钟,滤过,取滤液作为同法定标准
独一味质量标准及检验操作规程 第 2 页 共 4 页
供试品溶液。另取独一味对照药材lg,同法制成对照药材溶液。再取山梔苷
甲酯对照品、8-O-乙酰山栀苷甲酯对照品,加乙醇制成每lml各含0.5mg的
混合溶液,作为对照品溶液。照薄层色谱法(通则0502)试验,吸取供试品
溶液5~10µ1、对照药材溶液和对照品溶液各5µ1,分别点于同一硅胶G薄
层板上,以三氯甲烷-甲醇(4:1)为展开剂,展开,取出,晾干,喷以磷钼
酸试液,在105℃加热至斑点显色清晰。供试品色谱中,在与对照药材色谱
和对照品色谱相应的位置上,显相同颜色的斑点。
检查 水分 不得过13.0%(通则0832第二法)。 总灰分 不得过13.0%(通则2302)。 酸不溶性灰分 不得过4.0%(通则2302)。 二氧化硫残留量 照二氧化硫残留量测定法(通则2331)测定,不得过150mg/kg。 同法定标准
浸出物 照醇溶性浸出物测定法(通则2201)项下的热浸法测定,用70%乙醇作溶剂,不得少于20.0%。 同法定标准
含量测定 照高效液相色谱法(通则0512)测定。 色谱条件与系统适用性试验 以十八烷基硅烷键合硅胶为填充剂;以乙腈为流动相A,水为流动相B,按下表中的规定进行梯度洗脱;检测波长为235nm。理论板数按山栀苷甲酯峰计算应不低于3000。 时间(分钟) 流动相A(%) 流动相B(%) 0~11 9 91 11~35 9→18 91→82 35~45 18 82 对照品溶液的制备 取山栀苷甲酯对照品、8-0-乙酰山栀苷甲酯对照品适量,精密称定,加甲醇制成每lml各含30µg的混合溶液,即得。 供试品溶液的制备 取本品粉末(过三号筛)约0.6g,精密称定,置具塞锥形瓶中,精密加入70%甲醇25ml,密塞,称定重量,加热回流1小时,放冷,再称定重量,用70%甲醇补足减失的重量,摇匀,滤过,精密量取续滤液2ml,置10ml量瓶中,加甲醇至刻度,摇匀,滤过,取续滤液,即得。 测定法 分别精密吸取对照品溶液与供试品溶液各10µl,注入液相色谱仪,测定,即得。 本品按干燥品计算,含山栀苷甲酯(C17H26O11)和8-0-乙酰山栀苷甲酯(C19H28O12)的总量不得少于0.50%。 同法定标准
复验期 36个月 同法定标准
独一味质量标准及检验操作规程 第 3 页 共 4 页
贮藏 置通风干燥处。 同法定标准
7 检验操作规程:
7.1 试药与试剂:乙醇、独一味对照药材、山栀苷甲酯对照品、8-O乙酰山
栀苷甲酯对照品、三氯甲烷、甲醇、磷钼酸、乙腈、盐酸、硝酸、硝酸银、氨
试液、二氧化锰、硫酸、碘化钾淀粉试纸、氢氧化钠滴定液、甲基红乙醇溶液
指示剂。
7.2 仪器与用具:显微镜、硅胶G板、烘箱、马弗炉、电子天平、高效液
相色谱仪、中药二氧化硫测定仪。
7.3 性状:取本品适量,自然光下目测光泽,嗅闻气味。
7.4 鉴别:
7.4.1取本品制片置10×10显微镜下做显微观察。
7.4.2取本品粉末lg,加乙醇10ml,加热回流15分钟,滤过,取滤液作为
供试品溶液。另取独一味对照药材lg,同法制成对照药材溶液。再取山梔苷甲
酯对照品、8-O-乙酰山栀苷甲酯对照品,加乙醇制成每lml各含0.5mg的混合溶
液,作为对照品溶液。照薄层色谱法(附录7)试验,吸取供试品溶液5~10µ1、
对照药材溶液和对照品溶液各5µ1,分别点于同一硅胶G薄层板上,以三氯甲
烷-甲醇(4:1)为展开剂,展开,取出,晾干,喷以磷钼酸试液,在105℃加
热至斑点显色清晰。供试品色谱中,在与对照药材色谱和对照品色谱相应的位
置上,显相同颜色的斑点。
7.5 检查:
7.5.1水分:不得过13.0%(附录15第二法)。
7.5.2总灰分:不得过13.0%(附录17)。
7.5.3酸不溶性灰分:不得过4.0%(附录17)。
独一味质量标准及检验操作规程 第 4 页 共 4 页
7.5.4二氧化硫残留量:照二氧化硫残留量测定法(附录58)测定,不得过
150mg/kg。
7.6 浸出物照醇溶性浸出物测定法(附录19)项下的热浸法测定,用70%
乙醇作溶剂,不得少于20.0%。
7.7 含量测定:照高效液相色谱法(附录8)测定。
色谱条件与系统适用性试验 以十八烷基硅烷键合硅胶为填充剂;以乙腈
为流动相A,水为流动相B,按下表中的规定进行梯度洗脱;检测波长为235nm。
理论板数按山栀苷甲酯峰计算应不低于3000。
时间(分钟) 流动相A(%) 流动相B(%)
0~11
9 91
11~35
9→18 91→82
35~45
18 82
对照品溶液的制备 取山栀苷甲酯对照品、8-0-乙酰山栀苷甲酯对照品适
量,精密称定,加甲醇制成每lml各含30µg的混合溶液,即得。
供试品溶液的制备 取本品粉末(过三号筛)约0.6g,精密称定,置具塞锥
形瓶中,精密加入70%甲醇25ml,密塞,称定重量,加热回流1小时,放冷,
再称定重量,用70%甲醇补足减失的重量,摇匀,滤过,精密量取续滤液2ml,
置10ml量瓶中,加甲醇至刻度,摇匀,滤过,取续滤液,即得。
测定法 分别精密吸取对照品溶液与供试品溶液各10µl,注入液相色谱仪,
测定,即得。
本品按干燥品计算,含山栀苷甲酯(C17H26O11)和8-0-乙酰山栀苷甲酯
(C19H28O12)的总量不得少于0.50%。
