高等有机化学第6章
合集下载
有机化学课件--第六章立体化学共101页PPT资料

H C3HC COOH
H C3H*C COOH
H
OH
乳酸所以具有旋光性,可能是因为分子中有
一个*C原子(不对称碳原子或手性碳)。
为什么有*C原子就可能具有旋光性? :
2019/9/1
课件
7
(1)一个*C就有两种不同的构型:
(2)二者关系:互为镜象(实物与镜象关系,或左、 右手关系)。二者无论如何也不能完全重叠。
2019/9/1
课件
26
判断基团大小的依据是我们已经熟悉的顺 序规则
O H
C O O H
C O O H
C O O H
CH
CH
H O O C C H 3 C H 3 O H
(S)-
(S)-
C H
H O C H 3 (R )-
C
H H O
C H 3
(R )-
基 团 大 小 顺 序 : O H > C O O H > C H 3 > H
光是一种电磁波,光波的振动方向与光的前进 方向垂直。
让光通过一个象栅栏一样的 Nicol 棱镜 (起偏镜)
不是所有方向的光都能通过,而只有与棱镜晶轴方
向平行的光才能通过。这样,透过棱晶的光就只能
在一个方向上振动。这种只在一个平面振动的光,
称为平面偏振光,简称偏振光或偏光。
2019/9/1
课件
3
那么,偏振光能否透过第二个Nicol 棱镜 (检偏 镜) 取 决于两个棱镜的晶轴是否平行,平行则可透 过;否则不能通过。
一个C* 两个C* 三个C* 四个C*
…… n个C*
A+ B+ B-
C+ C- C+ C-
有机合成化学:第六章 缩合反应
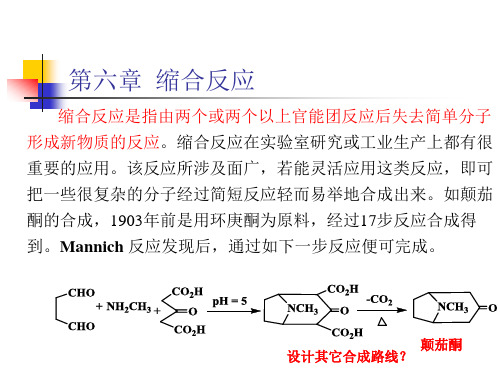
该反应在强碱作用下完成
CO2C2H5 O
其反应过程为:
第六章 缩合反应
4,醛(酮)与其它化合物的缩合: 1)硝基化合物:
这是合成苯乙胺类化合物的方法,例如:
合成小糪 碱的原料
第六章 缩合反应
2) 腈:
PhCH2C N NaOC2H5 PhCHC N PhCHO PhCHCN HC Ph
PhCCN 83-91% HC Ph
第六章 缩合反应
解释PhX难反应原因
卤代烷或环氧丙烷类化合物均可作烷基化试剂,用PhX类化 合物一般不行。丙二酸二乙酯在醇钠作用下可得较高产率单烷基 化产物。如果进行第二次烷基化则需要更强的碱。这是因为第一 个烷基的给电 子作用和空间作用使第二个α-氢的活性降低。这 里存在一个特殊情况,丙二酸二乙酯和1.3-二溴丙烷作用,在醇 钠的催化下直接得到二烷基化产物,环丁烷类化合物:
该反应在工业上有许多应用。如:
第六章 缩合反应
3、二腈类化合物的缩合:
第六章 缩合反应
5-8员环可得到90%的收率,14-33员环可得到60-80%的收率, 9-13员环只有1.3-15%的收率。
三、碳负离子的烷基化:
1、双官能团化合物的烷基化: 被两个吸电子基团活化后的α-氢有较大活性,可在温和条件 下进行烷基化,用醇钠作碱即可。在DMF或DMSO中,碳负 离子不会被溶剂化,活性更高,反应较快。如:
- Ph-CH=CH CO2C2H5
这种醛不能够含α-H,否则会以自身缩合产物为主。
与酸酐的缩合(反应): 这是制备肉桂酸的基本方法。能发生类似反应的还有其它醛。
第六章 缩合反应
苯环上的硝基增加了羰基的活性,使反应更易进行。相反, 对位或邻位二甲氨基的存在,可降低羰基的活性,使苯甲醛 不能发生此反应。但水杨醛尽管邻位存在供电子基羟基, 反应仍可以顺利进行:
有机化学课件 第6章 立体化学3
不能与自身镜像重合的分子。是不对称性 的分子。
分子与它的镜像不能重合的性质。
手性分子具有互为影像且不能重合的两种 构型,即对映异构体。
3. 判断分子具有手性的方法
如果分子中没有对称面和对称中心,分子一定是手 性分子,有旋光性,存在对映异构现象。
含有一个C*的分子
手性分子
含有两个以上C*或不含C*的分子 寻找对称面和对称中心
e
c ef a bd
c af db
e
e bd fa
c
说明:
1. Fischer投影式是一个重叠式构象;
2. 分子构型与构象的关系:
➢分子的任一构象都能表达出该分子的构型。分子的任 一构象有对称面或对称中心,分子就不是手性分子。
➢同一分子不同构象间相互转化,只需通过σ 键的旋转, 没有化学键的断裂;而要使构造式相同的分子构型转 变,必须经过化学键的断裂才能实现。
6.2 对映体
一.分子手性和对映异构
H CH3 C CH2CH3
Br
C
H
CH3
C2H5
Br
左右手互为镜 像与实物关系
左右手不 能重合
手性关系
象左右手互为实物与镜像的关系,且彼此不能完全重 合的特性,称手性或手征性
存在手性关系的分子,即不能与其镜像重叠的分子称为 手性分子
彼此成镜像关系,又不能重叠的两个异构体,互为对 映体,它属于立体异构体。
使偏振光的振动平面向右旋转(顺时针旋转)的为右旋体, 以(+)表示。
使偏振光的振动平面向左旋转(逆时针旋转)的为左旋体, 以(-)表示。
例如:(+)-2-溴丁烷 表示右旋体2-溴丁烷 ()-2-丁醇 表示左旋体2-丁醇
所有的旋光性物质,不是右旋的,就是左旋的。(+)和() 仅表示旋光方向不同,并不表示旋转角度的大小。
分子与它的镜像不能重合的性质。
手性分子具有互为影像且不能重合的两种 构型,即对映异构体。
3. 判断分子具有手性的方法
如果分子中没有对称面和对称中心,分子一定是手 性分子,有旋光性,存在对映异构现象。
含有一个C*的分子
手性分子
含有两个以上C*或不含C*的分子 寻找对称面和对称中心
e
c ef a bd
c af db
e
e bd fa
c
说明:
1. Fischer投影式是一个重叠式构象;
2. 分子构型与构象的关系:
➢分子的任一构象都能表达出该分子的构型。分子的任 一构象有对称面或对称中心,分子就不是手性分子。
➢同一分子不同构象间相互转化,只需通过σ 键的旋转, 没有化学键的断裂;而要使构造式相同的分子构型转 变,必须经过化学键的断裂才能实现。
6.2 对映体
一.分子手性和对映异构
H CH3 C CH2CH3
Br
C
H
CH3
C2H5
Br
左右手互为镜 像与实物关系
左右手不 能重合
手性关系
象左右手互为实物与镜像的关系,且彼此不能完全重 合的特性,称手性或手征性
存在手性关系的分子,即不能与其镜像重叠的分子称为 手性分子
彼此成镜像关系,又不能重叠的两个异构体,互为对 映体,它属于立体异构体。
使偏振光的振动平面向右旋转(顺时针旋转)的为右旋体, 以(+)表示。
使偏振光的振动平面向左旋转(逆时针旋转)的为左旋体, 以(-)表示。
例如:(+)-2-溴丁烷 表示右旋体2-溴丁烷 ()-2-丁醇 表示左旋体2-丁醇
所有的旋光性物质,不是右旋的,就是左旋的。(+)和() 仅表示旋光方向不同,并不表示旋转角度的大小。
6章-亲核取代反应

C. 带负电荷亲核试剂 + 正离子底物
R
L + Nu
+
Nu
R
L
Nu R + L
电荷减少
极性溶剂对反应不利。
1
前五章的内容: 1. 序论 2. 取代基效应
3. 有机酸碱理论 4. 立体化学 5. 有机反应机理的研究和描述 接下来的授课内容及形式
2
以典型反应为基础,以结构、反应、机理开展讨论,在相 应的章节介绍一些基本知识,如,
第六章 亲核取代反应,重点介绍经典碳正离子和非经典碳正离子、 其中介绍碳正离子研究的历史和现状,获诺贝尔化学奖者—— 欧拉教授的研究工作; 超酸的应用;两个极端情况下的反应 机理的SN1和SN2 。 第七章 芳香族化合物的反应, 介绍苯炔中间体 重点介绍芳香性概念:芳香性,非芳香性,反芳香性,同芳香性 等概念 第八章 基于羰基化合物的反应,介绍碳负离子。羰基碳的亲核加成, 羰基-碳的亲电加成反应等,并举出实际有用的例子。 第九章 自由基化学,有关自由基研究的简单介绍:结构与稳定性的关系; 自由基反应的特点,自由基反应历程。
CH3 (+) C6H5 C NH2 H
1.3 按双分子历程反应的势能图
依反应机理的分析,这种反应的 势能图也表现出:新键生成,旧键 断裂,有能量的变化。一般认为, 断裂旧键是吸热的,生成新键是放 热的,这种吸热和放热的能量交换 是在分子内完成的,所以,按SN2 历程进行的反应,活化能低。
Y C
反应进程
那些类型化合物?
8
1.3 机理的研究
由于该反应涉及到底物的性质和亲核试剂的性质 , 基于两者,这类反应按其机理的不同分为两种极 限情况被讨论,如,SN1 和 SN2。
有机化学第6章芳烃-文档资料77页

• 1847年以后发现煤焦油是苯及相同化合物的丰 富来源
• 芳烃是历史的名词,并非都有芳香味,分子中 没有苯环但性质与芳烃相似的烃,叫非苯芳烃。
• 芳烃:含有苯环的烃叫芳香烃,简称芳烃。
6.1 苯的结构
一、凯库勒式 芳烃是芳香族化合物的母体,苯是最简单的芳 烃,苯的分子式C6H6,六个碳原子连成一个闭 合的平面碳环,每个碳原子连一个氢原子。
• 对于结构较复杂或支链上有官能团的化合物以及多苯代脂烃,可
以把苯环作为取代基来命名。
C H 3 C H 3C H 2C H C H C H 3 2-甲基-3-苯基戊烷 C 6H 5
C 6H 5C H 2C HC H 2 3-苯基-1-丙稀
φ2 C H 2 二苯甲烷
二、单环芳烃的物理性质
• 苯及其同系物一般为无色液体,不溶于水,易溶于有 机溶剂。环丁砜、二甘醇、N-甲基吡咯烷酮等溶剂对 芳烃有高度的选择性溶解能力,常用来萃取芳烃。
2 F e + 3 B r 2 2 F e B r 3 B r 2 + F e B r 3 F e B r 4 - + B r +
• 卤正离子作为亲核试剂进攻苯环生成卤代苯
H
+ Br
Br
H Br + Br FeBr3
Br +HBr+FeBr3
• 氯苯和溴苯进一步卤代时,产物主要为邻和对位异构 体。
均三甲苯 1,3,5-三甲苯
• 苯环上连有不同烷基时,一般将含最简单烷基的芳烃
做母体。
C H 2C H 3
C H 2C H 2 C H 3 CH3
3-乙基甲苯
4-丙基-1,3-二甲苯
CH3
CH3
• 苯环上连有不饱和基时,一般以不饱和烃为母体,苯环为取代基
• 芳烃是历史的名词,并非都有芳香味,分子中 没有苯环但性质与芳烃相似的烃,叫非苯芳烃。
• 芳烃:含有苯环的烃叫芳香烃,简称芳烃。
6.1 苯的结构
一、凯库勒式 芳烃是芳香族化合物的母体,苯是最简单的芳 烃,苯的分子式C6H6,六个碳原子连成一个闭 合的平面碳环,每个碳原子连一个氢原子。
• 对于结构较复杂或支链上有官能团的化合物以及多苯代脂烃,可
以把苯环作为取代基来命名。
C H 3 C H 3C H 2C H C H C H 3 2-甲基-3-苯基戊烷 C 6H 5
C 6H 5C H 2C HC H 2 3-苯基-1-丙稀
φ2 C H 2 二苯甲烷
二、单环芳烃的物理性质
• 苯及其同系物一般为无色液体,不溶于水,易溶于有 机溶剂。环丁砜、二甘醇、N-甲基吡咯烷酮等溶剂对 芳烃有高度的选择性溶解能力,常用来萃取芳烃。
2 F e + 3 B r 2 2 F e B r 3 B r 2 + F e B r 3 F e B r 4 - + B r +
• 卤正离子作为亲核试剂进攻苯环生成卤代苯
H
+ Br
Br
H Br + Br FeBr3
Br +HBr+FeBr3
• 氯苯和溴苯进一步卤代时,产物主要为邻和对位异构 体。
均三甲苯 1,3,5-三甲苯
• 苯环上连有不同烷基时,一般将含最简单烷基的芳烃
做母体。
C H 2C H 3
C H 2C H 2 C H 3 CH3
3-乙基甲苯
4-丙基-1,3-二甲苯
CH3
CH3
• 苯环上连有不饱和基时,一般以不饱和烃为母体,苯环为取代基
有机化学 第六章 立体化学

a C d b S构型 c
观察方向
C d
b
c R构型 CHO ex: H OH CH2OH
Cl C2H5 H
Cl>C2H5>CH3>H
CH3
OH>CHO>CH2OH>H
R-(+)-甘油醛
S-(+)-2-氯丁烷
* R/S是基于次序规则确定的,与原来的基团没有联系。
OH OH 还原 C2H5 CH3 C2H5 CH2Br H H OH>CH2Br>CH2CH3>H OH>CH2CH3>CH3>H S构型 R构型 * CH 还原时,与 C 相连的键没有断裂,因此构型保持不变,但CH3 和 2Br 次序改变
R-2-溴丙酸
Ag2O. H2O
COOH H OH CH3
R-乳酸
六. 外消旋体的拆分 1. 机械拆分法 2. 选择吸附拆分法 3. 微生物拆分法 4. 化学拆分法 ex: 拆分酸
(+)RCOOH ( )RCOOH
-
2( ) RNH2
-
RCOO( )RNH3 (+)
( ) ( )
- RCOO - RNH3
H CH3
H P H
H
COOH
3. 对称轴(Cn) 360°/n (n=正整数,且n>1)
H3C C H C2
4.交替对称轴(旋转反应轴) 设想分子中有一跳直线,当分子以此直线为轴旋转360°/n 后,再用一个与此直线 垂直的平面进行反映(即以次平面为镜面,作出镜像),如果得到的镜像与原来分子 完全相同,这条直线就是交替对称轴。例如:
α C10H7
如果a=b,则由于有m. 因而不是手性分子
观察方向
C d
b
c R构型 CHO ex: H OH CH2OH
Cl C2H5 H
Cl>C2H5>CH3>H
CH3
OH>CHO>CH2OH>H
R-(+)-甘油醛
S-(+)-2-氯丁烷
* R/S是基于次序规则确定的,与原来的基团没有联系。
OH OH 还原 C2H5 CH3 C2H5 CH2Br H H OH>CH2Br>CH2CH3>H OH>CH2CH3>CH3>H S构型 R构型 * CH 还原时,与 C 相连的键没有断裂,因此构型保持不变,但CH3 和 2Br 次序改变
R-2-溴丙酸
Ag2O. H2O
COOH H OH CH3
R-乳酸
六. 外消旋体的拆分 1. 机械拆分法 2. 选择吸附拆分法 3. 微生物拆分法 4. 化学拆分法 ex: 拆分酸
(+)RCOOH ( )RCOOH
-
2( ) RNH2
-
RCOO( )RNH3 (+)
( ) ( )
- RCOO - RNH3
H CH3
H P H
H
COOH
3. 对称轴(Cn) 360°/n (n=正整数,且n>1)
H3C C H C2
4.交替对称轴(旋转反应轴) 设想分子中有一跳直线,当分子以此直线为轴旋转360°/n 后,再用一个与此直线 垂直的平面进行反映(即以次平面为镜面,作出镜像),如果得到的镜像与原来分子 完全相同,这条直线就是交替对称轴。例如:
α C10H7
如果a=b,则由于有m. 因而不是手性分子
有机化学上第六章 立体化学
(1) 手性的概念
手——左、右手互为实物与镜像的关系,不能完全重合。 手性——像左右手一样,实物与其镜象不能叠合的性质。 例如两种不同的乳酸分子都具有手性:
右旋乳酸, 由肌肉运动产生 左旋乳酸, 由蔗糖发酵得到
COOH H C OH H3C 实物 HO 镜子
COOH C H CH3 镜象
(动画)
其中心碳原子上连有四个不同的原子或原子团,在 空间有两种不同的排列方式,不能完全重合,互为实物 与镜像的关系,是两种不同的化合物。
Û ¹ ¸ ²
NicolÀâ ¾µ
旋光性——某些物质能使偏振光的振动方向旋转一定角 度的性质。 右旋—— (+) ; 左旋 ——(-) 旋光度——旋光性物质使偏振光的振动平面所旋转的角 度,用α表示。 显然,溶液的旋光度与浓度、单位盛液管长度成正比。 比旋光度——单位浓度、单位盛液管长度下测得的旋光 度,用[α]表示。
实际测量时,可用溶液测量其旋光度,再用下式计算其 比旋光度: a t [a]l = l C 式中:[α] λ t ——比旋光度; λ——测量时所采用的光波波长; t ——测量时的温度; α——由仪器测得的溶液的旋光度; l ——盛液管的长度,单位为dm(1dm=10cm);
C ——溶液的浓度,单位为g.mL-1。
注
意:
R/S标记法与D/L标记法的依据不同。
R/S法依据与 * C相连的四个原子或原子团的 大小顺序; D/L法依据与D-甘油醛的构型是否相同。
(五)具有两个手性中心的对映异构
(1) 具有两个不同手性碳原子的对映异构 (2) 具有两个相同手性碳原子的对映异构
(五)具有两个手性中心的对映异构
(1) 具有两个不同手性碳原子的对映异构
② 将手性碳上的四个基团中的任意三个轮转(顺时针或 反时针),构型不变;
有机化学第6章芳烃2019
• 对于结构较复杂或支链上有官能团的化合物以及多苯代脂烃,可
以把苯环作为取代基来命名。
C H 3 C H 3C H 2C H C H C H 3 2-甲基-3-苯基戊烷 C 6H 5
C 6H 5C H 2C HC H 2 3-苯基-1-丙稀
φ2 C H 2 二苯甲烷
二、单环芳烃的物理性质
• 苯及其同系物一般为无色液体,不溶于水,易溶于有 机溶剂。环丁砜、二甘醇、N-甲基吡咯烷酮等溶剂对 芳烃有高度的选择性溶解能力,常用来萃取芳烃。
第六章
芳烃
芳烃的由来
• 在有机化学发展初期,把从天然产物中得到的 有香气的化合物通称为芳香族化合物,如香树 脂、香精油
• 1825年法拉第从照明气的液体冷凝气中分离出 苯,并测定其组成为CH
• 1834年,德国科学家米希尔里希(E.E.Mitscherlich) 通过蒸馏苯甲酸和石灰的混合物,得到了与法拉 第所制液体相同的一种液体,并命名为苯。
1,4-二甲苯
CH3
邻二甲苯 O-二甲苯 1,2-二甲苯
间二甲苯 m-二甲苯 1,3-二甲苯
CH 3
• 三个烷基相同的三元烷基苯分别用连,偏,均或1,2,3-, 1,2,4-,1,3,5-表示。
CH3
CH3
CH3
CH3
CH3
CH3
连三甲苯 1,2,3-三甲苯
CH3
偏三甲苯 1,2,4-三甲苯
CH3
H
H
H
H
H 简写
H
凯库勒于1865年提出,因而称为苯 的凯库勒式,其可以说明苯的一元 取代物只有一种的事实但不能说明 苯的邻二元取代物只有一种的事实, 也不能解释苯环的特殊稳定性和苯 易于取代反应而难于加成反应的原 因
以把苯环作为取代基来命名。
C H 3 C H 3C H 2C H C H C H 3 2-甲基-3-苯基戊烷 C 6H 5
C 6H 5C H 2C HC H 2 3-苯基-1-丙稀
φ2 C H 2 二苯甲烷
二、单环芳烃的物理性质
• 苯及其同系物一般为无色液体,不溶于水,易溶于有 机溶剂。环丁砜、二甘醇、N-甲基吡咯烷酮等溶剂对 芳烃有高度的选择性溶解能力,常用来萃取芳烃。
第六章
芳烃
芳烃的由来
• 在有机化学发展初期,把从天然产物中得到的 有香气的化合物通称为芳香族化合物,如香树 脂、香精油
• 1825年法拉第从照明气的液体冷凝气中分离出 苯,并测定其组成为CH
• 1834年,德国科学家米希尔里希(E.E.Mitscherlich) 通过蒸馏苯甲酸和石灰的混合物,得到了与法拉 第所制液体相同的一种液体,并命名为苯。
1,4-二甲苯
CH3
邻二甲苯 O-二甲苯 1,2-二甲苯
间二甲苯 m-二甲苯 1,3-二甲苯
CH 3
• 三个烷基相同的三元烷基苯分别用连,偏,均或1,2,3-, 1,2,4-,1,3,5-表示。
CH3
CH3
CH3
CH3
CH3
CH3
连三甲苯 1,2,3-三甲苯
CH3
偏三甲苯 1,2,4-三甲苯
CH3
H
H
H
H
H 简写
H
凯库勒于1865年提出,因而称为苯 的凯库勒式,其可以说明苯的一元 取代物只有一种的事实但不能说明 苯的邻二元取代物只有一种的事实, 也不能解释苯环的特殊稳定性和苯 易于取代反应而难于加成反应的原 因
有机化学(上)第六章 6.2.3
CO2↑
O
O
Mn
O
>C=C<
KMnO4 冷、稀 OH -
>C
O C< H2O
顺邻二 醇OH OH >C Nhomakorabea C< + MnO2
由于邻二元醇的进一步氧化,反应条件不易控制, 收率低。如用四氧化锇代替高锰酸钾,使用H2O2作为 氧化剂,则收率大大提高,但毒性大。
+ H2O2
Os O4
H OH
H OH
2.催化氧化
H2C CH CH3 + O2
Cu2O
350℃,0.25MPa
H2C CHCHO + H2O
丙烯在铋、钼、磷等催化剂存在下,用空气和 氨直接氧化生成丙烯腈的反应称为氨氧化反应。
H2C
CH
CH3+
3 2
O2+
NH3
催化剂 470℃
H2C CHCN + 3 H2O
C
Cα
δ-
δ+
XX
X·
高温或光照α-氢卤代,低温双键加成
与氯相比,溴的反应活性较差,但是选择性比氯 好。对于苄基或者烯丙基的溴代通常使用N-溴代 丁二酰亚胺(简称NBS)作溴化剂。
+ Br2
光照
Br + HBr
O
+
CCl4 N Br
O NBS
Br +
O NH
O
二、α-氢的氧化反应
工业上以金属氧化物(如Cu2O)为催化剂,用 空气氧化丙烯,生成丙烯醛:
3)烯烃加次卤酸后在碱性条件下脱卤化氢
4.臭氧化
CH3CH=CH2 O3
O H3C CH CH2
OO
有机化学第6章对映异构
I 和 III, I 和 IV, II 和 III, II 和 IV是非对映体 (diastereomers)关系
Stereoismers that are not enantiomers are diastereomers of each other. As diastereomers they have different physical properties: mp, bp, etc. Diastereomers often display different chemical reactivity.
第3章 对映异构
光学活性、立体异构、对映体、非对映体 手性中心 绝对构型(R、S) 赤式和苏式 拆分
2020/3/11
1
构造异构
骨架异构 官能团异构 官能团位置异构
异构现象 立体异构
顺反异构 构型异构
对映异构
构象异构
2020/3/11
2
一. 对映异构现象(Enantiomerisms):
( 一) 对映异构体和手性 : 1. 对映异构体 (enantiomers):如两个分子具有对映,而不能 重叠的关系,为对映异构体。
确定R, S 构型的方法:右手法则
2020/3/11
10
问题 3-3 用R/S法标示下列各化合物的构型:
Cl (1) ClCH2 CH(CH3)2
CH3
H (2) CH2=CH CH2CH3
Br
(3)
Cl
(H3C)2HC C CH2CH2OH
Br
2020/3/11
11
2020/3/11
12
2020/3/11
CH3
CH3
H
Br
