元素化合物的化学性质归纳
化学中的化合物性质

化学中的化合物性质化学中的化合物性质是化学研究中的一个重要分支,是化学家们研究化合物的性质和行为的主要手段之一。
本文将从化学中的化合物定义、性质分类、化学变化以及应用角度等多个方面来阐述化学中的化合物性质。
一、化合物定义及性质分类化合物是两种或两种以上元素化学结合形成的物质。
化合物的性质与它所组成的元素类型和比例有关。
常见的化合物性质分类有以下几种:1.物理性质包括化合物的外观、颜色、形状、气味等。
这些性质是观察和记录化合物的最基本方式之一。
2.化学性质化合物的化学性质指的是其在化学反应中表现出来的性质。
例如,不同的化合物对不同的酸、碱、高温和氧化剂等物质都有不同的反应。
3.热学性质热学性质是指化合物与热量相关的性质,包括热容、热导率和热稳定性等。
4.电学性质电学性质是指化合物在电导性、导电率和电化学反应等方面的特性。
例如,某些化合物能够产生电子,也能够与电子发生反应。
二、化合物的化学变化化合物在各种不同的化学反应中表现出来的行为和性质也是所研究的部分。
化学变化可能包括某些分子或离子之间的化学键解离或形成,或某些分子或离子与其他物质之间的反应。
化合物在化学反应中可能会表现出不同的性质,包括如下:1.水解反应化合物与水反应会生成新的物质和化合物。
水解反应在许多化学反应中都有应用,其中包括酸碱中和反应和某些水溶性化合物的形成。
2.氧化反应氧化反应是化合物与氧气反应生成新的化合物,通常反应会伴随释放大量的能量。
3.还原反应还原反应中,化合物失去氧原子或者氧分子,生成更简单的化合物。
4.酸碱反应酸碱反应描述了碱性和酸性的平衡,通常反应会产生水和一些中间体化合物。
三、化学中的化合物应用化合物的性质既可以证明其化学特性,也可以作为材料的预测工具。
化学工程师将化学性质应用于化学反应分析和控制,从而生产出各种化学品和材料。
医学领域研究人员将对化合物分子结构和化学反应的了解应用于制药和诊疗方案的开发上。
总结:本文详细介绍了化学中的化合物性质,从化合物定义、性质分类、化学变化以及应用等多个方面进行了阐述。
元素和化合物的基本概念

元素和化合物的基本概念元素和化合物是化学中最基本的概念,它们是理解和研究物质及其性质、变化的基础。
本文将介绍元素和化合物的定义、特征以及它们在自然界和人类生活中的重要性。
一、元素的基本概念元素是构成物质的基本单位,是由同一种原子组成的纯物质。
每个元素都有独特的原子结构和性质。
元素通常以符号表示,如氢元素的符号是H,氧元素的符号是O。
元素的主要特征包括:1. 原子结构:元素的所有原子都具有相同的原子结构,包括原子核和电子壳。
原子核由质子和中子组成,质子数决定了元素的原子序数,也是元素的标识符。
2. 化学性质:元素的化学性质主要由其原子的电子结构决定。
元素可以通过与其他元素发生化学反应来形成化合物。
3. 物理性质:元素的物理性质包括密度、熔点、沸点等。
每个元素都具有独特的物理性质,可以用于元素的鉴别和分离。
元素在自然界中广泛存在,构成了地壳、大气、生物体等各种物质。
元素的丰度以及元素的性质对于地球上的生命和环境都有着重要的影响。
二、化合物的基本概念化合物是由两种或更多不同元素按照一定比例结合而成的物质。
化合物具有新的化学性质和物理性质。
化合物的特征包括:1. 原子组成:化合物由不同元素的原子组成,在化合物中各元素的原子数比例是固定的。
2. 化学性质:化合物具有与原子不同的化学性质。
它们可以通过化学反应分解成元素或与其他化合物形成新的化合物。
3. 物理性质:化合物的物理性质可以与组成它的元素的物理性质不同。
例如,水是由氢和氧组成的化合物,具有独特的物理性质,如沸点和密度。
化合物在自然界中广泛存在,包括水、盐、糖等。
化合物也是人类生产和生活中不可或缺的重要物质,如药物、塑料、合成纤维等。
三、元素和化合物的重要性及应用元素和化合物在生活和科学研究中都有着重要的作用。
1. 基础科学研究:元素和化合物的研究是化学科学的基础。
通过对元素和化合物性质的研究,可以深入了解物质结构和反应机理,推动化学科学的发展。
2. 材料科学:元素和化合物是制备各种材料的基础。
化学之元素周期表的性质
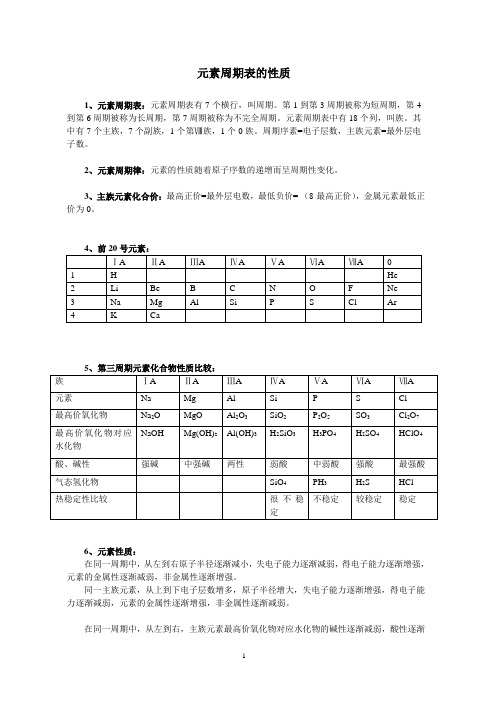
元素周期表的性质1、元素周期表:元素周期表有7个横行,叫周期。
第1到第3周期被称为短周期,第4到第6周期被称为长周期,第7周期被称为不完全周期。
元素周期表中有18个列,叫族。
其中有7个主族,7个副族,1个第Ⅷ族,1个0族。
周期序素=电子层数,主族元素=最外层电子数。
2、元素周期律:元素的性质随着原子序数的递增而呈周期性变化。
3、主族元素化合价:最高正价=最外层电数,最低负价=-(8-最高正价),金属元素最低正价为0。
4、前20号元素:ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 01 H He2 Li Be B C N O F Ne3 Na Mg Al Si P S Cl Ar4 K Ca5、第三周期元素化合物性质比较:族ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA元素Na Mg Al Si P S Cl最高价氧化物Na2O MgO Al2O3SiO2P2O5SO3Cl2O7NaOH Mg(OH)2Al(OH)3H2SiO3H3PO4H2SO4HClO4最高价氧化物对应水化物酸、碱性强碱中强碱两性弱酸中弱酸强酸最强酸气态氢化物SiO4PH3H2S HCl不稳定较稳定稳定热稳定性比较很不稳定6、元素性质:在同一周期中,从左到右原子半径逐渐减小,失电子能力逐渐减弱,得电子能力逐渐增强,元素的金属性逐渐减弱,非金属性逐渐增强。
同一主族元素,从上到下电子层数增多,原子半径增大,失电子能力逐渐增强,得电子能力逐渐减弱,元素的金属性逐渐增强,非金属性逐渐减弱。
在同一周期中,从左到右,主族元素最高价氧化物对应水化物的碱性逐渐减弱,酸性逐渐增强;它们气态氢化物的热稳定性逐渐增强。
在同一主族中,从上到下,元素最高价氧化物对应水化物的酸性逐渐减弱,碱性逐渐增强;它们的气态氢化物的热稳定性逐渐减弱。
原子半径金属性非金属性最高价氧化物对应水化物气态氢化物的稳定性酸性碱性同一横行减小减小增大减小增大增大同一列增大增大减小增大减小减小2011.11.12。
氧元素化学知识点总结

氧元素化学知识点总结氧是化学元素周期表中第8号元素,原子序数为8,原子量为15.9994。
氧元素是地球上最丰富的元素之一,占地壳中的总质量的约46.6%,是地球上第一丰度的元素,化学性质非常活泼,是一种重要的氧化剂。
1. 氧元素的基本性质氧元素是一种无色、无味、无臭的气体,密度为1.429 g/L,沸点为-183°C,熔点为-218.79°C。
它在常温下是一种双原子分子氧气(O2),并且在地球大气中占比约为21%。
2. 氧元素的化合物氧元素是一种非金属元素,它可以和大多数元素形成化合物,其中最常见的是水(H2O)和二氧化碳(CO2)。
水是生命活动以及地球上广泛应用的一种化合物,二氧化碳则是一种重要的温室气体。
3. 氧元素的氧化性氧元素是一种强氧化剂,它能够和大多数元素形成氧化物,例如金属氧化物、非金属氧化物等。
氧化反应是一种常见的化学反应类型,大多数氧化反应都伴随着释放热量、火焰等现象。
4. 氧元素的生物化学作用氧元素在生物体内起着至关重要的作用,它是细胞呼吸的必需气体,参与了生物体内能量合成的过程。
在人类医学上,氧气能够被用于治疗缺氧相关的疾病,比如高原反应、窒息等。
5. 氧元素的工业应用氧气是一种重要的工业气体,被广泛应用于冶金、化工、医药、环保等领域,如氧气可以作为火焰燃烧的氧化剂,用于金属加工、焊接等工艺;同时也可以制备工业氮气、氢气等气体。
6. 氧元素的环境影响氧元素在大气中的含量和分布对地球环境起着至关重要的作用。
目前,由于工业活动、人类生活以及交通运输等原因,二氧化碳排放过多导致了全球变暖和气候变化等问题,加剧了环境问题。
7. 氧元素的制备氧气可以通过多种方法制备,其中最常见的是通过气化矿物质、水解过氧化氢等。
此外,还可以通过电解水、加热含氧化金属等方法来制备氧气。
总之,氧元素是我们生活中不可或缺的重要元素,它在生物、环境、工业等方面都发挥着至关重要的作用。
因此,了解氧元素的基本性质和化合物、生物作用、工业应用、环境影响等知识点,对于我们深入了解化学知识、保护环境、促进工业发展等都有着重要的意义。
常见金属及其化合物重要化学性质归纳总结

常见金属及其化合物重要化学性质归纳总结〔2021.10.20〕一、金属单质1.与非金属单质反响:〔1〕与Cl2:分别写出Na、Mg、Al、Fe、Cu与Cl2反响的化学方程式:〔2〕与O2:分别写出Na、Mg、Al、Fe、Cu与O2反响的化学方程式:〔3〕与S:分别写出Na、Al、Fe、Cu与S反响的化学方程式:★特殊反响特别记:①Na与O2加热时反响的化学方程式:②Mg与N2反响的化学方程式:③Fe与Br2、I2反响的化学方程式:2.与水反响:分别写出Na、Mg、Fe与水反响的化学方程式:3.与酸反响①与非氧化性酸分别写出Na、Mg、Al、Fe与非氧化性酸〔如盐酸〕反响的离子方程式:②与强氧化性酸:分别写出Al、Fe〔少量、过量〕与稀HNO3反响的离子方程式:分别写出Cu与稀HNO3、浓HNO3、浓硫酸反响的化学方程式:★特殊反响特别记: 常温下,Al、Fe与浓硫酸、浓硝酸发生钝化4.与盐溶液反响:分别写出Na、Mg、Al、Fe与CuSO4溶液反响的离子方程式:★特殊反响特别记:Fe与FeCl3溶液反响的离子方程式:5. 特殊反响①Mg与CO2反响的化学方程式:②Al与Fe2O3反响的化学方程式:③Al与强碱溶液〔如NaOH溶液〕反响的化学方程式:6.金属的冶炼分别写出Na、Mg、Al、Fe的工业冶炼的化学方程式:二、金属氧化物1.与水①分别写出K2O、CaO、Na2O2与水反响的化学方程式:②Al2O3、FeO、Fe2O3、Fe3O4、CuO〔填“能〞或“不能〞〕与水反响直接生成相应的氢氧化物。
2.与酸:分别写出Na2O、MgO、Al2O3、FeO、Fe2O3、Fe3O4、CuO与盐酸反响的离子方程式:★特殊反响特别记:①分别写出Na2O2与水、盐酸、CO2反响的化学方程式:②写出Al2O3溶于NaOH溶液反响的离子方程式:③分别写出FeO溶于稀硝酸,Fe2O3溶于HI酸反响的离子方程式:三、氢氧化物1.与酸性氧化物写出NaOH〔少量、过量〕与CO2、SO2反响的离子方程式:2.与酸分别写出NaOH、Mg〔OH〕2、Al(OH)3、Fe(OH)2、Fe(OH)3、Cu〔OH〕2与盐酸反响的离子方程式3.受热分解NaOH、KOH、Ca(OH)2、Ba(OH)2等受热不易分解,而难溶性碱Mg〔OH〕2、Al(OH)3、Fe(OH)3、Cu〔OH〕2受热易分解,分别写出它们受热分解的化学方程式:★特殊反响特别记:①写出Al(OH)3溶于NaOH溶液的反响离子方程式:②写出Fe(OH)2浊液在空气被氧化的化学方程式:四、重要的盐1.MgCl2、AlCl3、KAl(SO4)2·12H2O、FeCl2、FeCl3、CuCl2的水溶液均呈酸性,原因是〔用离子方程式表示〕它们均能与烧碱溶液〔或氨水〕反响,分别写出离子方程式:★特殊反响特别记:分别写出AlCl3与少量、过量烧碱溶液、过量氨水反响的离子方程式:2. Na2CO3与NaHCO33.NaAlO2①向NaAlO2溶液中逐滴滴加盐酸过程中,反响的离子方程式:②向NaAlO2溶液中通入CO2气体由少量到过量,反响的离子方程式:4.铁盐和亚铁盐写出能实现以下转化的离子方程式:〔1〕Fe2+→Fe3+:①通入氯气:②参加H2O2、稀硫酸:〔2〕Fe3+→Fe2+:①参加铁粉:②参加铜:③淀粉-KI溶液:④参加Na2S溶液:〔3〕氯化铁溶液中滴入KS溶液反响的离子方程式:5.碱式碳酸铜①写出Cu2〔OH〕2CO3溶于稀硫酸反响的离子方程式:②Cu 2〔OH 〕2CO 3受热分解的化学方程式:元素及其重要化合物间的转化关系网络图1.钠及其重要化合物间的转化关系化学方程式或离子方程式自我梳理2化学方程式或离子方程式自我梳理Na 2SNaCl3⑹HCl2Mg⑵HCl⑴O 2或C O 2 ⑶熔融3.铝及其重要化合物间的转化关系化学方程式或离子方程式自我梳理4.铁及其重要化合物间的转化关系Al 2O 3AlAl(OH)3 AlCl 32⑵O 2或Fe 2O 3,高温⑶熔融电解⑷HCl 或Cl 2⑸⑹HCl⑼△⑽NH 3·H 2O 或NaOH⑾HCl⑺NaOH 溶液 FeCl 2 Fe(OH)2⑻氨水或NaOH ⑼HClCuCl 2⑷HCl 或化学方程式或离子方程式自我梳理5.铜及其重要化合物之间的转化关系化学方程式或离子方程式自我梳理Fe 3O 4 3Fe 2O 3⑶O 2+H 2O⑾ΔCu3〕2CuSO 4CuCl 2 CuOCu(OH)2⑺O 2⑹H 2或CO ⒀NaOH ⑾H 2SO 4⒁H 2SO 4⑶Cl 2或FeCl 3⑵Zn 或Fe ⑸浓H 2SO 4⑷Zn 或Fe⑿Δ6.碳、硅及重要化合物间的转化关系化学方程式或离子方程式自我梳理7.氯元素单质及其化合物间的转化关系H 2SiO 3 CaCO 3Ca(HCO3)2 CO 2COC⑹CO 2、H 2O⑸NaOH 或加热⑶Ca(OH)2 ⑴HCl 或高温 ⑵Ca(OH)2⑼ ⑾O 2或⑿CO 2⑻⑽C⑷HCl 或加热⒀Na 2SiO 3 H 2OSiO 2⒁加热 Na 2SiO 3⒂HCl ⒃NaOH⒄NaOHCaSiO 3⒅CaOSi⒇O 2 SiF 4⒆F 2或 HF(21)F 2或 HF⑺Mg2 FeCl化学方程式或离子方程式自我梳理8.硫及其重要化合物间的转化关系化学方程式或离子方程式自我梳理CuCl 2 Br 2I 2⑻KIFeS SO 2 SO 3 H 2SO 4CuSO Na 2SO 3⑻O 2 ⑼H 2O ⒄NaOH⒆O 2⒅H + 4Na 2SO 4 ⒁⑽H 、X 〔X =Cl 、Br 、I 〕 ⑵H 2S FeS 2 ⑺ H 2SO 3 ⒂ ⒃9.氮及其重要化合物的转化关系化学方程式或离子方程式自我梳理NH 3·H 2O NH 3 NH 4ClN 2NONO 2HNO 3Cu(NO 3)2⑵H 2O ⑶22⑻O 2 ⒂Cu⑹HCl⒀C 或Cu ⑺Ca(OH)2 ⒁Cu 或CuO⑷HCl ⑸NaOH ⑾H 2O。
化学元素知识点归纳

化学元素知识点归纳化学元素是构成物质的基本单位,是化学研究的基础。
在化学元素中,有一些常见的元素具有重要的地位和特性。
本文将以这些元素为主题,归纳总结它们的知识点。
一、氧气(O)氧气是地球大气中最常见的元素之一,化学符号为O。
氧气是一种无色、无味、无臭的气体,在自然界中广泛存在。
氧气是生物呼吸和燃烧过程中必需的气体。
在呼吸过程中,氧气与有机物发生氧化反应,产生二氧化碳和水,并释放能量。
二、水(H2O)水是地球上最常见的化合物之一,由氢元素和氧元素组成。
化学式为H2O。
水是一种无色、无味的液体,是地球上生命存在的基础。
水具有很多特性,如溶解性、热容量大、表面张力等。
水也是许多化学反应的重要反应介质。
三、碳(C)碳是生命存在的基础元素之一,化学符号为C。
碳具有四个价电子,可以形成多种化合物。
碳在有机化学中占有重要地位,几乎所有的有机物都含有碳元素。
碳的化合物有很多种类,如烷烃、烯烃、炔烃、醇类、酮类等,它们具有不同的性质和用途。
四、氢(H)氢是宇宙中最简单的元素,化学符号为H。
氢是一种无色、无味、无臭的气体。
氢是一种非常重要的能源,可以通过与氧气反应产生大量的能量。
此外,氢也是许多化学反应的重要原料,如氢氧化反应、氢化反应等。
五、氮(N)氮是地球大气中的主要组成成分之一,化学符号为N。
氮是一种无色、无味、无毒的气体。
氮在生物体内起着重要的作用,是合成蛋白质和核酸的重要组成元素。
氮还可以形成许多重要的化合物,如氨、硝酸等。
六、金(Au)金是一种贵重金属,化学符号为Au。
金是地球上最早被人类发现和使用的金属之一,具有很高的价值和广泛的用途。
金具有良好的延展性和导电性,是制造珠宝和电子器件的重要材料。
金还具有较强的耐腐蚀性,不易与其他物质反应。
七、银(Ag)银是一种贵重金属,化学符号为Ag。
银是一种具有良好导电性和热导性的金属,是制造电子器件和导电材料的重要元素。
银还具有抗菌性能,在医疗器械和消毒剂中有广泛的应用。
初中化学知识点归纳常见化合物的性质和应用的案例分析
初中化学知识点归纳常见化合物的性质和应用的案例分析化合物是由两种或两种以上的不同元素组成的物质,它们具有独特的性质和广泛的应用。
在初中化学学习过程中,我们需要了解一些常见化合物的性质以及它们在现实生活中的应用。
本文将对几种常见的化合物进行归纳,同时提供相应的应用案例分析。
一、酸和碱酸和碱是我们非常熟悉的化合物,它们具有不同的性质和反应。
酸味酸性物质,可以腐蚀金属和灼烧皮肤,而碱则具有碱性,有一定的腥味。
酸和碱的中和反应可以生成盐和水,并伴随着放热现象。
例子1:氢氧化钠氢氧化钠是一种常见的碱性化合物,具有强烈的腥味和腐蚀性。
它广泛应用于肥皂、洗涤剂和玻璃制造等行业。
例如,在肥皂制造过程中,氢氧化钠可以与动植物油脂发生皂化反应,生成肥皂。
例子2:盐酸盐酸是一种强酸,具有刺激性气味和腐蚀性。
它常用于实验室中的酸碱中和反应,并广泛应用于金属清洗、水处理和制备含氯化合物等工业领域。
二、氧化物氧化物是由金属和氧元素组成的化合物,具有多样的性质和应用。
某些金属氧化物可以作为催化剂,某些氧化物是重要的矿石。
例子3:二氧化碳二氧化碳是由碳和氧元素组成的氧化物,无色、无味并具有稳定性。
它是生物体呼吸产生的一种废气,广泛应用于饮料制造、消防灭火和植物光合作用等领域。
例子4:二氧化硅二氧化硅是一种重要的无机化合物,由硅和氧元素组成。
它具有很高的熔点和化学稳定性,广泛应用于玻璃制造、建筑材料和电子工业等领域。
三、盐类盐类是由阳离子和阴离子组成的化合物,它们通常是在酸碱反应中生成的。
例子5:氯化钠氯化钠是一种常见的盐类化合物,由钠和氯离子组成。
它是我们平日里使用的食盐,也被广泛应用于食品加工和农业领域。
例子6:硝酸铜硝酸铜是由铜和硝酸根离子组成的盐类化合物。
它具有蓝色的结晶外观,被广泛应用于陶瓷制造和绘画领域。
综上所述,化合物具有不同的性质和应用,它们是我们日常生活中不可或缺的一部分。
通过对常见化合物的性质和应用的案例分析,我们不仅可以加深对化学知识的理解,还能更好地认识到化学在现实生活中的重要性。
高中化学常见的元素及其化合物性质与转化思维导图
常见元素及其化合物性质与转化一、典型元素及其化合物的转化关系
1.氯气及其化合物间的转化关系
2.硫及其化合物间的转化关系
3.氮气及其化合物间的转化关系
4.钠及其化合物间的转化关系5.铝及其化合物间的转化关系6.铁及其化合物间的转化关系
、典型非金属单质的化学性质
、典型非金属氧化物性质
四、典型金属氧化物性质
五、典型金属氢氧化物性质
六、物质的特殊转化关系1.交叉型转化
2.三角型转化
七、特征反应
通电
2NaCl +2H2O 2NaOH+Cl2↑+H2↑
通电
2CuSO4 +2H2O 2Cu+O2↑+2H2SO4
通电
4AgNO 3 +2H2O 4Ag+O2↑+4HNO3
少量单质乙过量单质乙
少量O2过量O2 CO 2 C 2CO2
少量Fe 过量Fe
在溶液中:FeCl3Cl2FeCl2 ( FeBr3 Br2 FeBr2 )
化合物B 少量单质乙
单质甲化合物
A
少量O2过量O2
Na2O 2 Na 2Na2O2型的反应:
电解生成三种物质的反应。
高中化学非金属元素及其重要化合物性质大汇合
高中化学非金属元素及其重要化合物性质一、氯及其重要化合物1、氯气的性质及用途、①物理性质:常温下,氯气是黄绿色、有刺激性、能溶于水、比空气重、易液化的有毒气体。
②化学性质:氯气的化学性质很活泼的非金属单质。
〔1〕与金属反响〔与变价金属反响,均是金属氧化成高价态〕<1> 2Na+Cl2△2NaCl〔产生白烟〕<2>Cu+Cl2△CuCl2〔产生棕黄色的烟〕<3>2Fe+3Cl2△2FeCl3〔产生棕色的烟〕注:常温下枯燥的氯气或液氯不与铁反响,所以液氯通常储存在钢瓶中。
〔2〕与非金属反响<1>H2+Cl2△2HCl〔发出苍白色火焰,有白雾生成〕——可用于工业制盐酸<2>H2+Cl2光照或点燃2HCl〔会发生爆炸〕——不可用于工业制盐酸<3>2P+3Cl2△2PCl3〔氯气缺乏;产生白雾〕<4>2P+5Cl2△2PCl5〔氯气充足;产生白烟〕注:磷在氯气中燃烧产生大量白色烟雾。
〔3〕与水反响:Cl2+H2O = HCl+HClO〔4〕与碱反响<1>Cl2+2NaOH = NaCl+NaClO+H2O〔用于除去多余的氯气〕<2>2Cl2+2Ca(OH)2 = Ca(ClO)2+CaCl2+2H2O〔用于制漂粉精〕<3>Ca(ClO)2+CO2+H2O = CaCO3↓+2HClO〔漂粉精的漂白原理〕注意:1假设CO2过量则生成Ca(HCO3)2。
2假设向Ca(ClO)2溶液入SO2气体,不能生成CaSO3,因能被HClO氧化。
〔5〕与*些复原性物质反响<1>2FeCl2+Cl2 = 2FeCl3<2>2KI+Cl2 = 2KCl + I2〔使湿润的淀粉-KI试纸变蓝色,用于氯气的检验〕<3>SO2+*2+2H2O = 2HCl + H2SO4〔*=Cl、Br、I〕3、氯水的成分及性质氯气溶于水得黄绿色的溶液——氯水。
化学元素周期表性质
化学元素周期表性质work Information Technology Company.2020YEAR化学元素周期表性质1元素周期表中元素及其化合物的递变性规律1.1原子半径(1)除第1周期外,其他周期元素(惰性气体元素除外)的原子半径随原子序数的递增而减小;(2)同一族的元素从上到下,随电子层数增多,原子半径增大。
1.2元素化合价(1)除第1周期外,同周期从左到右,元素最高正价由碱金属+1递增到+7,非金属元素负价由碳族-4递增到-1(氟无正价,氧无+6价,除外);(2)同一主族的元素的最高正价、负价均相同1.3单质的熔点(1)同一周期元素随原子序数的递增,元素组成的金属单质的熔点递增,非金属单质的熔点递减;(2)同一族元素从上到下,元素组成的金属单质的熔点递减,非金属单质的熔点递增1.4元素的金属性与非金属性(1)同一周期的元素从左到右金属性递减,非金属性递增;(2)同一主族元素从上到下金属性递增,非金属性递减。
1.5最高价氧化物和水化物的酸碱性元素的金属性越强,其最高价氧化物的水化物的碱性越强;元素的非金属性越强,最高价氧化物的水化物的酸性越强。
1.6非金属气态氢化物元素非金属性越强,气态氢化物越稳定。
同周期非金属元素的非金属性越强,其气态氢化物水溶液一般酸性越强;同主族非金属元素的非金属性越强,其气态氢化物水溶液的酸性越弱。
1.7单质的氧化性、还原性一般元素的金属性越强,其单质的还原性越强,其氧化物的氧离子氧化性越弱;元素的非金属性越强,其单质的氧化性越强,其简单阴离子的还原性越弱。
2.推断元素位置的规律判断元素在周期表中位置应牢记的规律:(1)元素周期数等于核外电子层数;(2)主族元素的序数等于最外层电子数;(3)确定族数应先确定是主族还是副族,其方法是采用原子序数逐步减去各周期的元素种数,即可由最后的差数来确定。
最后的差数就是族序数,差为8、9、10时为VIII族,差数大于10时,则再减去10,最后结果为族序数。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
元素化合物的化学性质归纳编写:陈应护一、钠的化学性质1、与O2反应:常温:____________________________________ (_______色固体);点燃或加热:____________________________________ (_______色固体);2、与Cl2反应:____________________________________;3、与水反应:____________________________________4、与酸反应:非常剧烈,以致爆炸;____________________________________5、与盐溶液反应:可认为是先与盐溶液中的水反应,然后再发生复分解反应(其实质都是先于溶液中的H+反应)。
________________________________________________________________________二、Cl2的化学性质1、与金属反应____________________________________(白烟);____________________________________ (棕黄色烟,加少量水显绿色,冲稀后变蓝色);____________________________________ (棕红色烟,加少量水显棕黄色)2、与非金属反应____________________________________ (白雾)。
纯净的H2可在Cl2中燃烧,发出苍白色火焰。
HCl (溶解度1∶500)溶于水成为盐酸.3、与水反应:____________________________________4、与碱反应:____________________________________(该反应可用于Cl2的尾气处理);工业上用Cl2与石灰乳作用制漂白粉:____________________________________5、与盐溶液的置换反应:____________________________________(该反应常用作Cl2的检验);____________________________________氯水的成分和性质(1)氯水的成分氯水是氯气的水溶液,通常情况下为浅黄色溶液,氯水中只有部分Cl2与水反应,其化学方程式为:____________________________________新制的氯水中含___________________________等分子和________________________等离子。
(2)氯水的性质氯水的性质比较复杂,有可能存在多种成分同时作用于一种物质.在一般情况下,认为是溶液中氯分子的性质。
若为盐酸或次氯酸的性质,主要有下面几种情况:①作为盐酸的性质:当与弱酸的盐或硝酸银溶液作用时,主要作为盐酸性质,例如:氯水与Na2CO3溶液反应以及氯水与AgNO3溶液反应。
②作为次氯酸的性质:氯水用于漂白(与有机化合物色素作用)、消毒、杀菌等。
③要注意液氯与氯水的区别:液氯是纯净物,成分是Cl2分子,而氯水是混合物。
三、碳酸钠和碳酸氢钠的比较Na2CO3和NaHCO3在一定条件下的相互转化:溶液中:____________________________________,____________________________________固体中:____________________________________,____________________________________四、氨和铵盐1、氨的化学性质:①碱性:氨与水、酸反应时显碱性与水反应:____________________________________与酸反应:____________________________________说明:a氨溶于水,大部分与水结合成一水合氨(NH3·H2O),一水合氨少部分电离,因此,氨水显弱碱性。
氨气是中学阶段唯一的一种碱性气体,利用这一点,可以检验NH3。
b NH3与其它酸也能反应生成相应的铵盐。
其中,NH3与盐酸这样的易挥发性酸反应时会有白烟(铵盐固体的小颗粒)生成。
利用这个现象,在某些场合也可以检验NH3。
②还原性:氨的催化氧化反应____________________________________说明:a 该反应是工业上生产硝酸的一个基础反应。
b NH3中的氮元素的价态为-3价,因此,NH3不仅能被催化氧化生成NO,在纯氧中燃烧能生成N2。
在一定条件下,NH3还能被Cl2、CuO等氧化。
____________________________________ 2.铵盐铵盐具有以下性质:(1)铵盐受热分解____________________________________;____________________________________(2)铵盐与碱反应____________________________________ ;____________________________________(3)氨的实验室制取药品:____________________________________反应原理:____________________________________装置:与制氧气相同收集:______________________验满:____________________________________。
防止多余氨气污染空气的方法:____________________________________。
干燥:NH3通过盛有____________________________________。
实验室制取氨的其它方法:__________________________、_____________________________等。
五.硝酸1、硝酸的不稳定性:硝酸见光或受热易分解。
____________________________________说明:硝酸越浓,越容易分解。
长期存放的浓HNO3呈黄色,这是由于HNO3分解产生的NO2溶于硝酸的缘故。
也正因为硝酸见光或受热易分解,一般将它保存在_____________瓶里,放置在阴凉处。
2.硝酸的强氧化性:硝酸具有强的氧化性,是因为硝酸分子里氮呈+5价。
(1)与金属反应:HNO3几乎能与所有的金属(除金、铂、钛以外)发生氧化还原反应。
浓____________________________________稀____________________________________说明:硝酸与不活泼金属反应时,浓硝酸生成NO2,稀硝酸生成NO。
3、与非金属反应:硝酸能与许多非金属及某些有机物发生氧化还原反应:____________________________________六.硫的化学性质:1、与金属发生反应:_________________________________ ________________________________(S表现氧化性)2、与非金属发生反应____________________________________(S表现还原性)3、与氧化性酸浓HNO3、浓H2SO4发生反应____________________________________(S表现还原性)____________________________________(S表现还原性)七、SO2的化学性质1、二氧化硫是酸性氧化物,具有酸性氧化物的一切通性:____________________________________;____________________________________;____________________________________;____________________________________;SO2+2NH3·H2O=___________________;____________________________________(吸收SO2)____________________________________ (酸性:H2SO3>H2S);____________________________________ (酸性:H2SO3>H2CO3);2、氧化性:____________________________________(气体或溶液中均可进行)3、还原性:能被Cl2、Br2、I2、Fe3+、KMnO4、HNO3等强氧化剂氧化生成SO42-。
例如:____________________________________ (X=Cl、Br、I)4、漂白性:SO2可以使________________溶液褪色。
注意,SO2能使氯水、KMnO4溶液等褪色,这是因为SO2具有______________性的缘故。
八.浓硫酸的强氧化性:浓硫酸是强氧化性酸,可以氧化大多数金属(除Pt和Au)和其他还原性物质(H2S、Fe2+等)。
____________________________________ (__________性、_________性)____________________________________ (氧化性)2FeSO4+2H2SO4(浓)=____________________________________ (_____________性)H2S+H2SO4(浓)=____________________________________ (___________性)九. 海水提镁的方法1、海水提镁的3个环节:①碱的制取——贝壳高温分解产生CaO,再与水反应得碱。
②Mg2+的浓缩——海水加碱,得氢氧化镁沉淀,将沉淀分离出来,再加盐酸,得到浓的MgCl2溶液。
③Mg的制取——MgCl2溶液经过蒸发、浓缩、干燥,得到MgCl2固体,电解熔融的MgCl2得到Mg。
2、相关化学(或离子)方程式:①____________________________________;____________________________________②____________________________________;____________________________________③____________________________________3、化学性质①与非金属单质反应_________________________ _________________________ _______________________②与酸反应与镁与非氧化性酸,如稀硫酸、盐酸等反应生成氢气:____________________________________ 与镁与氧化性酸,如浓硫酸、硝酸等反应,但不生成氢气:____________________________________③与某些氧化物反应:____________________________________十、硅的化学性质:①在常温下,硅的化学性质不活泼,不与O2、Cl2、H2SO4、HNO3等发生反应,但能与F2、HF和强碱反应。
