化学药品临床试验资料综述(doc 31页)
2.5临床试验综述

2.5临床试验综述
2.5 临床试验综述
目录页码
1. 产品开发原理
2. 生物药剂学综述
2a. 研究中产品的生物等效性研究
3. 临床药理学综述
3a. 药代动力学
3a1. 吸收
3a2. 分布
3a3. 代谢与排泄
3a4. 年龄与疾病的作用
3b. 药效学
3b1. 对中枢神经递质系统的作用
3b2. 神经内分泌效应
3b3. 血液动力学效应
4. 疗效综述
4a . 用于治疗精神分裂症申请的适应症4a1. 非对照试验4a2. 与安慰剂对比
4a3. 与其它抗精神病药物对比
4a4. 利培酮治疗顽固性精神分裂症
4a5. 对精神病患者情感症状的作用
4b. 对痴呆患者的行为和心理学症状的治疗4b1. 量表4b2. 非对照与回顾性试验
4b3. 对照临床试验
4b4. 长期治疗
4c. 利培酮治疗儿童和老年精神病患者
5. 安全性综述
5a. 耐受性
5a1. 锥体外系症状
5a2. 心血管效应
5a3. 其它作用
5a4. 体重增加
5b. 药物相互作用
5c. 药物过量
6. 利益与风险结论
6a. 适应症、剂量与给药7.参考文献模块2.7 临床研究概述。
临床试验申请IND药物化学

(2)Ⅱ期临床试验
治疗作用初步评价阶段。 要求:盲法对照试验; 病例:≥100例。
(3)Ⅲ期临床试验
治疗作用确证阶段。 要求:盲法对照和开放试验; 病例:试验组≥300例。
(4)Ⅳ期临床试验
新药上市后由申请人自主进行的应用研究阶段。其 目的是考察在广泛的使用条件下的药物的疗效和不 良反应;评价在普通或者特殊人群中使用的利益与 风险关系,改进给药剂量等
BIOTECHNOLOGY
药品注册培训 许伟明 2012.08
问题
一、是否熟悉或者基本熟悉药品注册管理法律 、法规和药品注册的技术要求?
问题
二,知道或者基本知道对每一项申报资料的技 术要求和药审中心对每项申报资料审评的关注 重点在哪里?
问题
三、有木有以各种方式同药审中心沟通过,比 如电话咨询,预约沟通,参加新药评审会议等 ?
四、新药的临床研究
药物临床研究必须经SFDA批准后实施。 药物临床研究包括临床试验和生物等效性试验。 临床研究必须执行《药物临床试验质量管理规范》
(GCP)。
(一)临床试验的分期及最低病例数要求
临床试验分为Ⅰ、Ⅱ、Ⅲ、Ⅳ期。
(1)Ⅰ期临床试验
初步的临床药理学及人体安全性评价试验。观察人体对 于新药的耐受程度和药物代谢动力学,为制定给药方案 提供依据。
要求:开放试验; 病例:≥2000例
2、生物等效性试验:
与已生产对照药品的生物利用度比较试验。 要求:盲法或开放试验;病例:18-24例
(二)药物临床试验的质量管理
药物临床试验场所 申请人应从具有药物临床试验资格的机构中选
择进行临床试验 临床研究用药制备和使用管理
药品申报材料格式

药品申报材料格式【篇一:化学药品申报资料撰写格式与要求】化学药品申报资料撰写格式与要求技术指导原则一药理毒理研究资料综述撰写格式和要求(第一稿)二oo四年十月一、概述?????????????????二、撰写格式和要求???????????(一)前言?????????????????(二)药理毒理研究总结???????????1、药效学试验资料及文献资料???????2、毒理学试验资料及文献资料???????3、药代动力学试验及文献资料???????(三)对药理毒理研究的分析和评价1、研究项目选择的法规和科学依据??????2、药物的有效性?????????????3、药物的安全性?????????????4、综合评价???????????????(四)参考文献???????????????三、参考文献???????????????四、起草说明???????????????一、概述本指导原则是“化学药品申报资料的撰写格式和要求”系列技术指导原则中的一部分,内容为新药注册申报资料中药理毒理研究资料综述(申报资料项目16)的撰写格式和要求。
本指导原则意在通过规范药理毒理研究资料综述的撰写,提高药理毒理申报资料的质量;引导药品注册申请人对新药进行综合分析和自我评价,进而提高注册效率,规范新药研究。
不同注册分类的药物药理毒理研究资料综述的撰写可能与本文的要求不完全吻合,注册申请人可根据药物的特点在本文的基础上做适当调整。
药理毒理研究资料综述的内容分为前言、药理毒理研究总结、对研究的分析和评价、参考文献四部分。
二、撰写格式和要求(一)前言前言主要介绍药物开发的背景,应包括以下内容:●简述药物的结构特点和理化性质。
●明确药物临床拟用适应症,简述疾病的发病机制、临床症状、病程、转归,以及现有药物的治疗概况。
●阐明药物可能的作用机制、药物本身或同类药物在国内外的研究开发进展、明确提出立题依据。
●目前已知的药物本身或同类药物在动物试验和临床使用中存在的主要安全性和有效性问题。
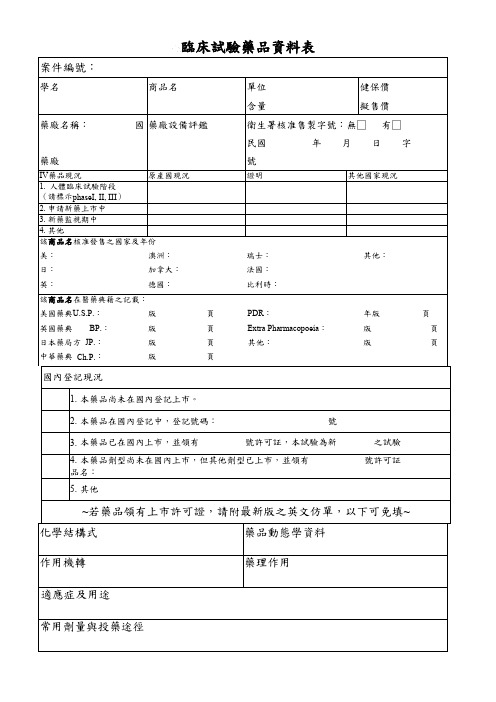
临床试验药品资料表
日:
加拿大:
英:
德國:
該商品名在醫藥典籍之記載:
美國藥典U.S.P.:
版
頁
英國藥典 BP.:
版
頁
日本藥局方 JP.:
版
頁
中華藥典 Ch.P.:
版
頁
號
證明
其他國家現況
瑞士: 法國: 比利時:
PDR: Extra Pharmacopoeia: 其他:
其他:
年版 版 版
頁 頁 頁
國內登記現況
1. 本藥品尚未在國內登記上市。
臨床試驗藥品資料表
案件編號:
學名
商品名
單位
健保價
含量
擬售價
藥廠名稱:
國 藥廠設備評鑑
衛生署核准售製字號:無□ 有□
民國年月日字藥廠源自IV藥品現況原產國現況
1. 人體臨床試驗階段
(請標示phaseI, II, III)
2. 申請新藥上市中
3. 新藥監視期中
4. 其他
該商品名核准發售之國家及年份
美:
澳洲:
不良反應報告 禁忌與注意事項(安全性評估) 國內已使用之醫院 國內其他臨床試驗進行地點
2. 本藥品在國內登記中,登記號碼:
號
3. 本藥品已在國內上市,並領有
號許可証,本試驗為新
4. 本藥品劑型尚未在國內上市,但其他劑型已上市,並領有 品名:
5. 其他
之試驗 號許可証
~若藥品領有上市許可證,請附最新版之英文仿單,以下可免填~
化學結構式
藥品動態學資料
作用機轉
藥理作用
適應症及用途
常用劑量與投藥途徑
化学药品注册分类和申报资料要求专业知识培训

化学药物旳注册分类
❖ 注册分类1-5品种为新药 ❖ 注册分类6为已经有国家原则旳药品
执行。 6、文件资料为所申请药物旳各项药理毒理(涉及药效
学、作用机制、一般药理学、 毒理学、药代动力学等)研 究旳文件资料和/或其文件综述资料。
说明
❖ 1、注册分类1~5旳品种为新药,注册分类6 旳品种为已经有国家原则旳药品。对监测期 内旳新药,如生产工艺确有重大改进,经国 家食品药品监督管理局批准后,仍可按照该 新药原注册分类申报。
三、申报资料项目阐明
❖ 7、资料项目8原料药生产工艺旳研究资料: ❖ 涉及工艺流程和化学反应式、 ❖ 起始原料和有机溶媒、反应条件(温度、压
力、时间、催化剂等)和操作环节、精制措 施、主要理化常数及阶段性旳数据积累成果 等, ❖ 注明投料量和收得率以及工艺过程中可能产 生或引入旳杂质或其他中间产物
❖ 根据注册分类旳不同报送不同旳研究资料,详细情况见《申 报资料项目表》
❖ 注:1、“+”:指必须报送旳资料和/或试验资料。 2、“±”:指能够用文件资料替代试验资料。 3、“-”:指能够无需提供旳资料。 4、“* ”:按照阐明旳要求报送资料,如?8,指见阐
明之第8条。 5、“△”:按照本附件“五、临床试验要求”中第4条
❖ 属于注册分类1.6旳,不单独予以监测期。
注册分类2、变化给药途径且还未在国内外上 市销售旳制剂。
❖ 原剂型已在国外或者已在国内上市,变化给 药途径后旳剂型还未在国内外上市
临床试验数据总结报告

临床试验数据总结报告一、引言临床试验是评估新医疗产品或治疗方法安全性和疗效的重要手段。
为了全面准确地总结临床试验数据,本报告对相关数据进行了分析和整理,以便为后续的临床决策提供参考。
二、试验背景(这部分根据具体情况进行描述)三、试验设计(这部分根据具体情况进行描述)四、受试者信息在本次试验中,共招募了xxx名受试者,其中包括男性和女性。
受试者的年龄范围为xx岁至xx岁,他们来自不同的地区和社会背景。
受试者的选择遵循xx原则,在签署知情同意书后,进行个体基本信息的收集,包括性别、年龄、病史等。
五、数据收集与分析1. 数据收集在试验进行过程中,严格按照试验方案执行,对受试者的数据进行收集。
数据收集包括但不限于临床检查、实验室检验、问卷调查等。
所有数据均通过统一的表格和系统进行输入和存储,以确保数据的准确性和安全性。
2. 数据清理与验证收集到的数据经过初步清理后,进行详细的验证。
验证包括逻辑性验证、范围验证、异常值验证等。
同时,对数据进行质控和质量管理,确保数据的可靠性和准确性。
3. 数据分析根据试验设计和目的,对收集到的数据进行统计学分析。
采用适当的分析方法,包括描述性统计和推断性统计,对数据进行整合、比较和归纳。
六、数据结果根据数据分析的结果,得到以下结论:1. 效果评估:根据药物使用或治疗方法,对受试者的临床疗效进行评估。
具体包括临床症状的改善程度、疾病风险的减少等。
2. 安全性评估:对药物或治疗方法的安全性进行评估,包括不良反应的发生率、严重程度等。
3. 副作用分析:对试验中出现的副作用进行统计和分析,研究其发生原因、频率等。
七、讨论根据数据结果,对试验结果进行讨论和解释。
结合其他相关研究和文献,分析试验结果的在临床实践中的意义,并对可能出现的问题和局限性进行探讨。
八、结论综合以上分析和讨论,得出以下结论:1. 对于本次试验,药物或治疗方法具备良好的临床疗效,能帮助患者达到特定的治疗目标。
2. 药物或治疗方法的安全性较高,不良反应发生率较低,并且一般为轻度或可接受的副作用。
总局关于发布化学药品新注册分类申报资料要求(试行)的通告(2016年第80号)
总局关于发布化学药品新注册分类申报资料要求(试⾏)的通告(2016年第80号)附件化学药品新注册分类申报资料要求(试⾏)第⼀部分注册分类1、2、3、5.1类申报资料要求(试⾏)⼀、申报资料项⽬(⼀)概要1.药品名称。
2.证明性⽂件。
2.1注册分类1、2、3类证明性⽂件2.2注册分类5.1类证明性⽂件3.⽴题⽬的与依据。
4.⾃评估报告。
5.上市许可⼈信息。
6.原研药品信息。
7.药品说明书、起草说明及相关参考⽂献。
8. 包装、标签设计样稿。
(⼆)主要研究信息汇总表9. 药学研究信息汇总表。
10. ⾮临床研究信息汇总表。
11. 临床研究信息汇总表。
(三)药学研究资料12. (3.2.S)原料药(注:括号内为CTD格式的编号,以下同)。
12.1(3.2.S.1)基本信息12.2(3.2.S.2 )⽣产信息12.3(3.2.S.3 )特性鉴定12.4(3.2.S.4)原料药的质量控制12.5(3.2.S.5)对照品12.6(3.2.S.6)包装材料和容器12.7(3.2.S.7)稳定性13. (3.2.P)制剂。
13.1(3.2.P.1)剂型及产品组成13.2(3.2.P.2)产品开发13.3(3.2.P.3)⽣产13.4(3.2.P.4)原辅料的控制13.5(3.2.P.5)制剂的质量控制13.6(3.2.P.6)对照品13.7(3.2.P.7)稳定性(四)⾮临床研究资料14.⾮临床研究资料综述。
15.主要药效学试验资料及⽂献资料。
16.安全药理学的试验资料及⽂献资料。
17.单次给药毒性试验资料及⽂献资料。
18.重复给药毒性试验资料及⽂献资料。
19.遗传毒性试验资料及⽂献资料。
20.⽣殖毒性试验资料及⽂献资料。
21.致癌试验资料及⽂献资料。
22.依赖性试验资料及⽂献资料。
23.过敏性(局部、全⾝和光敏毒性)、溶⾎性和局部(⾎管、⽪肤、粘膜、肌⾁等)刺激性等特殊安全性试验资料及⽂献资料。
24.其他安全性试验资料及⽂献资料。
2016年第80号~化学药品新注册分类申报资料要求(试行).doc
附件化学药品新注册分类申报资料要求(试行)第一部分注册分类1、2、3、5.1类申报资料要求(试行)一、申报资料项目(一)概要1.药品名称。
2.证明性文件。
2.1注册分类1、2、3类证明性文件2.2注册分类5.1类证明性文件3.立题目的与依据。
4.自评估报告。
5.上市许可人信息。
6.原研药品信息。
7.药品说明书、起草说明及相关参考文献。
8. 包装、标签设计样稿。
(二)主要研究信息汇总表9. 药学研究信息汇总表。
10. 非临床研究信息汇总表。
11. 临床研究信息汇总表。
(三)药学研究资料12. (3.2.S)原料药(注:括号内为CTD格式的编号,以下同)。
12.1(3.2.S.1)基本信息12.2(3.2.S.2 )生产信息12.3(3.2.S.3 )特性鉴定12.4(3.2.S.4)原料药的质量控制12.5(3.2.S.5)对照品12.6(3.2.S.6)包装材料和容器12.7(3.2.S.7)稳定性13. (3.2.P)制剂。
13.1(3.2.P.1)剂型及产品组成13.2(3.2.P.2)产品开发13.3(3.2.P.3)生产13.4(3.2.P.4)原辅料的控制13.5(3.2.P.5)制剂的质量控制13.6(3.2.P.6)对照品13.7(3.2.P.7)稳定性(四)非临床研究资料14.非临床研究资料综述。
15.主要药效学试验资料及文献资料。
16.安全药理学的试验资料及文献资料。
17.单次给药毒性试验资料及文献资料。
18.重复给药毒性试验资料及文献资料。
19.遗传毒性试验资料及文献资料。
20.生殖毒性试验资料及文献资料。
21.致癌试验资料及文献资料。
22.依赖性试验资料及文献资料。
23.过敏性(局部、全身和光敏毒性)、溶血性和局部(血管、皮肤、粘膜、肌肉等)刺激性等特殊安全性试验资料及文献资料。
24.其他安全性试验资料及文献资料。
25.非临床药代动力学试验资料及文献资料。
26.复方制剂中多种成分药效、毒性、药代动力学相互影响的试验资料及文献资料。
化学药品注册分类与申报资料要求(doc 14页)
化学药品注册分类与申报资料要求(doc 14页)化学药品注册分类及申报资料要求(药品注册管理办法附件2;国家食品药品监督管理局令第28号公布,自2007年10月1日起施行)一、注册分类1.未在国内外上市销售的药品:(1)通过合成或者半合成的方法制得的原料药及其制剂;(2)天然物质中提取或者通过发酵提取的新的有效单体及其制剂;(3)用拆分或者合成等方法制得的已知药物中的光学异构体及其制剂;(4)由已上市销售的多组份药物制备为较少组份的药物;(5)新的复方制剂;(6)已在国内上市销售的制剂增加国内外均未批准的新适应症。
2.改变给药途径且尚未在国内外上市销售的制剂。
3.已在国外上市销售但尚未在国内上市销售的药品:(1)已在国外上市销售的制剂及其原料药,和/或改变该制剂的剂型,但不改变给药途径的制剂;(2)已在国外上市销售的复方制剂,和/或改变该制剂的剂型,但不改变给药途径的制剂;(3)改变给药途径并已在国外上市销售的制剂;(4)国内上市销售的制剂增加已在国外批准的新适应症。
4.改变已上市销售盐类药物的酸根、碱基(或者金属元素),但不改变其药理作用的原料药及其制剂。
5.改变国内已上市销售药品的剂型,但不改变给药途径的制剂。
6.已有国家药品标准的原料药或者制剂。
二、申报资料项目(一)综述资料1.药品名称。
2.证明性文件。
3.立题目的与依据。
4.对主要研究结果的总结及评价。
29.临床试验计划及研究方案。
30.临床研究者手册。
31.知情同意书样稿、伦理委员会批准件。
32.临床试验报告。
三、申报资料项目说明1.资料项目1药品名称:包括通用名、化学名、英文名、汉语拼音,并注明其化学结构式、分子量、分子式等。
新制定的名称,应当说明命名依据。
2.资料项目2证明性文件:(1)申请人机构合法登记证明文件(营业执照等)、《药品生产许可证》及变更记录页、《药品生产质量管理规范》认证证书复印件,申请生产时应当提供样品制备车间的《药品生产质量管理规范》认证证书复印件;(2)申请的药物或者使用的处方、工艺、用途等专利情况及其权属状态说明,以及对他人的专利不构成侵权的声明;(3)麻醉药品、精神药品和放射性药品需提供研制立项批复文件复印件;(4)完成临床试验后申报生产时应当提供《药物临床试验批件》复印件及临床试验用药的质量标准;(5)申请制剂的,应提供原料药的合法来源证明文件,包括原料药的批准证明文件、药品标准、检验报告、原料药生产企业的营业执照、《药品生产许可证》、《药品生产质量管理规范》认证证书、销售发票、供货协议等的复印件;(6)直接接触药品的包装材料和容器的《药品包装材料和容器注册证》或者《进口包装材料和容器注册证》复印件。
临床试验数据报告
临床试验数据报告为了评估一种新型药物的疗效和安全性,我们进行了一项临床试验。
本报告旨在准确地呈现试验数据,并详细展示所得结果。
1. 背景简介在开展临床试验之前,我们首先介绍了试验背景和目的。
本次试验旨在评估新药物对某种疾病的治疗效果,并确保其安全性。
我们对试验样本进行了严格的筛选,并得到了符合条件的参与者。
2. 试验方案为了保证试验的科学性和可靠性,我们制定了严谨的试验方案。
试验样本被随机分为两组:治疗组和对照组。
治疗组接受新药物的治疗,而对照组接受安慰剂。
试验采用双盲的方式,既保护了试验对象的隐私,也减少了主观因素的影响。
3. 数据收集与分析在试验进行期间,我们仔细记录了参与者的基本信息、疾病症状、药物剂量和使用过程中的不良反应等数据。
所有数据都经过严格的比对和核实,确保其准确性和完整性。
在数据分析阶段,我们运用了多种统计学方法对试验结果进行了分析。
这些方法包括描述性统计、方差分析、生存分析等。
通过这些分析,我们得到了药物的疗效评估指标、安全性评估指标以及与对照组的比较结果。
4. 实验结果根据数据分析得出的结果,我们得到了如下结论:4.1 疗效评估指标新药物在治疗组中表现出显著的疗效。
与对照组相比,治疗组在症状减轻、复发率降低等方面取得了显著的优势。
4.2 安全性评估指标新药物在安全性方面的表现也较为良好。
在治疗组中,不良反应的发生率较低,并且没有出现严重的不良反应。
4.3 与对照组的比较与对照组相比,治疗组在各项指标上均有显著的改善。
这进一步证实了新药物在治疗目标疾病上的疗效和安全性。
5. 结论与讨论经过对试验结果的分析和评估,我们得出了如下结论:新药物在治疗目标疾病上表现出了显著的疗效和良好的安全性。
这为患者提供了一种新的治疗选择,对于改善疾病的预后具有积极的意义。
然而,值得注意的是,本次临床试验还存在一些局限性。
例如,样本大小相对较小,试验时间较短等。
我们鼓励后续研究对这些问题进行更深入的探索和分析。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
化学药品临床试验资料综述(doc 31页)化学药品申报资料撰写格式与内容技术指导原则——临床试验资料综述撰写格式和内容(第二稿草稿)二OO 五年三月1目录一、概述 (3)二、临床试验资料综述撰写的格式与内容 (4)(一)临床文献与试验总结 (4)1、临床文献总结 (4)2、临床试验总结 (5)2.1 生物药剂学研究总结 (5)2.2 临床药理学研究总结 (5)2.3 临床有效性总结 (6)2.3.1 受试人群 (7)2.3.2 有效性研究结果及比较 (7)2.3.3 不同受试人群间结果比较 (7)2.3.4 与推荐剂量相关的临床信息 (8)2.3.5 长期疗效与耐受性问题 (8)2.4 临床安全性总结 (8)2.4.1 用药/暴露情况 (8)2.4.2 不良事件 (9)2.4.3 实验室检查指标评价 (11)22.4.4 与安全性相关的症状体征和其他发现.......................112.4.5 特殊人群的安全性 (12)2.4.6 上市后数据 (12)2.5 生物等效性研究总结 (13)(二)临床试验总体评价 (13)1、立题分析 (13)2、生物药剂学总体评价 (14)3、临床药理学总体评价 (14)4、有效性总体评价 (14)5、安全性总体评价 (15)6、获益与风险评估 (16)三、名词解释 (17)四、参考文献 (18)五、起草说明 (19)六、著者 (21)3一、概述按照《药品注册管理办法》(试行)附件二的要求,化学药品申报注册时应提供的第28 项申报资料为“国内外相关的临床试验资料综述”。
该综述由注册申请人撰写。
为指导和规范注册申请人撰写该综述,现参考国际协调会议(ICH)申报资料中通用技术文件(CTD)临床部分的相关技术要求,在充分考虑国内药品注册现状的基础上,制定“临床试验资料综述撰写的格式与内容”指导原则(以下简称本指导原则),其内容和形式与“化学药品申报资料的撰写格式和要求”系列指导原则中“对主要研究结果的总结及评价撰写格式和要求”指导原则和“临床试验报告的撰写的格式与内容”指导原则相衔接。
临床试验资料综述,是药品注册所必需的临床信息总结与评价,包括临床试验与文献总结和临床试验总体评价两部分。
临床试验与文献总结,是指与研究药物有关的临床试验与文献信息的详尽的事实性总结。
根据国内注册实际,将临床试验与文献总结同:申报临床时,应提供临床试验文献总结和临床试验总体评价;申报生产时,除提供临床试验文献总结和临床试验总体评价外,还应提供研究药物的临床试验总结。
注册申请人应以科学、严谨、求是的精神撰写该综述,提供完善的临床信息总结和评价,充分体现出药物研发的系统性特征,内容衔接应有逻辑性,思路应清晰,文字应简洁。
二、临床试验资料综述撰写的格式与内容(一)临床文献与试验总结临床文献总结和临床试验总结,均采用下述框架和逻辑顺序撰写:生物药剂学研究总结临床药理学研究总结临床有效性总结临床安全性总结研究报告列表与文献另外,本资料的撰写应为临床试验方案及说明书内容提供相应的依据。
1、临床文献总结本部分为依据文献资料(国外、国内)撰写,其格式与内容要求同“临床试验总结”部分。
52、临床试验总结本部分系注册申请人所研究药物的临床试验及部分相关研究的总结。
2.1 生物药剂学研究总结目的是为剂型设计提供依据。
首先列出试验结果,包括:(1)体外溶出度研究;(2)生物利用度(BA)或生物等效性(BE)研究。
然后依据上述试验进行总结,重点为:处方和工艺改变对体外溶出度、BA 和BE 影响的证据;食物对BA 与BE 影响的证据;体外溶出与BA 相关的证据;不同剂型BA、BE 比较。
最后,根据对药物体外溶出度研究、BA 或BE 研究结果的分析,提供剂型确定的思路和依据。
2.2 临床药理学研究总结临床药理学研究的目的是为临床试验提供指导。
首先列出试验结果,然后通过对人体生物材料研究、人体药代动力学研究、药效学研究的总结与分析,提供对临床试验的指导性建议结论。
撰写内容包括:(1)人体生物材料研究,重点为通透性研究(如肠道吸收、血脑屏障通过情况)、蛋白结合情况、肝脏代谢情况、与代谢有关的药物相互作用情况等。
(2)人体药代动力学(PK)研究、药效学(PD )研究。
总结不同受试人群、内在因素(Intrinsic Factors)和外在因素(Extrinsic Factors)对PK和PD6的影响,为不同目标适应症人群(如儿童、老年患者、肝肾功能不全患者)用药剂量、剂量调整和用药间隔的确定提供依据。
(3)桥接研究:总结和分析地区或种族间有效性信息,提供桥接国外的证据。
2.3 临床有效性总结分别叙述研究药物对每个适应症的有效性。
列出与有效性评价有关的临床试验(包括:量效关系研究、有效性比较研究、远期有效性研究、不同人群的有效性研究)的结果。
对试验设计的重点与特殊点进行分析,如随机化、双盲、对照药选择及理由、受试者选择、试验设计的特殊点、研究终点(主要及次要)、研究时限以及既定研究结果的分析方法等。
必要时可引用非临床试验数据和临床药理学数据,如支持用法用量的依据等。
具体撰写过程中,宜采用适宜的方式(文字、图、表)。
对于有多个临床试验的药物,应总结所有有效性的数据,包括支持结论和不支持结论的数据。
通常采用两种分析方法:一为临床试验结果汇总分析,一为临床试验结果间的比较。
对于只有单个临床试验的药物,仅就单个临床试验的有效性数据进行总结。
总结的具体内容包括:72.3.1 受试人群简要描述基线水平人口学和其他特征,包括疾病特征(严重程度、持续时间)、治疗情况、入选与排除标准;不同受试人群基线水平的差异;受试人群与上市后拟用人群的不同;对脱落病人数、时间、原因进行评估。
2.3.2 有效性研究结果及比较撰写重点如下:(1)对所有的用于有效性评价的临床试验结果(包括不支持该研究结论的结果和阴性结果)进行分析和比较。
分析的重点为:研究终点、对照组、研究时限、统计方法、受试人群、剂量等。
(2)临床试验之间比较的重点为主要研究终点。
如研究终点涉及不同的变量或时间点时,应对从所有临床试验中获取的重要信息进行综合比较。
(3)提供疗效的置信区间。
(4)设计相同的临床试验结果间有重要的不同时,应该描述和讨论。
(5)如果进行临床试验荟萃分析,应该注明这种分析是按既定分析方案进行,或事后拟定方案进行。
重点描述试验间的试验设计、受试人群、有效性测定的区别,以便评价临床试验结果与结论间的关联性。
(6)桥接研究:总结和分析地区或种族间有效性信息,提供桥接的证据。
2.3.3 不同受试人群间结果比较目的是了解不同亚组间治疗结果是否一致。
进行多个临床试验间的横向比较分析,评价人口学因素(年龄、性别和种族)和其他既定的或相关的内在因素或外在因素对疗效的影响。
82.3.4 与推荐剂量相关的临床信息参考非临床试验结果,总结药代动力学、药理毒理学研究、对照临床试验与非对照临床试验数据,提供支持推荐剂量(首剂剂量、最大剂量、个体化用药指导)的依据。
2.3.5 长期疗效与耐受性问题目的是为了解研究药物长期疗效情况,是否存在耐受性问题。
提供有长期疗效数据的病人数量以及药物暴露时间的临床资料,分析随着用药时间的延长其疗效持续或减弱的数据。
此类分析应主要针对有对照的临床试验,尤其是那些收集长期疗效的数据的研究。
在长期疗效观察的临床试验中,应考虑早期治疗中断或改用其他治疗方法对有效性结果的影响。
2.4 临床安全性总结总结所有与安全性相关的临床试验数据与文献数据。
只要使用过至少一次受试药物的受试者均应列入安全性分析。
从以下三个方面,整理与安全性有关的数据:用药/暴露情况(用药剂量、用药时间、用药病例数)。
常见不良事件和实验室检查异常。
严重不良事件和重要不良事件。
2.4.1 用药/暴露情况列出用于安全性评价的数据,包括:(1)非临床试验与文献;(2)与临床安全性相关的临床结果;(3)特殊安全性问题。
2.4.1.1用药/暴露程度对各期临床试验中的药物暴露程度进行总结。
在撰写过程中应对下述几点9进行考虑:(1)如果存在多种用药剂量或用药时限,应按特定的剂量和时限段对受试者数量进行归纳。
(2)列出所有受试者中最大用药剂量、用药时间最长的剂量。
必要时列出受试者平均每日用药量。
(3)不良事件与药物累计剂量相关时,应提供药物的累计情况。
(4)剂量按公斤体重或体表面积计算时,更能提示药物与不良事件和实验室异常的相关性。
2.4.1.2 受试人群的特征简单描述受试人群的有关特征,包括疾病的严重程度,是否住院治疗,是否有肝、肾功能损害,是否有合并症,合并用药情况,受试者所在地区。
受试者出现合并症、病情加重或违背治疗方案合用其他药物时,如果该部分病例从安全性分析中剔除,应特别说明。
2.4.2 不良事件总结与比较试验药与对照药不良事件情况:(1)不良事件种类;(2)严重程度;(3)持续的时间;(4)处理情况;(5)转归。
不良事件应包括与治疗相关和不相关者。
2.4.2.1 常见不良事件常见的与用药相关的不良事件相关因素包括剂量,按公斤体重或体表面积剂量,用药方法,治疗时限,总剂量,年龄、性别、种族等人口学特征,合并用药,其他如肝、肾功能等基线特征,有效性结果,药物浓度。
10分析不良事件与上述因素的关系。
2.4.2.2 死亡所有死亡病例均应列表,包括治疗结束后短期内死亡病例,或之后发生的与临床试验可能相关的死亡。
根据各个临床试验和汇总临床试验中的死亡率情况,对死亡病例应该逐个审查和分析,考虑总体死亡率和特殊原因致死情况,分析死亡与用药相关的不良事件相关因素的关系。
2.4.2.3 严重不良事件分析严重不良事件发生率与治疗时限的关系,尤其是长期用药情况。
分析严重不良事件与用药相关的不良事件相关因素的关系。
2.4.2.4 重要不良事件首先假定导致停药的重要不良事件与药物治疗有关,然后对停药原因进行分析,应该进行研究间停药率的比较(治疗药物与安慰剂或阳性对照药)。
分析重要不良事件与用药相关的不良事件相关因素的关系。
2.4.2.5 不良事件分析按器官系统分类按器官系统总结和分析不良事件便于理解药物与事件的相关性,不良事件按器官系统总结并冠以器官系统名称,按不良事件发生率的降序排列。
如果不良事件以综合征的形式出现,应另栏总结。
2.4.2.6 不良事件分析受试药和对照药的所有不良事件均应进行分析,比较受试组和对照组不良事件的发生率,最好结合事件的严重程度及因果判断分类进行。
必要时,还应分析其与给药剂量、给药时间、基线特征及人口学特征的相关性。
描述不良事件应采用标准化术语。
11安全性汇总分析(Pooled Safety Analyses)是常用的一种分析方法,在人群、试验设计、剂量、用药时限、不良事件检查方法相同情况下采用。
