粗多糖检测方法(蒽酮比色法)
蒽酮-硫酸法测多糖

蒽酮硫酸比色法测定多糖含量之杨若古兰创作一. 实验道理糖类在较高温度下可被浓硫酸感化而脱水生成糠醛或羟甲基糖醛后,与蒽酮(C14H10O)脱水缩合,构成糠醛的衍生物呈蓝绿色.该物资在620 nm处有最大接收,在150 µg/mL范围内,其色彩的深浅与可溶性糖含量成反比.该法有很高的灵敏度,糖含量在30 µg摆布就能进行测定.二. 试剂器材蒽酮试剂:精密称取0.1g蒽酮,加80%浓H2SO4100 mL使溶解,摇匀.当日配制使用;葡萄糖尺度液:将无水葡萄糖置于五氧化二磷干燥器中,12hr后精密称取100mg,用蒸馏水定容至100ml;其他器材:分析天平、分光光度计、容量瓶(100ml、50ml、10ml)、烧杯、具塞试管、移液器、移液器吸头、涡旋振荡器和废液缸等.三. 操纵步调样品的测定将样品溶液糖浓度调整到测定范围,精确汲取2mL置于干燥洁净试管中,在每支试管中立即加入蒽酮试剂6mL,振荡混匀,各管加完后一路置于沸水浴中加热15min.取出,敏捷浸于冰水浴中冷却15min,每个浓度做23个反复.在625nm波长下敏捷测定各管吸光值.根据葡萄糖含量的尺度曲线,由样品溶液吸光值计算各样品溶液中糖的浓度,并计算其糖含量. 四. 留意事项该法的特点是几乎可测定所有的碳水化合物,不单可测定戊糖与已糖,且可测所有寡糖类和多糖类,包含淀粉、纤维素等(由于反应液中的浓硫酸可把多糖水解成单糖而发生反应),所以用蒽酮法测出的碳水化合物含量,实际上是溶液中全部可溶性碳水化合物总量.在没有须要过细划分各种碳水化合物的情况下,用蒽酮法可以一次测出总量,省去很多麻烦,是以,有特殊的利用价值,但在测定水溶性碳水化合物时,则应留意切勿将样品的未溶解残渣加入反应液中,否则会由于细胞壁中的纤维素、半纤维素等与蒽酮试剂发生反应而添加了测定误差. 分歧的糖类与蒽酮试剂的显色深度分歧,果糖显色最深,葡萄糖次之,半乳糖、甘露糖较浅,五碳糖显色更浅,故测定糖的混合物时,常因分歧糖类的比例分歧形成误差,但测定单一糖类时则可防止此种误差.。
蒽铜的比色法

三、操作方法
(1)标准曲线绘制 (2)100ml容量瓶编号 沸 水 浴 加 热 6 分 钟 , 取 出 冷 却 → 用 1 cm 比 色 杯 →620nm测定吸光度→作出以吸光度为横坐标, 糖液浓度为纵坐标的准曲线
4
(3)样品测定 取1ml样品、系列标准溶液和蒸馏水 (作空白)各1ml,分别置于8根试管中, 沿壁各加入5ml冷的蒽酮溶液,混匀后, 在试管口盖上玻璃球,在沸水浴上加热 10分钟后,在流水中冷却20分钟,在 620nm波长处以试剂空白作参比,测定吸光度。
7
蒽铜的比色法
1
一、原理:
糖与硫酸反应脱水生成羟甲基呋喃甲醛, 生成物再与蒽铜缩合成蓝绿色化合物, 其颜色深浅与溶液中糖的浓度成正比, 可比色定量。 本法在20-200 mg/L含量范围内呈良好的 先行关系。 本法是微量法,适用于含微量的碳水化 1)0.2%蒽铜试剂:溶解蒽铜0.2g于 100ml95%硫酸中,置棕色瓶中冷暗处保 存 (2) 0.1%葡萄糖液:准确称干燥葡萄 糖0.1000g 定容100ml 再配成10、20、40、60、80、100mg/L的 系列标准溶液。
以标准系列数据做标准曲线,查出样品含量
5
四 、计算
总糖(以葡萄糖%计)=C×稀释倍数 ×0.0001 式中:C是从标准曲线查得的糖浓度,PPm 0.0001是将PPm换算为%的系数
6
五、试验注意
1,样液必须清澈透明,加热后不应有蛋 白质沉淀 2,样品颜色较深时,可用活性炭脱色后 再进行测定 3,此法与所用的硫酸浓度和加热时间有 关 4,所取糖液浓度在1-2.5mg/100ml之间
蒽酮比色法流程

蒽酮比色法流程蒽酮比色法呀,这可是个挺有趣的实验方法呢。
一、实验准备。
做这个蒽酮比色法实验之前,咱们得把东西都准备好。
你得有蒽酮试剂,这个试剂可重要啦,就像是这个实验的小魔法药水一样。
然后还得有标准的糖溶液,这就像是一把尺子,用来衡量咱们要测的东西。
再有就是要准备好咱们的样品,不管是从植物里提取的,还是其他什么来源的,这个样品就是咱们实验的主角啦。
当然啦,各种实验用到的玻璃器皿也不能少,像试管呀,移液管之类的,它们就像是这个实验的小助手,帮助咱们把各种溶液准确地量取和混合。
二、样品处理。
把样品准备好之后呢,可不能就直接拿去测。
咱们得先对样品进行处理。
如果是从植物里取的样品,可能得先把植物组织给弄碎,就像把一块大蛋糕切成小块一样。
然后要把它里面的糖给提取出来,这个过程就有点像从沙子里淘金子,要把咱们想要的东西从一堆东西里弄出来。
有时候可能要加一些溶剂,然后搅拌呀,加热呀之类的操作,让糖乖乖地跑到溶剂里去。
这一步可不能马虎,要是没处理好样品,后面的实验结果可能就会出问题,就像盖房子要是地基没打好,房子就不稳啦。
三、反应过程。
等样品处理好了,就到了很关键的反应环节啦。
把处理好的样品溶液和蒽酮试剂混合在一起。
这时候呀,就会发生神奇的化学反应。
糖和蒽酮试剂会产生一种颜色变化,就像是变魔术一样。
这个颜色变化可是我们测量的关键呢。
你就看着溶液的颜色慢慢改变,心里还会有点小激动,想着自己做的实验是不是会成功呢。
这个反应可能会需要一定的时间,就像烤蛋糕一样,时间不够或者太长都不行,要刚刚好,这样才能得到准确的结果。
四、比色测定。
反应完成之后,就该比色啦。
把反应后的溶液放到比色计里面。
比色计就像是一个超级眼睛,它能很精确地看出溶液颜色的深浅。
根据颜色的深浅呢,就可以知道样品里糖的含量啦。
这个时候就有点像在猜谜语,比色计给出答案,我们就知道这个样品里有多少糖了。
要是颜色深,那就说明糖含量高,要是颜色浅,糖含量就低。
这个过程也需要很小心,要确保比色计是准确的,就像我们看东西的时候要保证眼睛没毛病一样。
粗多糖含量测定方法
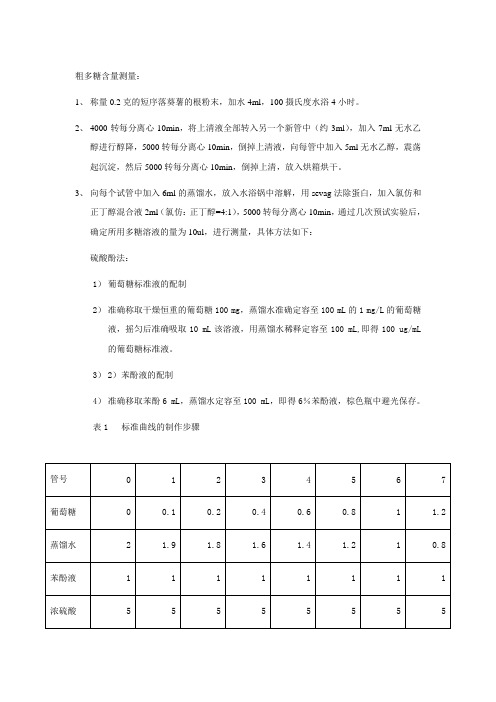
粗多糖含量测量:1、称量0.2克的短序落葵薯的根粉末,加水4ml,100摄氏度水浴4小时。
2、4000转每分离心10min,将上清液全部转入另一个新管中(约3ml),加入7ml无水乙醇进行醇降,5000转每分离心10min,倒掉上清液,向每管中加入5ml无水乙醇,震荡起沉淀,然后5000转每分离心10min,倒掉上清,放入烘箱烘干。
3、向每个试管中加入6ml的蒸馏水,放入水浴锅中溶解,用sevag法除蛋白,加入氯仿和正丁醇混合液2ml(氯仿:正丁醇=4:1),5000转每分离心10min,通过几次预试实验后,确定所用多糖溶液的量为10ul,进行测量,具体方法如下:硫酸酚法:1)葡萄糖标准液的配制2)准确称取干燥恒重的葡萄糖100 mg,蒸馏水准确定容至100 mL的1 mg/L的葡萄糖液,摇匀后准确吸取10 mL该溶液,用蒸馏水稀释定容至100 mL,即得100 ug/mL的葡萄糖标准液。
3)2)苯酚液的配制4)准确移取苯酚6 mL,蒸馏水定容至100 mL,即得6%苯酚液,棕色瓶中避光保存。
表1 标准曲线的制作步骤取8支干净的具塞试管按表2方法操作,摇匀后放置5 min,置沸水浴中加热15min,取出迅速冷却至室温,以0号作为空白调零,在最大吸收波长处测定吸光度。
以葡萄糖浓度Y 为纵坐标(ug/mL),吸光度X为横坐标,从而来绘制标准曲线。
用exceL软件求得回归方程。
计算百分含量:百分含量=L*600*10^(-6)/0.2蒽酮法:1.葡萄糖标准曲线的制作取6支20ml具寒试管,编号,按下表数据配制一系列不同浓度的标准葡萄糖溶液。
在每管中均加入0.5ml蒽酮试剂,再缓慢地加入5ml浓H2SO4,摇匀后,打开试管塞,置沸水浴中煮沸10分钟,取出冷却至室温,在620nm波长下比色,测各管溶液的光密度值(OD),以标准葡萄糖含量为纵坐标,光密度值为横坐标,作出标准曲线。
样品含量测定:百分含量= L*600*10^(-6)/0.2。
蒽酮-硫酸比色法测定多糖含量

蒽酮-硫酸比色法测定多糖含量
操作步骤
葡萄糖标准曲线的制作
取6支具塞试管,按下表数据精密配制一系列不同浓度的葡萄糖溶液,每个浓度做2个重复:
管号0 1 2 3 4 5
标准葡萄糖溶液/mL 0 0.2 0.4 0.6 0.8 1.0
蒸馏水/mL 1.0 0.8 0.6 0.4 0.2 0
在每支试管中立即加入蒽酮试剂4mL,振荡混匀,各管加完后一起置于沸水浴中加热10min。
取出,迅速浸于冰水浴中冷却10min。
在652nm波长下以第1管为空白,迅速测定其余各管吸光值。
以标准葡萄糖含量( g)为横坐标,以吸光值为纵坐标,绘制标准曲线。
样品的测定
将样品溶液糖浓度调整到测定范围,精确吸取2mL置于干燥洁净试管中,在每支试管中立即加入蒽酮试剂6mL,振荡混匀,各管加完后一起置于沸水浴中加热15min。
取出,迅速浸于冰水浴中冷却15min,每个浓度做2-3个重复。
在652nm波长下迅速测定各管吸光值。
根据葡萄糖含量的标准曲线,由样品溶液吸光值计算各样品溶液中糖的浓度,并计算其糖含量。
Cri-J。
多糖测定
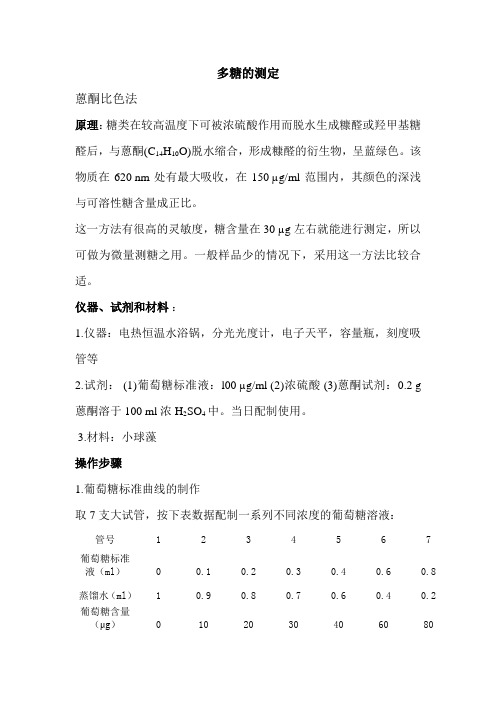
多糖的测定蒽酮比色法原理:糖类在较高温度下可被浓硫酸作用而脱水生成糠醛或羟甲基糖醛后,与蒽酮(C14H10O)脱水缩合,形成糠醛的衍生物,呈蓝绿色。
该物质在620 nm处有最大吸收,在150 µg/ml范围内,其颜色的深浅与可溶性糖含量成正比。
这一方法有很高的灵敏度,糖含量在30 µg左右就能进行测定,所以可做为微量测糖之用。
一般样品少的情况下,采用这一方法比较合适。
仪器、试剂和材料:1.仪器:电热恒温水浴锅,分光光度计,电子天平,容量瓶,刻度吸管等2.试剂: (1)葡萄糖标准液:l00 µg/ml (2)浓硫酸 (3)蒽酮试剂:0.2 g蒽酮溶于100 ml浓 H2SO4中。
当日配制使用。
3.材料:小球藻操作步骤1.葡萄糖标准曲线的制作取7支大试管,按下表数据配制一系列不同浓度的葡萄糖溶液:管号 1 2 3 4 5 6 7葡萄糖标准液(ml)0 0.1 0.2 0.3 0.4 0.6 0.8蒸馏水(ml) 1 0.9 0.8 0.7 0.6 0.4 0.2 葡萄糖含量(μg)0 10 20 30 40 60 80在每支试管中立即加入蒽酮试剂4.0m1,迅速浸于冰水浴中冷却,各管加完后一起浸于沸水浴中,管口加盖,以防蒸发。
自水浴重新煮沸起,准确煮沸l0 min取出,用冰浴冷却至室温,在620 nm波长下以第一管为空白,迅速测其余各管吸光值。
以标准葡萄糖含量(µg)为横坐标,以吸光值为纵坐标,作出标准曲线。
2.小球藻中可溶性糖的提取(1)将生长至平衡期的小球藻液6ml离心(3500r/min)5min,获得新鲜的小球藻藻泥;(2)向藻泥中加入5倍体积的去离子水,置于冰箱(-4℃)中冷冻,然后取出融化,如此反复3次提取水溶物;(3)将冰融后的溶液离心(4500r/min)10min,弃残渣,取上清清液;(4)将上清液在水浴中加热,浓缩至原体积的1/3,然后加入体积分数为3%的三氯乙酸沉淀蛋白,离心(12000r/min)10min,取上清液;(可以再平均分成n份,视量而调整)(5)吸取上清液1ml,加入5倍体积的乙醇溶液(体积分数为95%),所得的沉淀物即为小球藻粗多糖;(6)将粗多糖溶于水,再用体积分数30%乙醇(95%乙醇31.58ml,68.42ml蒸馏水)进行沉淀,最终得到多糖。
蒽酮比色法[宝典]
蒽酮比色法蒽酮比色法是一个快速而简便的定糖方法。
蒽酮可以与游离的已糖或多糖中的已糖基、戊糖基及已糖醛酸起反应,反应后溶液呈蓝绿色,在620nm处有最大吸收。
本法多用于测定糖原的含量,也可用于测定葡萄糖的含量。
蒽酮比色法测糖试验蒽酮比色法测定多糖含量1、蒽酮比色法测糖试验一实验目的掌握蒽酮比色法测糖的原理和方法二实验原理蒽酮可以与游离的已糖或多糖中的已糖基、戊糖基及已糖醛酸起反应,反应后溶液呈蓝绿色,在620nm处有最大吸收。
三实验器材及试剂马铃薯干粉可调试移液器或移液管可见分光光度计(723型)电子分析天平水浴锅电炉子蒽酮试剂:取2g蒽酮溶解到80%H2SO4中,以80%H2SO4定容到1000ml,当日配制使用。
标准葡萄糖溶液(0.1mg/ml):100mg葡萄糖溶解到蒸馏水中,定容到1000ml 备用。
四、操作1.制作标准曲线取7支干燥洁净的试管,按表1顺序加入试剂,进行测定。
以吸光度值为纵坐标,各标准溶液浓度(mg/ml )为横坐标作图得标准曲线。
表1 蒽酮比色法定糖——标准曲线的制作沸水浴中准确煮沸10min,取出用流水冷却,室温放10min,于620nm处比色葡萄糖浓度(mg/ml)2.样品含量的测定样品液的制作:精确称取马铃薯干粉0.1g置于锥形瓶中—→加入30ml沸水—→沸水浴30min(不时摇动)—→取出,3000rpm离心10min(或过滤)—→反复洗涤残渣2次—→合并滤液—→冷却至室温—→定容到50ml的锥形瓶中—→再从中取出1ml,再定容到10ml的容量瓶中样品液的测定:(1)取4支试管,按照表2加样(加蒽酮时需要冰水浴5min冷却)表2 蒽酮比色法定糖——样品的测定(2)加样冷却完成后置沸水中煮沸10min,取出流水冷却放置10min,620nm 处比色测量各管OD值。
(3)以1号试管作为调零管,2、3、4号管的OD值取平均后从标准曲线上查出样品液相应的含糖量。
3.结果计算:C×Vw = ————×100%m,式中w:糖的质量分数(%)C:从标准曲线中查出的糖质量分数(mg/ml)V:样品稀释后的体积(ml)m:样品的质量(ml)2、蒽酮比色法测定多糖含量一试验原理植物在个体发育的各个时期,代谢活动也发生相应的变化,碳水化合物的代谢也不例外,其含量也随之发生变化。
蒽酮-硫酸比色法测定多糖含量讲课稿
蒽酮-硫酸比色法测定多糖含量蒽酮-硫酸比色法测定多糖含量一. 实验原理糖类在较高温度下可被浓硫酸作用而脱水生成糠醛或羟甲基糖醛后,与蒽酮(C14H10O)脱水缩合,形成糠醛的衍生物呈蓝绿色。
该物质在620 nm处有最大吸收,在150 µg/mL范围内,其颜色的深浅与可溶性糖含量成正比。
该法有很高的灵敏度,糖含量在30 µg左右就能进行测定。
二. 试剂器材蒽酮试剂:精密称取0.1g蒽酮,加80%浓H2SO4100 mL使溶解,摇匀。
当日配制使用;葡萄糖标准液:将无水葡萄糖置于五氧化二磷干燥器中,12hr后精密称取100mg,用蒸馏水定容至100ml;其他器材:分析天平、分光光度计、容量瓶(100ml、50ml、10ml)、烧杯、具塞试管、移液器、移液器吸头、涡旋振荡器和废液缸等。
三. 操作步骤葡萄糖标准曲线的制作取7支具塞试管,按下表数据精密配制一系列不同浓度的葡萄糖溶液,每个浓度做2-3个重复:管号0 1 2 3 4 5 6标准葡萄糖溶液/mL 0 0.2 0.4 0.6 0.8 1.0 1.2蒸馏水/mL 2.0 1.8 1.6 1.4 1.2 1.0 0.8 在每支试管中立即加入蒽酮试剂6mL,振荡混匀,各管加完后一起置于沸水浴中加热15min。
取出,迅速浸于冰水浴中冷却15min。
在625nm波长下以第1管为空白,迅速测定其余各管吸光值。
以标准葡萄糖含量( g)为横坐标,以吸光值为纵坐标,绘制标准曲线。
样品的测定将样品溶液糖浓度调整到测定范围,精确吸取2mL置于干燥洁净试管中,在每支试管中立即加入蒽酮试剂6mL,振荡混匀,各管加完后一起置于沸水浴中加热15min。
取出,迅速浸于冰水浴中冷却15min,每个浓度做2-3个重复。
在625nm波长下迅速测定各管吸光值。
根据葡萄糖含量的标准曲线,由样品溶液吸光值计算各样品溶液中糖的浓度,并计算其糖含量。
四. 注意事项该法的特点是几乎可测定所有的碳水化合物,不但可测定戊糖与已糖,且可测所有寡糖类和多糖类,包括淀粉、纤维素等(因为反应液中的浓硫酸可把多糖水解成单糖而发生反应),所以用蒽酮法测出的碳水化合物含量,实际上是溶液中全部可溶性碳水化合物总量。
灵芝粗多糖测定试验方案-2015-09-23
灵芝粗多糖的测定-蒽酮法1 试验原理多糖经乙醇沉淀分离后,去除其他可溶性糖及杂质的干扰,糖与硫酸在沸水浴中加热脱水生成羟甲基呋喃甲醛(羟甲基糠醛),再与蒽酮缩合成蓝绿色化合物,其呈色强度与溶液中糖的浓度呈正比,在620nm波长下比色定量。
2 样品、仪器与试剂2.1 样品破壁灵芝孢子粉(袋装)2.2 仪器(1)离心机:4000r/min(2)离心管50mL或具盖10mL离心管(3)分光光度计(TU1901)(4)水浴锅(TW20)2.3 试剂实验用水为二级水;所用试剂为分析纯级。
1)葡萄糖标准液:准确称取0.1000g经98~100℃干燥至恒重的分析纯葡萄糖,加水溶解后定容至100mL,浓度是1.0mg/mL,以水稀释10倍(0.1mg/mL)制作标准曲线,现配现用。
2)蒽酮硫酸溶液:称取0.2g蒽酮置于烧杯中,缓慢加入100mL硫酸溶液(80%),溶解后呈黄色透明溶液,摇匀(棕色瓶保存)。
(等硫酸溶液温度降下来再加入蒽酮中)(80%硫酸配置:100mL 98%硫酸+30.29mL水)3)无水乙醇(A.R)4)3%草酸溶液:称取3.0克草酸,加水溶解后定容至100mL。
3 多糖溶液制备称取2.0000g破壁灵芝孢子粉加入50mL草酸溶液(3%)沸水浴加热回流提取2h,提取液冷却、过滤后定容至100mL,取5mL加入25mL无水乙醇4℃放置过夜沉淀多糖,离心,弃去上清,沉淀加少量热水溶解,重复沉淀一次;沉淀加少量水溶解并定容至50mL,得到样品溶液。
4 标准曲线的绘制分别精密吸取对照品溶液(0.1mg/mL)0.2、0.4、0.6、0.8、1.0mL,置25mL 具塞试管中,加水至1.0mL,精密加入硫酸蒽酮溶液5mL,置沸水浴中加热15min,取出,放入冰水浴中冷却15min,以相应的试剂为空白,按照紫外-可见分光光度法,测定620m波长处吸光度。
以吸光度为纵坐标,浓度为横坐标,绘制标准曲线。
5 样品含量的测定取一定体积的样品溶液(1.0mL)4份,分别置10mL具塞试管中,精密加入硫酸蒽酮溶液5mL,置沸水浴中加热15min,取出,放入冰水浴中冷却15min,测定吸光值。
实验一蒽酮比色定糖法
实验一:蒽酮比色定糖法一.实验目的:1.学习分光光度法的基本原理2.学习对蔬菜和食品中糖含量进行测定的方法二.实验原理1. 分光光度法基本原理:溶液中的物质在光的照射激发下,产生对光的吸收效应,不同的物质具有各自选择性的吸收光谱,因此,当某单色光通过溶液时,能量会被吸收而减弱,光能量减弱的程度和物质浓度有一定比例关系,即符合于比色原理——比尔定律。
2.朗伯-比尔定律A=lg(1/T)=KbcA:为吸光度,T:为透射比,是投射光强度比上入射光强度c:为吸光物质的浓度b:为吸收层厚度3.物理意义当一束平行单色光垂直通过某一均匀非散射的西光物质时,起其吸光度A与吸光物质的浓度c及吸收层厚度b成正比.4.蒽酮比色法蒽铜比色法是一个快速而简便的定糖方法。
蒽酮可以和游离的己糖或多糖中的己糖基,戊醛糖及己糖醛酸反应,反应后溶液呈蓝绿色,在620nm处有最大吸收。
蒽酮可与其他一些糖类发生反应,但显现的颜色不同。
当样品中存有含较多色氨酸的蛋白质时,反应不稳定,呈现红色。
对于特定的糖类,反应较稳定。
本法多用于测定糖原含量,亦可用于测定葡萄糖含量。
三.实验试剂1. 制作标准曲线:(1)蒽酮试剂:取0.2g蒽酮溶于100mL 80%(V/V)硫酸中,当日配制使用;(2)标准葡萄糖溶液(0.1mg/mL):(可滴加几滴甲苯作防腐剂);(3)糖样品溶液。
四.实验操作步骤1.取干试管6支,依次加入标准糖溶液0,0.1,0.2,0.3mL,0.4ml,0.5ml,并依次用蒸馏水补足体积到1mL,各管均加入蒽酮试剂4mL,沸水浴准确煮沸10 min,室温放置10min,用1号试管溶液调零,比色测定A620(同时测定样品)。
用标准糖溶液浓度为横坐标,吸光度为纵坐标,制作标准曲线。
2. 样品含糖量测定:无蛋白糖溶液样品溶液稀释100倍,吸取1mL置试管中,再加入4mL蒽酮试剂,沸水浴中煮沸10分钟,取出后自来水冷却后比色,其他条件与做标准曲线相同,测得的吸光度值由标准曲线查算出样品液的糖含量。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
粗多糖检测方法(蒽酮比色法):
1 主要仪器
(1)离心机( 4000r/min )。
(2)离心瓶容量 100ml 或具盖 10ml 离心管。
(3)分光光度计。
(4)水浴锅。
2 试剂
实验用水为双蒸水;所用试剂为分析纯级。
(1)葡萄糖标准液:准确称取I.OOOOg经过98〜100 C干燥至恒重的分析纯葡萄糖,加水溶解后以水稀释至 1000ml ,此溶液 1ml 含 1mg 葡萄糖,用前稀
释10倍(0.1mg/ml ),现用现配。
(2) 0.2%蒽酮硫酸溶液:称取0.2g蒽酮置于烧杯中,缓慢加入100ml浓硫酸(分析纯),溶解后呈黄色透明溶液,现用现配。
3 测定步骤
(1)样品处理:准确称取样品 1〜2g 按上法用乙醇沉淀多糖,然后用热水分次溶解沉淀并稀释定容至 100〜250ml (使样液含糖量在 0.02〜 0.05mg/ml
间)。
过滤,弃去初滤液即为待测液。
(2)标准曲线的绘制:准确吸取葡萄糖标准液( 0.1mg/ml ) 0、0.1、0.2、
0.4、0.6、0.8、1.0ml 于 10ml 具塞比色管中,加水至 1.0ml ,加入蒽酮
试剂 5ml 充分混匀,在沸水浴中加热 10min ,取出在流水中冷却 20min
后,在 620nm 波长下,以试剂空白调零,测定各管的吸收值绘制标准曲(3) 样品测定:准确吸取样品待测液10ml (含糖20〜80⑷)按标准曲线绘
制步骤于 620nm 波长下测定吸光度值并求出样品含糖量。
4 结果计算:
m1
X= --------------- x F x n x 100%
m x 1000
式中
X—样品中粗多糖含量(以葡萄糖计)(%);
m1 —由标准曲线查得样品液含糖质量( mg );
m —样品质量( g );
n —稀释倍数;
F—换算因子。
换算因子的测定:准确称取被测物质的纯品 20mg 置 100ml 容量瓶中,加蒸馏水溶解并稀释至刻度,吸取 0.2 〜0.4ml 于 10ml 具塞比色管中,加水至 1.0ml 按上法测定。
从标准曲线中查出供试液中相当于标准葡萄糖的质量 (mg )
m
F = —————
m1x n
式中
m —多糖纯品的质量( mg );
m1 —多糖纯品供试液中相当于标准葡萄糖的质量( mg );
n —供试液的稀释倍数;。
