2017年全国化学课程与教学论年会《基于化学学科核心素养的难溶电解质的沉淀溶解平衡教学设计》
基于学科核心素养培养的高中化学课堂教学设计——以“水的电离和溶液的pH”为例

基于学科核心素养培养的高中化学课堂教学设计以 水的电离和溶液的pH 为例徐㊀璐(湖北省宜昌市第一中学ꎬ湖北宜昌443099)摘㊀要:以人教版高中化学必修一第三章 水的电离和溶液的pH 教学设计为例ꎬ展现了 变化观念与平衡思想㊁证据推理与模型认知 等学科核心素养在高中化学教学过程中的培养过程.通过以数字化实验为基础的探究活动来构建知识体系ꎬ促进学生建立宏微观念㊁认识物质变化㊁建构认知模型㊁感受学科价值ꎬ全面发展化学学科核心素养.关键词:水的电离ꎻ溶液酸碱性ꎻpHꎻ数字化实验中图分类号:G632㊀㊀㊀文献标识码:A㊀㊀㊀文章编号:1008-0333(2024)06-0128-03收稿日期:2023-11-25作者简介:徐璐(1990.9-)ꎬ女ꎬ湖北省宜昌人ꎬ硕士ꎬ中学一级教师ꎬ从事高中化学教学研究.基金项目:2021年湖北省教育协会 十四五 教育研究一般课题 基于学科核心素养的化学教学设计研究 研究成果(课题编号:A06-02)㊀㊀«普通高中化学课程标准(2017年版)»要求学生能从宏观和微观结合㊁定性与定量结合上收集证据ꎬ能依据证据从不同视角分析问题ꎬ并推出合理的结论[1].现以 水的电离和溶液的pH 一课为例ꎬ探讨学科核心素养的培养在中学教学中的具体实施.1教材分析水的电离和溶液的pH 是人教版高中化学选择性必修1第三章第二节第一课时的内容.本课时内容包括:水的电离ꎬ溶液的酸碱性与pH.本节内容是对 电解质的电离 学习的进一步深化ꎬ也是对 电离平衡 相关知识的巩固ꎬ同时为学习 盐类的水解 提供知识储备.2课时目标(1)学会书写水的电离方程式ꎬ理解水的离子积含义及适用范围ꎻ知道pH的意义及数学表达式ꎬ并能进行简单计算ꎻ(2)利用已有知识进行证据推理ꎬ理解温度㊁外加酸碱对水的电离平衡的影响ꎻ(3)通过分组实验培养动手能力和合作学习能力ꎬ进一步了解科学探究的一般方法ꎬ养成勤于实践ꎬ善于合作ꎬ勇于创新的科学探究精神ꎻ(4)了解pH在生活生产中的应用ꎬ体会化学科学的发展对提高人类生活质量的积极作用ꎬ培养科学态度和社会责任.教学重点:水的离子积常数㊁影响水的电离平衡的因素㊁溶液的酸碱性与pH.教学难点:水的离子积常数适用范围㊁影响水的电离平衡的因素.3教学用品NaOH溶液(0.01mol/L㊁0.1mol/L)㊁盐酸(0.1mol/L)㊁pH计㊁滤纸㊁磁力加热搅拌器㊁温度传感器㊁电导率传感器.希沃授课助手㊁LAB-PORT2数据采集器㊁Lab-Studio数据分析软件.8214教法学法教法:情境激学法㊁任务驱动法㊁推理归纳法等ꎻ学法:实验探究法㊁类比归纳法㊁合作学习法等.5教学过程环节一:创设情境ꎬ矛盾凸现.ʌ情境引入ɔ展示图1:蔚蓝色的波涛拍打着两岸的岩壁ꎬ在水面上扑腾起一簇簇浪花ꎬ这一望无际的海洋孕育了美丽富饶的宝岛台湾.图2:长江三峡滋养了一代代华夏儿女ꎬ孕育了璀璨的中华文明.以 共抓大保护㊁不搞大开发 为导向ꎬ推动长江经济带发展的战略部署ꎬ更是强调了 水 资源不容小觑的意义和价值.水不仅重要ꎬ水还有特殊的一面.让我们走上探索之旅ꎬ一起学习水的电离和溶液的pH.ʌ疑激导学ɔ水为何特殊?例如:水作为一种共价化合物在液态时却能导电ꎬ为什么?设计意图:通过介绍长江三峡的江水ꎬ使学生从多个角度认识水ꎬ了解水的重要性和 共抓大保护ꎬ不搞大开发 战略部署的重大意义ꎬ培养社会责任感.通过水的特殊性引发思维冲突ꎬ激发学习兴趣.环节二:科学史话ꎬ模型认知.ʌ科学史话ɔ1806年ꎬ化学家格罗特斯提出:水分子通过氧原子将质子从一个水分子传递给另一个水分子ꎬ如同分子接力赛.2016年ꎬ耶鲁大学化学教授马克约翰逊团队对水分子中发生的电子迁移拍摄了光谱快照ꎬ证实了格罗特斯理论ꎬ认为水发生了电离.ʌ知识建构ɔ水分子之间相互作用而电离出水合氢离子与氢氧根ꎬ可简写为水电离出氢离子和氢氧根.ʌ任务驱动ɔ请在学案上写出水的电离平衡常数表达式.ʌ学生书写ɔK电离=c(H+)ˑc(OH-)c(H2O)ʌ教师讲解ɔ常温下ꎬ1L水中只有1ˑ10-7mol水发生了电离.ʌ任务驱动ɔ请求出此时水中的c(H+)和c(OH-).㊀ʌ学生回答ɔ均为1ˑ10-7mol/L.ʌ教师讲解ɔ可见水的电离程度极其微弱ꎬc(H2O)可视为常数ꎬK电离也是常数ꎬ故c(H+)与c(OH-)的乘积为常数ꎬ称为水的离子积常数ꎬ用Kw表示ꎬ它与温度有关.常温Kw为1ˑ10-14.Kw不仅适用于纯水ꎬ也适用于稀的电解质水溶液ꎬ且Kw表达式中c(H+)与c(OH-)表示的是溶液中总的c(H+)与总的c(OH-).设计意图:科学史话拓展学生视野ꎬ使学生了解科学研究的重大意义.书写水的电离平衡常数表达式ꎬ回顾旧知并为引入Kw做铺垫ꎬKw的引入为后续微观探析中证据推理提供知识储备.环节三:微观探析ꎬ证据推理.ʌ教师提问ɔ根据影响弱电解质电离平衡的因素思考:水的电离平衡可能受什么因素影响?ʌ学生回答ɔ1.温度ꎻ2.c(H+)㊁c(OH-)ʌ微观探析一ɔ测定不同温度时蒸馏水的电导率ʌ教师提问ɔ观察到什么实验现象?得出什么结论?ʌ学生回答ɔ温度升高ꎬ蒸馏水的电导率呈增大趋势.升高温度ꎬ水的电离平衡正向移动ꎬ水的离子积常数增大.ʌ教师讲解ɔ请看表格ꎬ了解不同温度时水的离子积常数.已知纯水在某温度下的Kwꎬ将Kw开平方即可得此时纯水中的c(H+).这些数值很小ꎬ不方便表示ꎬ故引入pHꎬ即c(H+)的负对数表示溶液中c(H+)的大小来表示.ʌ教师讲解ɔ改变c(H+)或c(OH-)会使水的电离平衡如何移动?增大c(H+)或c(OH-)会使水的电离平衡中生成物浓度增大ꎬ此时平衡如何移动?ʌ学生回答ɔ逆向移动.ʌ问题凸现ɔ加入酸碱的浓度不同对水电离的抑制程度如何?ʌ微观探析二ɔ测量常温时一定浓度的盐酸或NaOH溶液的pH.ʌ教师讲解ɔ本实验使用到的实验仪器及用品有:pH计(精确度:0.1)ꎬ滤纸ꎬ小烧杯等.ʌ实验探究ɔ分组实验:用pH计平行测定三次ꎬ921计算平均值.ʌ数据分析ɔ第一组:c(H+)=c水(H+)=c水(OH-)=1ˑ10-12mol/Lꎬc(OH-)=1ˑ10-2mol/Lꎻ第二组:c(H+)=c水(H+)=c水(OH-)=1ˑ10-13mol/Lꎬc(OH-)=1ˑ10-1mol/Lꎻ第三组:c(H+)=1ˑ10-1mol/Lꎬc(OH-)=1ˑ10-13mol/L=c水(H+)=c水(OH-)=1ˑ10-13mol/L.ʌ教师提问ɔ对比第一㊁二组实验数据ꎬ思考问题1:向水中加入碱的浓度不同对水电离的抑制程度如何?ʌ学生回答ɔ碱的浓度越大ꎬ对水电离的抑制程度越大ꎻʌ教师追问ɔ问题2:向水中加入的酸中c(H+)或加入的碱中c(OH-)相等时ꎬ对水电离的抑制程度如何?ʌ学生回答ɔ对水电离的抑制程度相等.设计意图:数字化实验仪器可以将不易观察的实验现象进行数据呈现ꎬ可提高学生证据意识.环节四:迁移应用ꎬ归纳演绎.ʌ任务驱动ɔ结合所学知识完成迁移应用练习题.学生分组汇报练习题答案.ʌ教师提问ɔ只有酸溶液中才存在H+ꎬ碱溶液中才存在OH-ꎬ对吗?ʌ学生回答ɔ不对.任何水溶液中都存在H+和OH-.㊀ʌ教师追问ɔ溶液的酸碱性由什么决定?ʌ学生回答ɔc(H+)和c(OH-)的相对大小.ʌ教师追问ɔ能否根据pH判断溶液酸碱性?ʌ学生回答ɔ可以.ʌ教师讲解ɔ25ħ时ꎬpH<7溶液显酸性ꎬpH=7溶液显中性ꎬpH>7溶液显碱性.ʌ教师追问ɔ纯水显中性.为什么此时pH<7?ʌ学生回答ɔ因为温度不是25ħ.ʌ教师追问ɔ用pH判断溶液酸碱性时必须考虑什么外界条件?ʌ学生回答ɔ温度.ʌ模型认知ɔ1.溶液的酸碱性由c(H+)和c(OH-)相对大小决定c(H+)=c(OH-):中性ꎻc(H+)>c(OH-):酸性ꎻc(H+)<c(OH-):碱性.2.pH的大小与溶液酸碱性的关系(常温)pH<7酸性ꎻpH=7中性ꎻpH>7碱性设计意图:对比归纳总结判断溶液酸碱性的依据ꎬ强调 根据pH判断溶液酸碱性必须考虑温度 ꎬ培养学生严谨求实的科学态度.环节五:拓展视野ꎬ整合提高.ʌ教师讲解ɔpH在日常生活生产中应用也很广泛.阅读教材ꎬ回答问题:洗完头发后需要涂抹护发素ꎬ为什么?ʌ学生回答ɔ护发素具有调节头发pH使之达到适宜酸碱度的功能.ʌ知识建构ɔ组织学生进行知识整理.ʌ教师总结ɔ本节课通过科学史话认识了水的电离过程ꎻ进而通过微观探析探究影响水的电离的因素及不同浓度酸或碱对水电离的抑制程度ꎻ通过对比数据掌握判断溶液酸碱性的依据ꎻ通过拓展视野了解pH在生活生产中的应用.ʌ作业设计ɔ完成教材P68第1㊁2㊁3㊁6题6结束语本节课由自然界的水展开ꎬ了解水的重要性ꎬ引发学生共情ꎬ使学生从生活世界走进化学世界.了解pH在日常生活生产中的应用时ꎬ以学生熟悉的问题展开ꎬ激发学生学习欲望ꎬ并在这一过程中体会化学科学的社会价值.本节课通过科学史话㊁动画模拟等引导学生从宏观(水能导电)到微观(水能电离)ꎬ从理论(水的电离平衡移动方向)到实际(溶液酸碱性的变化)视角进行原理揭示ꎬ并用框图的形式对这一认识思路显性化ꎬ学生按此认识思路就能够进行迁移.参考文献:[1]中华人民共和国教育部.普通高中化学课程标准(2017年版)[M].北京:人民教育出版社ꎬ2018.[责任编辑:季春阳]031。
沉淀溶解平衡

第3节沉淀溶解平衡学习目标1.能描述沉淀溶解平衡,知道沉淀转化的本质2.知道溶度积并利用溶度积进行简单的计算3.熟悉溶度积与溶解度的相互换算。
知识梳理1.象碳酸钙、氢氧化镁这样的电解质,尽管在水中难以溶解,但它们在水中会建立一种___________________________,即沉淀溶解平衡。
2.沉淀溶解平衡的研究对象是__________特点是_______________________。
一定温度下,难溶电解质在水中达到平衡时,也存在着一个平衡常数,叫做____________或____________,用符号_________表示,溶度积只与____________和_____________有关,与________无关,反映了物质在水中的__________。
对于难溶物电解质Am Bn在水溶液中的沉淀溶解平衡,可以表示为:AmBn(s) mA n+(aq)+nB m-(aq)Ksp=_______________________影响沉淀平衡的因素有______________________________________。
3.由一种沉淀转化为另一种沉淀的过程称为________________,若难溶解电解质类型相同,则Ksp ___________的沉淀易于转化为Ksp_________的沉淀;根据溶度积常数Ksp与浓度商QC 的关系可以判断沉淀溶解平衡移动的规律,对于难溶电解质AmBn,浓度商QC表示为:QC= [A n+] m[B m-]n若QC <Ksp_______________________________________________________,若QC =Ksp_______________________________________________________,若QC >Ksp_______________________________________________________。
“基于学科核心素养的高中化学教学评一致性研究”课题开题报告

“基于学科核心素养的高中化学教学评一致性研究”课题开题报告“基于学科核心素养的高中化学教学评一致性研究”课题开题报告一、核心概念1.素养:素养是个体在特定的情境下能成功地满足情境的复杂要求与挑战,并能顺利地执行生活任务的内在先决条件。
素养是在个体与情境的有效互动中生成的,这些情境包括家庭、健康、消费、休闲、职场、教育与训练,以及社区和公共领域等。
素养与情境因素是相互呼应的,不同的情境所要求的素养组合也有所不同。
[?][i]2.化学学科核心素养:本课题研究的学科核心素养特指高中化学课程蕴含的化学学科核心素养。
在最新的《普通高中化学课程标准框架》中,第一次提到了化学学科核心素养的概念,认为化学学科核心素养是科学素养在化学课程中的具体体现,是学生具有化学学科特质的关键能力和品格,学生通过普通高中阶段的化学教育,在“科学认识与观念”、“科学思维和方法”、“科学探究与实践”、“科学态度与价值观”等方面全面发展的具体要求,即为化学学科核心素养[?][ii]。
高中化学核心素养是学生发展全面素养的重要组成部分。
学生通过高中化学课程的学习,在知识与技能、过程与方法、情感态度和价值观等方面全面发展,进而形成化学学科的核心素养。
高中学生的化学核心素养一般包括“宏微结合”“分类表征”“变化守恒”“模型认知”“实验探究”“绿色应用”等要素,具体有待课题研究进一步细化和确定。
3.化学学科素养表现:是指学生在化学课程学习过程中表现出来的比较稳定的学科心理特征和行为特征,是可观察的和外显的化学学习质量和学习结果。
化学学科素养表现是学生在化学学科学习中学业成就或学习质量的重要组成部分。
基于学生的知识学习和认知活动,学生的学科素养表现往往体现为由内隐的学科思维过程和外显的学科行为反应决定的学科素养。
一般来说,化学课程的学科核心素养表现包括科学观察、科学实验、科学探究与问题解决能力等[?][iii]。
化学学科素养表现是化学学科的核心能力表现,是最能体现化学学科性质的维度。
二、学科核心素养与课程目标——2017年版《普通高中课程标准》化学(word文档)

(一)学科核心素养学科核心素养是学科育人价值的集中体现,是学生通过学科学习而逐步形成的正确价值理念、必备品格和关键能力。
高中化学学科核心素养是高中学生发展核心素养的重要组成部分,是学生综合素质的具体体现,反映了社会主义核心价值观下化学学科育人的基本要求,全面展现了化学课程学习对学生未来发展的重要价值。
化学学科核心素养包括“宏观辨识与微观探析”“变化观念与平衡思想”“证据推理与模型认知”“科学探究与创新意识”“科学态度与社会责任”5个方面。
素养1 宏观辨识与微观探析能从不同层次认识物质的多样性,并对物质进行分类;能从元素和原子、分子水平认识物质的组成、结构、性质和变化,形成“结构决定性质”的观念。
能从宏观和微观相结合的视角分析与解决实际问题。
素养2 变化观念与平衡思想能认识物质是运动和变化的,知道化学变化需要一定的条件,并遵循一定规律;认识化学变化的本质是有新物质生成,并伴有能量的转化;认识化学变化有一定限度、速率,是可以调控的。
能多角度、动态地分析化学变化,运用化学反应原理解决简单的实际问题。
素养3 证据推理与模型认知具有证据意识,能基于证据对物质组成、结构及其变化提出可能的假设,通过分析推理加以证实或证伪;建立观点、结论和证据之间的逻辑关系。
知道可以通过分析、推理等方法认识研究对象的本质特征、构成要素及其相互关系,建立认知模型,并能运用模型解释化学现象,揭示现象的本质和规律。
素养5 科学态度与社会责任具有安全意识和严谨求实的科学态度,具有探索未知、崇尚真理的意识;深刻认识化学对创造更多物质财富和精神财富、满足人民日益增长的美好生活需要的重大贡献;具有节约资源、保护环境的可持续发展意识,从自身做起,形成简约适度、绿色低碳的生活方式;能对与化学有关的社会热点问题作出正确的价值判断,能参与有关化学问题的社会实践活动。
上还5个方面立足高中学生的化学学习过程,各有侧重,相辅相成。
“宏观辨识与微观探析”“变化观念与平衡思想”“证据推理与模型认知”要求学生形成化学学科的思想和方法;“科学探究与创新意识”从实践层面激励学生勇于创新;“科学态度与社会责任”进一步揭示了化学学习更高层次的价值追求。
2017年核心素养版《普通高中化学课程标准》解读(2018年2月)

2003年的《普通高中化学课程标准(实验)》的前言部分,对化学学科的含义、特点与作用进行了明确的描述,准确定位了化学课程标准,明确了化学学科在高中教育中的地位和作用,有利于调动化学教师的教学积极性。
2017年版《普通高中化学课程标准》的前言部分肯定了03版的作用和贡献,同时提出面对新时代社会的变化和要求以及我国高中阶段教育基本普及的新形势,普通高中课程方案和课程标准实验稿还有一些不相适应和亟待修订改进之处。
2017年版《普通高中化学课程标准》前言部分主要是对两个方面进行了阐述。
一、修订工作的指导思想和基本原则2.基本原则(1)坚持正确的政治方向。
(2)坚持反映时代要求。
(3)坚持科学论证。
(4)坚持继承发展。
二、修订的主要内容和变化1.普通高中课程方案主要变化■进一步明确了普通高中教育的定位针对长期以来存在的片面追求升学率的倾向,强调普通高中教育是在义务教育基础上进一步提高国民素质、面向大众的基础教育,不只是为升大学做准备,还要为学生适应社会生活和职业发展做准备,为学生的终身发展奠定基础。
普通高中培养目标是进一步提升学生的综合素质,着力发展核心素养,使学生具有理想信念和社会责任感,具有科学文化素养和终身学习能力,具有创新精神和实践能力,具有自主发展能力和沟通合作能力。
■进一步优化了课程结构一是保留原有学习科目,在英语、日语、俄语基础上,增加德语、法语和西班牙语。
二是将课程类别调整为必修课程、选择性必修课程和选修课程。
在保证共同基础的前提下,为不同发展方向的学生提供有选择的课程。
三是进一步明确各类课程的功能定位,与高考综合改革相衔接:必修课程根据学生全面发展需要设置,全修全考;选择性必修课程根据学生个性发展和升学考试需要设置,选修选考;选修课程由学校根据实际情况统筹规划开设,学生自主选择修习,可以学而不考或学而备考,为学生就业和高校自主招生录取提供参考。
四是合理确定各类课程学分比例,在毕业总学分不变的情况下,对原必修课程学分进行重构,由必修课程学分、选择性必修课程学分组成,适当增加选修课程学分,既保证基础性,又兼顾选择性。
基于学科核心素养的化学概念教学
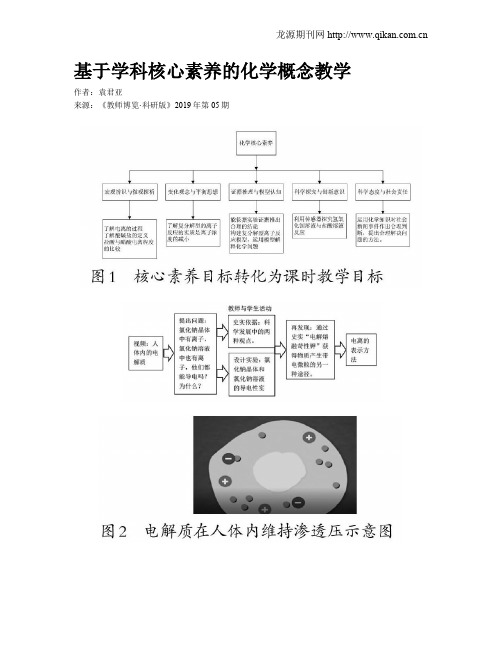
基于学科核心素养的化学概念教学作者:袁君亚来源:《教师博览·科研版》2019年第05期[摘要] 《普通高中化学课程标准(2017年版)》明确指出学科核心素养是学科育人价值的集中体现,是学生通过学科学习而逐步形成的正确价值观念、必备品格和关键能力。
在化学概念的教学中需要培养学生的核心素养,以“离子反应”的教学为例进行具体说明。
通过情境创设了解酸碱盐的电离;归纳总结电解质的概念;探究分析不同电解质的电离程度不同;实验探究获得复分解反应型离子反应的实质;运用概念解决实际问题。
[关键词] 学科核心素养;概念教学;离子反应化学概念是中学化学最基础、最关键、最核心的内容,是学生学好化学知识的首要前提,它是人们对化学研究最本质的概括和认识,深刻反映了过程中最本质的化学特征。
[1]一、教学内容分析“离子反应”是人教版化学必修1第二章第二节内容,是中学化学重要的基础概念之一。
《普通高中化学课程标准(2017年)》中对本节内容的要求是:认识酸、碱、盐等电解质在水溶液中或熔融状态下能发生电离。
此前,在九年级化学教学中介绍了常见的酸、碱、盐的组成及其性质,并且学习了复分解反应,知道复分解反应的条件是生成沉淀、气体和水,这是对水溶液中复分解反应的宏观认识,但是,学生对电解质在水溶液中的存在状态及行为还缺乏足够的理解和认识,对水溶液中物质的认识还没有深入到微观这一层面,对复分解反应的微观实质还不太清楚,不能从微观的角度分析离子的存在以及离子之间的相互作用,欠缺研究微观问题的方法和思路。
因此本节内容在此基础之上,由宏观到微观,揭示酸、碱、盐在水溶液中的变化本质——电离,从微观粒子作用观的角度剖析复分解反应的实质,从微粒的存在到离子之间的相互作用再到离子之间相互作用的结果,深刻理解水溶液中物质发生复分解反应的微观实质,建立研究水溶液中物质反应的新思路和新视角。
二、基于化学核心素养的教学目标分析高中化学学科核心素养包括“宏观辨识与微观探析”“变化观念与平衡思想”“证据推理与模型认知”“科学探究与创新意识”“科学态度与社会责任” 5个方面:1.通过“电离理论”化学史的学习,了解酸、碱、盐电离成自由移动离子的过程。
基于“变化观念与平衡思想”的高中化学教学策略——以“难溶物沉淀溶解平衡”教学为例
2021·04文章以“难溶物沉淀溶解平衡”的教学为例,通过创设真实情境,让学生感知化学变化;通过实验教学,帮助学生建构变化观念;通过深度探究,帮助学生完善变化观念并形成平衡思想;通过知识的迁移和应用,深度发散学生思维,建构完整的知识体系,提升学生的问题解决能力,进而培育学生化学核心素养。
摘要关键词变化观念;平衡思想;核心素养;实验教学;溶解平衡“变化观念与平衡思想”是化学学科核心素养之一,是学生对化学变化过程的综合认识。
为培养学生的化学变化观念与平衡思想,苏教版普通高中化学教材不但在必修2中设置了“化学反应与能量变化”,还开设了《化学反应原理》课程。
教学中化学知识的学习必须通过相关问题的设置和实验进行引导,让学生的创新意识得到提高,创新思维得到深化,还应该将所学知识运用到实践中,起到解决实际问题的作用,以培养学生的综合素养。
教师在课堂教学中,应围绕变化观念与平衡思想,选取合适的教学内容,落实学科素养教育。
一、“变化观念与平衡思想”的涵义研究化学中物质之间的相互转化的基本观念就是中学化学的变化观念,化学变化过程又涉及有关平衡问题,变化观念与平衡思想是动态的组织机构。
高中化学变化观念与平衡思想核心素养的内涵包括:(1)在一定条件下,物质能遵循一定的规律在不断地运动和变化的。
(2)化学变化是可以调控的,且有一定的速率和限度并生成新物质。
(3)能多角度、多元化的分析问题,在一些预设的条件下能预测可能产生的结果。
(4)能揭示物质间相互反应的内在联系与变化规律[1]。
总之,“变化观念与平衡思想”是学生对化学变化过程的综合认识。
教师要让学生能够认识化学反应是一个形成新物质的过程,在变化过程中可通过创造一些条件让反应达到原先预期的目的来助力社会发展,能借助变化观念去理清化学变化的本质,能够运用已掌握的变化规律去解决问题,能用变化观和平衡观对社会现象做出正确的价值判断。
难溶电解质的沉淀溶解平衡是建立在学生已知的化学平衡、弱电解质的电离平衡的基础上进一步学习的,有助于学生形成系统的离子平衡理论,[2]动态认识沉淀溶解平衡,多角度的分析有难溶电解质参加反应或生成离子反应的本质,进一步发展学生的变化观和平衡观。
学科核心素养发展导向的高中化学课程内容和学业要求——《普通高中化学课程标准(2017年版)》解读
发布时间 : 2023/1/13 19:54:11 星期五文章解读——2017年版《普通高中课程标准》化学解读更新完毕开始阅读新修订的2017版课程标准,增加了“学业质量”部分,明确学生完成本学科学习内容后,学科核心素养应达到的等级水平,提出了“学业质量”标准。
“学业质量”是对学生多方面发展状况的综合衡量,明确了新的质量观,改变过去单纯看知识、技能的掌握程度。
分为“学业质量内涵”“学业质量水平”和“学业质量水平与考试评价的关系”三个方面。
3.学业质量水平是考试与评价的重要依据。
学业质量水平2是高中毕业生在本学科应该达到的合格要求,是化学学业水平合格性考试的命题依据;学业质量水平4则是化学学业水平等级性考试的命题依据。
学业质量标准把学业质量划分为不同水平,帮助教师更好地把握教学要求,因材施教,更加关注育人目标的有效落实。
因为学业质量已经划分出层次了,那么命题的时候,根据考试的不同类型,高考还是学业水平考试,考试的类型层次不一样,那就对应质量水平的层次,把它对接好,实际上要真正做到难易的程度是可控的。
这样划分完之后,高考、学业水平考试将来都要变成真正的水平考试。
就是说,学生一门学科学完之后,到底达到了什么样的水平和层次,跟其他的同学没有关系,关键是学生本人在该学科到底学到什么样的程度了,掌握没掌握?掌握到什么程度?这样教学、人才的选拔,我们心中就有数了。
2017年版的实施建议由2003年实验版的四部分(教学建议、评价建议、教科书编写建议、课程资源的开发与利用建议)调整为了(一)教学与评价建议、(二)学业水平考试与命题建议、(三)教材编写建议、(四)地方和学校实施本课程的建议,共四个部分;新增了学业水平考试与命题建议,其他几个部分也进行了调整。
(一)教学与评价建议2017年版(一)教学与评价建议 1.深刻领会化学学科核心素养的内涵,科学制订化学教学目标 2.准确把握学业质量标准,合理选择和组织化学教学内容一、教学建议 1.尊重和满足学生发展需要,指导学生自主选择课程模块 2.把握不同课程模块的特点,合理选择教学策略和教学方式。
解读03学科核心素养与课程目标——2017年版《普通高中课程标准》化学解读
原创精品资源学科网独家享有版权,侵权必究!
1
1.学科核心素养
(1)化学学科核心素养概要
●学科基础知识是学生发展化学学科核心素养的载体
化学学科基础知识是化学课程的主体。
化学课程标准根据学生的认知能力、水平和学生个性化发展需要确定课程的主题、模块和系列,这些主题、模块和系列都依托化学基础知识将其科学、有效地融合在一起。
学生在学习化学基础知识的进程中,逐步形成并发展其化学学科核心素养。
例如,“宏观辨识与微观探析”要求学生能从宏观和微观相结合的视角分析和解决实际问题。
学生通过必修“主题3:物质结构基础和化学反应规律”的学习,建立“宏观辨识与微观探析”的基本意识;在选修“物质结构与物质”模块的。
基于学科(化学)核心素养的价类二维图在元素化合物学习中的运用—以《硫及其化合物的性质复习》教学为例
基于学科(化学)核心素养的价类二维图在元素化合物学习中的运用—以《硫及其化合物的性质复习》教学为例内容摘要:元素化合物知识的学习是中学(高中)化学基础知识的主要内容,也是发展学生化学学科核心素养的重要载体。
但其内容繁多学生遗忘性大,本文通过价类二维图,引导学生自主有条理地列举出硫元素各类别的典型代表物,并从类别分析其通性,从价态分析其氧化还原性质,直接在图上标识和推导物质类别和元素价态的转化,实现了分类观和氧化还原观等抽象原理的可视化。
价类二维图构建的过程是学生将知识整理内化的过程,同时在构建模型的过程中加深了化学核心素养之一证据推理和模型认知的学习和理解,体会建模在化学学习中的价值与应用。
关键词价类二维图元素化合物认知模型可视化元素化合物知识是高中化学基础知识的重要组成部分,也是发展和提升学生化学学科核心素养的重要载体。
《普通高中化学课程标准(2017 年版)》中提到“常见无机物及其应用”,作为必修课程的五大主题之一[1],说明元素化合物学习在学生化学学习中占有重要的地位。
一、价类二维图实现抽象思维的可视化在高中化学的学习中,元素化合物的性质多而散,学生想要更好地掌握元素化合物性质就必须形成相关的思维模型,其中分类观和氧化还原观是我们学习元素化合物性质的两大有效工具,贯穿整个高中阶段元素化合物的学习。
但对学生而言,分类观尤其是氧化还原观都属于抽象思维,学生在解题过程中,无法第一时间在脑海中想起运用分类观和氧化还原观来解决问题。
以物质类别为横坐标元素化合价为纵坐标的价类二维图是物质转化观和分类观的直观图像,通过价类二维图可以引导学生自主、有条理地列举出该元素各类别的典型代表物,并能从类别分析其通性,从价态分析其氧化还原性质,直接在图上标识和推导物质类别和元素价态的转化,很好地实现了分类观、氧化还原观的可视化。
借助价类二维图将抽象思维可视化,不仅能让学生在运用抽象思维去分析解决问题时有了可操作性强的抓手,更可以提高课堂思维含量,并能使学生分析问题的思维过程外显,利于教师根据学生的外显思维进行授课方向和授课内容的调整,以此促进教学,达到元素化合物复习的增质和提效。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
基于化学学科核心素养的“难溶电解质的溶解平衡”教学设计罗明月李远蓉*(西南大学化学化工学院重庆400715)摘要:文章基于化学学科核心素养,对高中化学《选修四》“难溶电解质的溶解平衡”第二课时进行教学设计。
在分析该课时内容的基础上,寻找出与化学学科核心素养的契合点,以先行组织者策略为指导,遵循“易溶电解质的溶解平衡-难溶电解质的溶解平衡-沉淀的转变”的设计思路进行教学设计。
整个教学设计以实验探究层层深入,将“变化观念与平衡思想”渗透于整个教学过程中,揭示溶解平衡的内部联系与外在表现之间的相互联系。
学生则通过观察宏观实验现象对微观物质的运动进行推理、论证,培养其“科学探究”与“证据推理”的能力,从而促进其化学学科核心素养的形成。
关键词:化学核心素养教学设计难溶电解质的溶解平衡1 问题的提出2015年1月,我国普通高中学科课程标准开始重新修订,标志着我国基础教育课程改革进入新的发展阶段。
面对信息时代对学校教育提出的挑战,我国借鉴国际课程改革的先进经验,将“核心素养”作为课程改革的出发点和归宿[1]。
而学科核心素养是学生在该学科(或特定学习领域)学习过程中取得的能体现学科本质特征的关键成就[2]。
在核心素养的框架下,化学学科提出将“宏观辨识与微观探析、变化观念与平衡思想、证据推理与模型认知、实验探究与创新意识、科学精神与社会变化”作为化学核心素养。
旨在以化学学科为载体,培养学生的核心素养。
“基于核心素养的课程发展意味着,无论是课程开发者抑或一线教师都需要在‘核心素养—课程标准( 学科素养/跨学科素养) —单元设计—学习评价’这一连串环环相扣的链环中聚焦核心素养展开运作”[3]。
教学设计是教学实施的蓝图,因此,基于学科核心素养的教学设计无疑是落实学科核心素养重要而不可缺或的环节。
2 教学素材的教育价值及功能分析2.1 课标要求课标作为化学教学的纲领性文件,对于课程目标、课程内容、教学方法、教学评价等具有指导作用。
在高中化学课程标准中,《化学反应原理》模块分为3个主题。
即主题1-化学反应与能量,主题2-化学反应速率与化学平衡,主题3-溶液中的离子平衡。
“难溶电解质的溶解平衡”是主题3中的内容。
梳理初高中《标准》[4]不难看到,在义务教育和高中选修阶段都涉及到了部分的相关内容,具体要求如下:表1 《标准》对“难溶电解质的溶解平衡”的要求从《标准》中可以看出,在义务教育阶段,学生就已经从定性和定量的角度认识了物质的溶解性,但对沉淀-溶解的认识是单向的、静态的。
在高中选修阶段则要求从平衡、动态、变化的角度理解沉淀的溶解,转化过程。
从《标准》对本节内容的活动探究建议可以发现,*通信联系人,E-mail:**************.cn我们可以利用生活中的相关素材来培养学生发现问题,解决问题的能力并且要求学生能够利用所学知识来解释生活中的一些现象或是解决问题。
教材是教师在授课时的直接参考资料,教材中的教学素材对于课堂教学的实施起着至关重要的作用。
对人教版、鲁科版、苏教版中所涉及到的教学素材及其功能分析统计如表2 所示:表2 三版教材中涉及的《难溶电解质的沉淀溶解平衡》教学素材对比人教版、鲁科版、苏教版三个版本的教材,都给出了沉淀溶解平衡原理、沉淀平衡的应用、沉淀的转化三大板块的教学内容,以期能实现课标中“能描述沉淀溶解平衡,知道沉淀转化的本质”的内容标准。
由此可知,沉淀溶解平衡与沉淀的转化是本节内容的核心知识,而沉淀平衡的应用则是对本节内容的综合应用。
对于沉淀-溶解平衡原理,鲁科版与苏教版教材均通过实验证明了难溶电解质溶液在一定的条件下存在沉淀-溶解平衡。
因此,从教学素材的功能看,鲁科版与苏教版的素材旨在激发学生的学习兴趣,培养学生的科学探究能力。
而人教版则是开门见山,通过列举几种物质的溶解性,以数据引发学生的思考。
再以AgCl为例,深入讲解了沉淀溶解平衡。
对于沉淀的转化,3个版本的教材都将其隶属于沉淀溶解平衡的应用中,均给出了不同的活动探究实验来说明沉淀转化的原理和条件,且列出沉淀平衡的实际应用并且解释其应用原理。
根据以上的教学素材分析可知,虽然3个版本教材的编排方式和设计活动有所不同,但其教学素材都体现出了沉淀溶解平衡的原理、变化、应用。
且主要蕴含了“变化观念与平衡思想”的学科核心素养,教材中的活动探究又可以培养学生的“实验探究与证据推理”的能力,这些都体现了化学学科特有的思想和方法。
3 学情分析表3 学情分析根据先行组织者策略[5]可知,难溶电解质的溶解平衡相对于化学平衡是属于下位组织者,而相对于易溶电解质的溶解平衡属于并列组织者,学生在本章第一节已学习过易溶电解质的结晶-溶解平衡。
因此,本文先通过易溶电解质的溶解平衡类比引入,并以化学平衡概念进行总结、归纳。
最后,学生便自然的将难溶电解质的溶解平衡这一内容整合到已学过的化学平衡这一上位概念中。
5.1 由旧引新,建立易溶电解质的溶解平衡【问题情境1】如果想从饱和的NaCl 溶液中得到NaCl 固体,可以采用什么样的方式?在这个过程中导致NaCl 固体形成的实质是什么?请从化学平衡移动的角度思考。
【思考与交流1】从初中所学知识出发,可以通过蒸发,降温的方式。
【问题驱动】从平衡移动的角度思考,蒸发和降温是怎样使得饱和NaCl溶液结晶的?【总结提问】从平衡移动的角度思考,蒸发即增大了溶液中Na+、Cl-的浓度,使溶解结晶平衡向离子浓度减小的方向(逆方向)进行。
降温亦是使平衡向逆方向进行。
如果向饱和NaCl 溶液中加入浓HCl,结果会怎样呢?请用实验证明。
【学生实验1】提供给学生饱和的NaCl溶液、浓盐酸HCl、烧杯、滴管等实验仪器。
学生通过实验发现,向饱和的NaCl中滴加浓HCl后,溶液中有沉淀生成。
【总结归纳】通过加入与NaCl溶液相同的离子的酸(或碱、盐),从而使NaCl的溶解度降低的现象被称为同离子效应。
【拓展应用】展示同离子效应在工业处理含氟废水时的应用。
设计意图:学生在初中阶段知道蒸发、降温的方式可以使饱和溶液析出晶体,但不知道变化的实质是什么。
而实际上,蒸发、降温相当于平衡移动原理中的降低浓度、改变温度。
此问题情境由旧知引出新知,从事物的本质出发,将新旧知识重组,优化学生的认知结构。
让学生学会用化学平衡原理去分析问题。
5.2 从宏观-微观,揭示平衡内部联系与外在表现之间的相互关系【问题情境2】通过以上实验证明了在易溶电解质中存在着沉淀-溶解平衡,如果是在难溶电解质中呢?存在沉淀溶解平衡吗?【思考与交流2】阅读教材P61中的思考与交流,谈谈你对“溶”与“不溶”的理解。
【小结归纳】“溶”与“不溶”只是相对的,没有绝对的不溶的物质。
根据物质的溶解度大小可以分为易溶、可溶、微溶、难溶。
接下来,我将提供给大家AgNO3、KSCN、FeCl3,请大家交流思考,并证明难溶电解质中存在溶解平衡吗?已知AgSCN为白色沉淀,Fe(SCN)3为红色络合物。
【学生实验2】向AgNO3加入等量的KSCN,再取其上清液,向其中加入FeCl3发现有血红色物质生成,极易推测出此红色物质便是Fe(SCN)3,说明在AgSCN沉淀中存在着SCN-。
再向血红色溶液中加入AgNO3,红色沉淀又变为无色。
此过程即为增大沉淀中某种离子的浓度,平衡即向逆方向进行。
说明平衡的变化性、动态性。
【学生活动】阅读教材中的资料,了解化学沉淀法废水处理工艺示意图。
设计意图:通过AgSCN的沉淀、SCN-的检测、AgSCN的再沉淀,溶液的颜色由白色-红色-无色。
颜色变化给学生带来的宏观视觉上的冲击,恰到好处的揭示了整个过程中溶液中平衡的变化过程,将平衡的内部变化与外在表现联系起来,给学生留下深刻的印象。
5.3 沉淀的溶解与转化,培养其对立统一的哲学思想【问题情境3】通过实验2可以得知,向沉淀的饱和溶液中加入其中一种离子可以导致该溶液再沉淀。
从化学平衡的角度思考,即增大该溶液中离子的浓度,平衡便会朝着减小该溶液中离子浓度的方向进行。
如若减小溶液中电离出的离子浓度呢?会有什么样的现象?以Mg(OH)2的饱和溶液为例。
【思考与交流】学生经分析后,很容易得知减小溶液中某种离子的浓度,平衡将会朝着该离子浓度增大的方向移动,即沉淀的溶解。
【问题驱动】有什么样的方式可以改变Mg(OH)2中某种离子的浓度呢?【思考与交流】学生思考后得出,可以通过减小Mg2+或OH-的浓度来进行实验探究,可以通过将Mg2+沉淀的方式减小Mg2+的浓度,而减小OH-的浓度既可以形成弱电解质NH3·H2O,也可以形成沉淀的方式。
【问题驱动】为便于观察,最佳的实验方案应该是哪一个?【思考与交流】如果选择沉淀Mg2+,新生成的沉淀与Mg(OH)2的颜色相同,即便是有新生成的沉淀,势必会影响观察,实验现象不明显。
为便于观察,学生很容易便会选择形成有颜色Fe(OH)3。
或是形成NH3·H2O,可以观察到沉淀的减少。
【学生实验3】提供MgCl2、NaOH、NH4Cl、FeCl3,引导学生进行Mg(OH)2的溶解与转化实验,并完成表3。
通过实验,学生发现滴加NH4Cl与FeCl3都减小溶液中OH-的浓度。
滴加NH4Cl导致了沉淀的溶解,滴加FeCl3却是导致了沉淀的转化,其实质都是平衡的移动。
表4 Mg(OH)2的溶解和转化实验2323是否是任意一种沉淀都可以转化为其阴阳离子所构成另一种沉淀呢?请大家设计一个最简单实验证明。
【思考与交流】学生通过思考与交流得出,解决此问题最佳方式是通过向Fe(OH)3中滴加MgCl2,观察红色沉淀是否会转化为白色沉淀。
【学生实验】通过实验可以发现,向Fe(OH)3中滴加少量的MgCl2时,沉淀并不会转化,但当MgCl2的浓度较大时,部分Fe(OH)3沉淀也会转化为Mg(OH)2【拓展应用】加热可使天然水产生MgCO3沉淀,但是镁在水垢中却主要以Mg(OH)2的形式存在,请查阅资料并分析,水垢中的Mg(OH)2是怎样生成的?设计意图:从沉淀溶解和沉淀转化的实质出发设计探究实验,学生通过实验从本质上理解了沉淀的溶解和转化都是平衡的移动。
进一步理解了沉淀-溶解平衡中蕴含的平衡与变化思想,并且学会了运用化学平衡原理来分析沉淀-溶解平衡。
通过设计实验,亦培养学生的探究能力和证据推理能力。
而沉淀与沉淀之间的相互转化,亦是培养了学生事物是相对的对立统一的思想。
6 教学设计反思6.1 研究不足本教学设计暂时还处于理论设计阶段,未进行教学实践。
因此,实际教学效果还有待考察,后期笔者将会对此教学设计进行教学实践,并针对其中的不足进行改进。
6.2 设计特色本教学设计结合三版教材中的教学素材,将难溶电解质的溶解平衡一节知识与实验进行有机整合。
将化学平衡思想贯穿整个教学设计中。
学生通过实验设计、将难溶电解质的沉淀、溶解、转化建构到自己的原有的知识体系中。
