成年小鼠心脏灌流
小鼠实验心脏实验报告

一、实验目的1. 了解心脏生理学的基本知识,掌握心脏功能实验的基本操作技能。
2. 探讨心脏在生理和病理状态下的功能变化,为心脏疾病的研究提供实验依据。
二、实验原理心脏是维持血液循环的泵,具有收缩和舒张功能。
通过实验,可以观察心脏在生理和病理状态下的功能变化,如心率、心输出量、心肌收缩力等。
三、实验材料与仪器1. 实验动物:成年雄性小鼠,体重20-25g。
2. 仪器:手术显微镜、心室灌流装置、生理信号记录仪、电子天平、注射器、手术刀、缝针、缝线、生理盐水、0.1%肝素钠溶液、10%福尔马林固定液等。
四、实验方法1. 动物麻醉:将小鼠用麻醉剂(如戊巴比妥钠)进行麻醉,保持动物呼吸平稳。
2. 心脏暴露:在手术显微镜下,沿小鼠左侧第四肋间进行开胸手术,暴露心脏。
3. 心脏固定:将心脏用缝线固定在心室灌流装置上。
4. 心肌收缩力测定:向心室灌流装置中注入0.1%肝素钠溶液,排除血液,然后注入生理盐水进行灌流。
使用生理信号记录仪记录心脏的收缩曲线,计算心肌收缩力。
5. 心输出量测定:记录心脏在灌流过程中,单位时间内通过心脏的血液量。
6. 心率测定:观察心脏在灌流过程中的跳动频率。
7. 实验结果分析:对实验数据进行统计分析,比较不同处理组之间的差异。
五、实验结果1. 生理状态下,小鼠心脏的收缩曲线呈规律性波动,心肌收缩力、心输出量和心率均处于正常范围。
2. 在病理状态下,小鼠心脏的收缩曲线出现异常,心肌收缩力降低,心输出量和心率下降。
3. 与对照组相比,病理组小鼠心脏的收缩曲线、心肌收缩力、心输出量和心率均有明显差异。
六、实验讨论1. 本实验通过观察小鼠心脏在生理和病理状态下的功能变化,为心脏疾病的研究提供了实验依据。
2. 实验结果表明,心脏在病理状态下,其功能受到严重影响,表现为心肌收缩力降低、心输出量和心率下降。
3. 本实验结果与相关文献报道一致,为心脏疾病的研究提供了参考。
七、实验结论1. 心脏在生理和病理状态下具有不同的功能变化。
小鼠灌注固定实验报告

一、实验目的1. 掌握小鼠灌注固定技术的基本原理和操作方法。
2. 了解灌注固定对组织学研究的意义。
3. 提高实验操作的熟练度和规范性。
二、实验原理灌注固定是利用动物自身的循环系统,将固定液输送到全身各个器官和组织,使组织得到均匀固定,以便于后续的组织学研究和病理学诊断。
本实验采用心脏灌注固定法,通过将固定液直接注入心脏,使固定液在短时间内迅速流经全身,实现快速、均匀的固定效果。
三、实验材料1. 实验动物:成年健康小鼠(体重约20-25g)。
2. 试剂:2%戊巴比妥钠麻醉剂、生理盐水、4%多聚甲醛固定液、肝素钠。
3. 用具:注射器(10ml)、头皮针、手术剪、眼科剪、止血钳、手术刀片、镊子、剪刀、解剖板、剪刀、手术剪、注射器、生理盐水、固定液、酒精、棉球等。
四、实验步骤1. 麻醉:将小鼠用2%戊巴比妥钠进行腹腔注射,剂量为0.0046ml/g(按体重),待小鼠麻醉后固定在解剖板上。
2. 开胸:在胸部左侧进行手术,剪开皮肤、肌肉和肋骨,暴露心脏。
3. 灌注:将头皮针插入心脏,通过心脏将固定液(4%多聚甲醛)注入小鼠体内。
灌注量约为20-30ml,灌注速度控制在每分钟2-3ml。
4. 固定:将小鼠放入固定液中浸泡,浸泡时间为4-6小时。
5. 取材:取出固定好的小鼠,去除皮肤、肌肉等非研究组织,取所需研究部位的组织。
6. 固定:将取出的组织放入固定液中,继续固定24小时。
7. 石蜡包埋:将固定好的组织进行石蜡包埋,切片。
8. 染色:将切片进行染色处理,如苏木精-伊红染色。
9. 观察:在显微镜下观察组织切片,分析实验结果。
五、实验结果通过小鼠灌注固定实验,成功固定了小鼠的组织,并进行了切片、染色和观察。
实验结果显示,组织结构清晰,细胞形态良好,为后续的组织学研究提供了良好的材料。
六、实验讨论1. 灌注固定是组织学研究的重要技术之一,能够保证组织结构的完整性和细胞形态的清晰度。
2. 本实验采用心脏灌注固定法,操作简便,固定效果良好。
大鼠灌注固定的方法
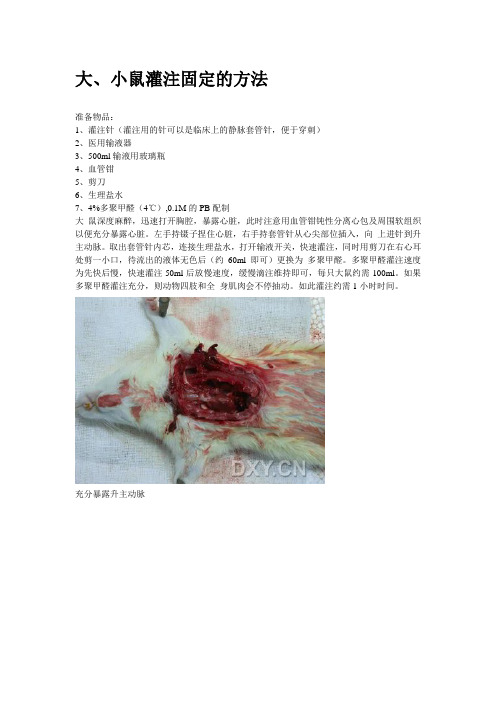
大、小鼠灌注固定的方法准备物品:1、灌注针(灌注用的针可以是临床上的静脉套管针,便于穿刺)2、医用输液器3、500ml输液用玻璃瓶4、血管钳5、剪刀6、生理盐水7、4%多聚甲醛(4℃),0.1M的PB配制大鼠深度麻醉,迅速打开胸腔,暴露心脏,此时注意用血管钳钝性分离心包及周围软组织以便充分暴露心脏。
左手持镊子捏住心脏,右手持套管针从心尖部位插入,向上进针到升主动脉。
取出套管针内芯,连接生理盐水,打开输液开关,快速灌注,同时用剪刀在右心耳处剪一小口,待流出的液体无色后(约60ml即可)更换为多聚甲醛。
多聚甲醛灌注速度为先快后慢,快速灌注50ml后放慢速度,缓慢滴注维持即可,每只大鼠约需100ml。
如果多聚甲醛灌注充分,则动物四肢和全身肌肉会不停抽动。
如此灌注约需1小时时间。
充分暴露升主动脉套管针从心尖部位插入,向上进针到升主动脉1、暴露心脏时要小心,速度要快,但不可损伤心脏及大血管,如果出现血液凝固或大血管损伤,灌流将失败。
2、最好是剖开右心室,但是因为暴露的问题,有误剪到左心室的可能。
相对来说,剪开右心耳更为方便。
我们就是这样做的。
3、灌流的效果:PBS或NS灌流时,血流丰富的脏器如肝脾肾等的颜色会迅速转为灰白,此为灌流正常。
另外,大鼠耳尖,口唇,四肢掌部也会变苍白。
4、PBS或NS灌流需缓慢而持续,防止血液血管内凝固。
有条件的话可加点肝素。
5、先主动脉插管,再右心耳放血,这样插管容易些。
先剪右心耳的话,心脏会瘪下去的。
小鼠灌注固定方法:采用水合氯醛麻醉后剪开胸腔,动作要快,经左心室插入头皮针连接的20 mL注射器(头皮针磨钝,从与身体纵轴成45°角的方向进针,针尖插入升主动脉内,可以看见,动作要轻柔),同时剪开右心耳,推入20 mL 生理盐水。
推完以后迅速换4 ℃多聚甲醛20 mL,灌完以后取材基本就可以了。
小鼠缺血再灌注

小鼠缺血再灌注(实用版)目录1.小鼠缺血再灌注的背景和意义2.小鼠缺血再灌注的实验方法和操作步骤3.小鼠缺血再灌注的实验结果和分析4.小鼠缺血再灌注的结论和展望正文一、小鼠缺血再灌注的背景和意义小鼠缺血再灌注是指在小鼠体内某一部位发生缺血后,再通过灌注使其恢复血流。
这一过程在生物医学研究中具有重要意义,因为它可以模拟人类某些疾病的发生过程,如心肌梗死、脑卒中等。
通过研究小鼠缺血再灌注,可以深入了解缺血后再灌注对组织和器官的影响,为临床治疗提供理论依据。
二、小鼠缺血再灌注的实验方法和操作步骤1.实验动物选择:选用健康成年小鼠,分为实验组和对照组。
2.制备缺血模型:将实验组小鼠放入灌注装置中,通过调整灌注流量和时间,使小鼠某一部位(如心肌、脑组织等)发生缺血。
3.观察缺血程度:通过检测相关生理指标(如心率、血压、血氧饱和度等),评估小鼠缺血程度。
4.再灌注操作:在观察到缺血程度达到预设值后,恢复灌注流量,使缺血部位重新获得血流。
5.观察再灌注效果:通过检测生理指标,评估再灌注对小鼠的影响。
三、小鼠缺血再灌注的实验结果和分析实验结果显示,在缺血发生后,小鼠的心率、血压、血氧饱和度等指标会发生明显变化。
再灌注后,这些指标会逐渐恢复到正常水平。
但不同缺血时间和程度的小鼠,再灌注后的恢复情况有所不同。
通过对实验结果的分析,可以得出以下结论:1.缺血再灌注对小鼠的组织和器官具有一定的保护作用,能够减轻缺血带来的损伤。
2.缺血时间和程度的不同,再灌注的效果有所差异,提示再灌注治疗需要个体化。
四、小鼠缺血再灌注的结论和展望总之,小鼠缺血再灌注实验为研究缺血后再灌注的生物学效应提供了一个有效模型。
通过对这一模型的深入研究,可以为临床治疗缺血性疾病提供理论依据和技术支持。
心脏灌流实验报告 乳酸

心脏灌流实验报告乳酸引言心脏灌流实验是研究心脏功能和心脏病理生理的重要手段之一。
乳酸是一种生物体代谢中的重要指标,其水平变化可以反映细胞的能量代谢状况。
本实验旨在通过心脏灌流实验,研究乳酸在心脏功能损伤中的作用及其产生的机制,以期为心脏疾病的治疗提供一定的理论依据。
方法实验设备和试剂本实验所用设备包括灌流装置、心脏收缩力记录仪、乳酸监测仪等。
动物模型选取20只健康成年大鼠作为实验对象,随机分为两组,每组10只。
实验组动物给予乳酸注射剂,对照组动物给予等量的生理盐水作为对照。
实验步骤1. 对照组动物和实验组动物分别麻醉,并进行气管插管。
2. 给予每只实验组动物乳酸注射剂,剂量为每公斤体重100mg。
3. 进行心脏灌流实验,记录心脏收缩力和乳酸水平的变化。
4. 根据实验数据进行结果分析和统计学处理。
结果实验记录到的数据如下表所示:时间点(分钟)心脏收缩力(单位)乳酸浓度(mmol/L)0 100 0.110 85 0.520 70 1.030 60 1.540 55 2.0讨论根据实验数据可以发现,实验组动物的心脏收缩力明显下降,且乳酸浓度逐渐升高。
而对照组动物的心脏收缩力和乳酸水平变化较小。
乳酸的产生主要来自乳酸酶催化的糖酵解过程。
在心脏功能受损的情况下,细胞能量代谢不足,糖酵解过程加强,导致乳酸的产生增加。
乳酸的积累对心肌细胞功能具有一定的抑制作用,进一步降低心脏收缩力。
实验中,给予实验组动物乳酸注射剂,可能会加速乳酸的产生,导致实验组动物的心脏收缩力下降更加明显。
而正常情况下,心脏对乳酸的产生有一定的代谢能力,能够维持适当的乳酸水平。
结论通过心脏灌流实验,我们发现乳酸在心脏功能损伤中的作用是抑制心脏收缩力的关键因素之一。
乳酸的产生增加会导致心肌细胞功能的下降,从而影响心脏的正常收缩和泵血功能。
因此,针对乳酸积累可能是心脏疾病治疗的一个潜在方向,可以尝试通过调节乳酸的代谢以及改善细胞能量代谢来提高心脏功能。
成年小鼠心脏单个细胞悬液的制备及流式细胞检测

成年小鼠心脏单个细胞悬液的制备及流式细胞检测目的:制備成年小鼠心脏单细胞悬液,测定心肌缺血再灌注损伤(reperfusioninjury,RI)小鼠心肌中白细胞的分布情况。
方法:选取10~12周龄SPF级雄性C57BL/6小鼠15只,按照随机方法将其分为假手术组5只(模型制备成功5只)和RI 24 h组10只(模型制备成功7只)。
RI 24 h组小鼠心脏缺血30 min后,于再灌注24 h后摘取小鼠心脏,配置心脏消化液,冲洗剪碎进行消化,经过滤离心收集心脏细胞,行流式细胞检测,以CD45标记白细胞,并进一步行CD11c 标记树突状细胞及Ly6C标记单核细胞。
比较两组CD45阳性细胞比例及CD11c、Ly6C标记的细胞占CD45阳性细胞比例;比较两组各细胞在总心肌细胞中的比例。
结果:每只小鼠心脏制备所得的单个细胞悬液行细胞计数为(1~2)×106个。
RI 24 h组CD45阳性细胞占心肌细胞比例高于假手术组(P<0.05);RI 24 h 组CD11c+Ly6C+树突状细胞占CD45阳性细胞的比例高于假手术组(P<0.05)。
RI 24 h组CD11c标记的树突状细胞及Ly6C标记的单核细胞等各亚群细胞在总心肌细胞中的比例均高于假手术组(P<0.05)。
结论:成年小鼠心脏细胞的单细胞悬液可以通过切碎和消化制备,可用单细胞悬液流式细胞仪检测RI心肌白细胞、树突状细胞和单核细胞的显著变化。
本研究为小鼠心脏白细胞的详细分析提供了一种可行的方法。
小鼠动物模型实验是进行科学研究的重要方法,与大鼠等动物模型相比,在炎症免疫方面的实验中小鼠来源的炎症细胞分类、细胞标记、实验相关抗体等更加详尽、充沛。
炎症细胞的研究不仅需要定性及形态学的研究,定量及功能研究可以提供更为准确、全面的信息。
小鼠心脏缺血再灌注损伤(reperfusion injury,RI)模型中病变呈局灶性分布,病理切片易受到取材误差干扰及观察视野影响,如果直接制备心脏单个细胞悬液后行流式细胞检测,不仅可以定量,还可以应用多抗体标记,从而更为详细地区分细胞亚群。
一种实验大鼠小鼠心脏灌注固定装置[实用新型专利]
![一种实验大鼠小鼠心脏灌注固定装置[实用新型专利]](https://img.taocdn.com/s3/m/c34204baad02de80d4d840f6.png)
专利名称:一种实验大鼠小鼠心脏灌注固定装置专利类型:实用新型专利
发明人:洪仕君,李利华,于洋,万佳
申请号:CN201521098043.4
申请日:20151225
公开号:CN205252181U
公开日:
20160525
专利内容由知识产权出版社提供
摘要:本实用新型公开了一种实验大鼠小鼠心脏灌注固定装置,包括灌注液体容器、液体输注管、液体滴速观察装置、液体输注管、三通阀门、流速控制装置、液体输注管和心脏穿刺针头,灌注液体容器、液体输注管、液体滴速观察装置、液体输注管、三通阀门、液体输注管和心脏穿刺针头依次连接,所述流速控制装置位于液体输注管的外面。
该装置为实验研究中实验动物的灌注固定提供了操作便利的实用装置。
本装置具有操作简便、易学、节约灌注试剂,可重复使用、成本低廉等优点。
申请人:昆明医科大学
地址:650500 云南省昆明市呈贡新城雨花街道春融西路1168号
国籍:CN
代理机构:北京国智京通知识产权代理有限公司
代理人:孙文彬
更多信息请下载全文后查看。
血管再灌注实验报告

血管再灌注实验报告1. 引言血管再灌注(Ischemia-reperfusion, I/R) 是指血液供应阻断后再恢复供应。
血管再灌注实验常被用于研究心脏、肝脏、肾脏等器官缺血再灌注损伤的机制和治疗方法。
本实验旨在通过建立小鼠心肌缺血再灌注模型,观察心肌组织的损伤程度,探讨可能的保护措施。
2. 材料与方法2.1 实验动物雄性C57BL/6小鼠,体重22-26g,年龄8-10周。
2.2 实验组织心脏组织。
2.3 实验设计将实验动物随机分为以下组别:- 对照组(Sham):动物接受手术操作,但没有缺血再灌注处理。
- 缺血再灌注组(I/R):动物在缺血30分钟后再进行1小时的再灌注。
- 预处理组(PreC):在缺血前15分钟,给予预处理药物。
2.4 缺血再灌注模型建立1. 手术动物采用深度麻醉并固定在手术台上。
2. 通过胸骨处切口,暴露心脏。
3. 用缝线将冠状动脉结扎。
4. 结扎30分钟后,解开缝线并进行1小时的再灌注。
5. 收集心肌组织样本。
2.5 组织损伤评价方法1. 心脏组织样本定量化。
2. 彩色素沉淀法(TTC staining) 观察心脏梗死面积。
3. 光镜下观察组织结构。
2.6 统计分析采用统计学软件进行数据的描述性分析,并使用方差分析(ANOVA) 进行组间比较,p < 0.05认为差异有统计学意义。
3. 结果3.1 心脏梗死面积变化通过TTC染色观察心脏梗死面积的变化,在I/R组中心脏梗死面积显著增加(p < 0.05),而在预处理组中心脏梗死面积较小,差异有统计学意义。
3.2 组织结构观察使用光镜观察心肌组织结构变化,发现I/R组心肌细胞出现明显的坏死和水肿,而预处理组心肌细胞结构相对完整,坏死和水肿程度明显减轻。
4. 讨论本实验通过建立小鼠心肌缺血再灌注模型,观察心肌组织的损伤程度。
结果表明,缺血再灌注会导致心肌梗死面积增加和心肌组织结构损伤。
然而,在预处理组中给予药物处理后,心肌梗死面积减小,心肌组织结构保持较好。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
成年小鼠心脏灌流
实验材料:需要观察脑切片的小鼠
试剂/试剂盒:乙醚;生理盐水(37℃水浴);4%PFA;30%蔗糖
仪器:蠕动泵;剪刀;镊子;针头;导管
实验步骤:
1、准备实验器材:两个锥形瓶(1个装生理盐水,一个装4%多聚甲醛,记得要用封口膜封口)
2、用生理盐水冲洗导管,并排除管内气体。
(灌流时选用雄性动物比选用雌性动物要好,原因是雌性动物受其激素周期影响,雄性的结果更为可靠)
3、在密闭容器内加适量乙醚,麻醉小鼠。
(需要注意的是,小鼠清醒一点比死掉要好,防止血液凝固给灌流带来阻力)
4、待小鼠麻醉后立即将其用针头固定在泡沫板上(用针头插住四肢)。
5、一只手用镊子扯起胸部皮肤,另一只手用剪刀剪开胸腔的皮肤和肋骨,暴露出心脏和肝脏。
6、将注射针头插入小鼠左心室(如针头不稳可用镊子将其固定在泡沫板上),同时将小鼠肝脏减掉,以使血液流出。
灌流速度5.8rpm。
(灌注生理盐水的时间维持在10min左右,血液排除后四肢、肝脏和舌头会变白)
7、对小鼠进行剪尾取样,以备测定其基因型。
同时,将小鼠信息卡片上记录灌流信息,并将灌流小鼠的信息记录在自己的实验记录本上,以方便后续的重新基因型鉴定操作。
8、待小鼠四肢、肝脏和舌头变白之后,将导管始端从生理盐水中拿出,将其放入冰浴的4%PFA溶液(4℃)中,用4%PFA灌流固定时,当PFA流至大脑处可能会使小鼠尾巴略有反射现象(有时可能没有),此时可将灌流速度由5.8rpm调至4.8rpm,以使固定更加充分。
整个PFA灌流时间约为20min。
(固定原理:多聚甲醛可以使蛋白质交联)
9、将导管始端从PFA中拿出,待管中液体流尽后,将心脏上的针头拔下,如果固定的较好,可发现小鼠眼球呈现白色。
将托盘中的血液倒至废液桶内,并准备下一步的取脑操作。
10、拿出一条纸巾,将小鼠尸体放在上面,沿颈部剪下头颅。
11、剪开头部皮肤,露出白色头盖骨。
将延髓上包被的软骨剪开,除去多余的结缔组织。
需要注意的时,眼睛要由剪刀剪下,不能够直接扯下来,因为眼睛后部连着视神经,如果扯的话有可能会损坏视交叉上核等其他脑部组织。
12、将头盖骨小心剥开,露出白色的脑部,在剥嗅球部位时要格外小心,必要的话可以先将嗅球前部的碎骨留着待进一步固定之后再去除。
13、将头盖骨剥开后,将脑下部连接的神经逐条剪短(可看到视神经交叉),待全部剪断后将脑整个剥离出来。
14,将剥离出来的脑浸泡在4%PFA中,过夜固定。
15、将PFA液换为30%蔗糖进行脱水(防止冷冻切片时形成冰晶和孔洞),初始脱水时脑会浮在蔗糖上面,待完全脱水后脑会沉底。
此时可将脑取出进行冷冻切片。
