76-片剂(薄膜衣片)外观的检查 药片脆碎度试验
2017执业药师西药学片剂质量检查

2017执业药师西药学片剂质量检查
为大家提供“2017执业药师西药学片剂质量检查”供广大考生参考,更多资讯请关注我们网站的更新!
一、外观性状
应完整光洁、色泽均匀、无杂斑、无异物
二、片重差异:
糖衣片的片芯应检查重量差异并符合规定,包糖衣后不再检查重量差异。
薄膜衣片应在包薄膜衣后检查重量差异并符合规定。
凡规定检查含量均匀度的片剂,一般不再进行重量差异检查。
三、脆碎度
用Roche脆碎度测定仪,通常脆碎度<1%为合格。
四、崩解时限
凡规定检查溶出度、释放度或融变时限的制剂,不再进行崩解时限检查。
普通压制片:应在15min内全部崩解
薄膜衣片:应在30min内全部崩解
糖衣片:应在60min内全部崩解
泡腾片:应在5min内全部崩解
肠衣片:先在盐酸溶液(9→100)中检查2h,每片不得有裂缝崩解或软化现象,于pH为6.8的磷酸盐缓冲液中1h内应全部崩解。
含片:应在30min内全部崩解或溶化。
舌下片:应在5min内全部崩解或溶化。
可溶片:水温15℃~25℃,应在3min内全部崩解或溶化。
结肠定位肠溶片:pH为7.8~8.0的磷酸盐缓冲液中60min内全部释放或崩解。
五、溶出度或释放度
溶出度检查用于一般的片剂,而释放度检查用于缓控释制剂
凡检查溶出度或释放度的制剂,不在进行崩解时限的检查。
六、含量均匀度
含量均匀度系指小剂量或单剂量的固体制剂、半固体制剂和非均相液体制剂的每片(个)含量符合标示量的程度。
凡检查含量均匀度的制剂不再检查重(装)量差异。
药品生产技术《片剂的质量检查、处方设计及举例》

片剂的质量检查、处方设计及举例一、片剂的质量检查〔一〕外观性状片剂外观应完整光洁,色泽均匀,有适宜的硬度和耐磨性,除另有规定外,对于非包衣片,应符合片剂脆碎度检查法的要求,防止包装、贮运过程中发生磨损或破碎。
〔二〕重量差异片重差异过大,意味着每片中主药含量不一,对治疗可能产生不利影响。
糖衣片的片芯应检查重量差异并符合规定,包糖衣后不再检查重量差异。
薄膜衣片应在包薄膜衣后检查重量差异并符合规定。
检查法:取供试品2021精密称定总重量,求得平均片重后,再分别精密称定每片的重量,每片重量与平均片重相比拟〔凡无含量测定的片剂,每片重量应与标示片重比拟〕,超出重量差异限度的不得多于2片,并不得有1片超出限度1倍。
凡规定检查含量均匀度的片剂,一般不再进行重量差异检查。
〔三〕脆碎度仪器装置:内径约为286mm,深度为39mm,内壁抛光,一边可翻开的透明耐磨塑料圆筒〔见图〕,筒内有一自中心向外壁延伸的弧形隔片〔内径为80mm±1mm,内弧外表与轴套外壁相切〕,使圆筒转动时,片剂产生滚动。
圆筒固定于水平转轴上,转轴与电动机相连,转速为每分钟25转±1转。
每转动一圈,片剂滚动或滑动至筒壁或其他片剂上。
检查法:片重为或以下者取假设干片,使其总重约为;片重大于者取10片。
用吹风机吹去脱落的粉末,精密称重,置圆筒中,转动100次。
取出,同法除去粉末,精密称重,减失重量不得过1%,且不得检出断裂、龟裂及粉碎的片。
【经典】最正确选择题在进行脆碎度检查时,片剂的减失重量不得超过%%『正确答案』C〔四〕崩解时限崩解系指口服固体制剂在规定条件下全部崩解溶散或成碎粒,除不溶性包衣材料或破碎的胶囊壳外,应全部通过筛网,但已软化或轻质上漂且无硬心者,可作符合规定论。
凡规定检查溶出度、释放度或融变时限的制剂,不再进行崩解时限检查。
1咀嚼片、缓、控释片,不需要作崩解时限检查。
2标准:〔五〕溶出度或释放度检查根据?药典?的有关规定,溶出度检查用于一般的片剂,而释放度检查适用于缓释控释制剂,其主要原因在于:崩解度检查并不能完全正确地反映主药的溶出速度和溶出程度以及机体的吸收情况。
76-片剂(薄膜衣片)外观的检查 药片脆碎度试验
4.4计算:根据下面公式计算脆碎度的百分率:(来自-b)÷a×100= %脆碎度
式中:a为测定前样品重量(g)b为测定后样品重量(g)
5、结果
5.1在控制限度内,如果测得的结果在控制限度内,压片可继续进行。但若测定的结果恰好在限度内或有接近限度的趋势,则须立即告知操作工对机器设备进行适当的调整。调整后,另取样品再进行试验。
5、方法:将所取的药片全部放在一张白纸上。
5.1压片开始:检查所有的药片是否从同类冲头中压出。按IPC记录的规定比较药片的外观。
首先检查药片“一般印象”,然后按下面SOP5.2规定的内容作详细的检查。
将药片的颜色与标准片(每批至少由20片组成)比较。标准片预先由质管部门挑选出,并经过生产部门同意。
5.2压片过程和包衣后:
部门:生产部
题目:片剂(薄膜衣片)外观的检查
共2页 第2页
MC-507
新订:
替代:
起草:
部门审核:
审阅:
批准:
执行日期:
例如:几个很小的黑点,或表面有较小的损伤。
5.2.1.4明显次于标准品的外观 G1=10分
如果一般印象记录等于或小于3分钟不必再进行详细检查(DE),必须将下列内容记录在IPC记录上;
----哪方面的外观差异;
----有外观差异片的大致数量。
5.2.2详细检查:详细检查所有样品片的一面。
将缺陷分数记录在IPC记录上;
5.2.2.110以下带有同类小缺陷的药片
DE=0分
5.2.2.211-20片具有以上具有同类小缺陷或者5-10片具有明显同类缺陷DE=1分。
0923 片剂脆碎度检查法公示稿(第一次)
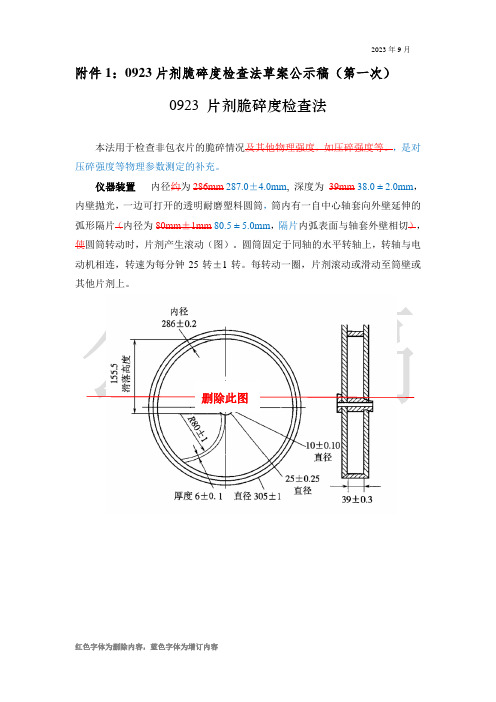
附件1:0923片剂脆碎度检查法草案公示稿(第一次)0923 片剂脆碎度检查法本法用于检查非包衣片的脆碎情况及其他物理强度,如压碎强度等。
,是对压碎强度等物理参数测定的补充。
仪器装置内径约为286mm 287.0±4.0mm, 深度为39mm38.0 ± 2.0mm,内壁拋光,一边可打开的透明耐磨塑料圆筒,筒内有一自中心轴套向外壁延伸的弧形隔片(内径为80mm±1mm80.5 ± 5.0mm,隔片内弧表面与轴套外壁相切),使圆筒转动时,片剂产生滚动(图)。
圆筒固定于同轴的水平转轴上,转轴与电动机相连,转速为每分钟25转±1转。
每转动一圈,片剂滚动或滑动至筒壁或其他片剂上。
删除此图单位mm图片剂脆碎度检查仪装置检查法片重为0.65g或以下者取若干片,使其总重约为6.5g; 片重大于0.65g 者取10片。
用吹风机吹去片剂脱落的粉末,精密称重定,置圆筒中,转动100次。
取出,同法除去吹去粉末,精密称重,减失重量不得过1%1.0%,且不得检出断裂、龟裂及或粉碎的片。
本试验一般仅只作1次。
如仅是减失重量超过1% 1.0%时,应复测2次,3次测定的平均减失重量不得过1% 1.0%,并不得检出断裂、龟裂及或粉碎的片。
如供试品的如由于形状或大小使片剂在圆筒中形成不规则滚动时,可调节圆筒的底座,使与桌面水平成约10°的角,试验实验时片剂不再聚集,能顺利下落。
对于形状或大小在圆筒中形成严重不规则滚动或特殊工艺生产的片剂,不适于本法检查,可不进行脆碎度检查。
本法不适用于由于形状或大小在圆筒中形成严重不规则滚动的片剂或特殊工艺生产的片剂。
检查泡腾片和咀嚼片脆碎度,可采用不同判定标准。
对易吸水引湿的制剂,检查操作时应注意控制环境湿度,防止吸湿引湿(通常控制相对湿度小于40%) 。
当圆筒配有双隔片或装置配有一个以上的圆筒时,可一次进行多批供试品实验。
起草单位:中国食品药品检定研究院主要起草人及联系方式:陈华、魏宁漪、周颖,************、************、************。
兽药片剂质量分析技术—片剂常规检查技术(兽药检测课件)

(2)转速设置 设置电动机转速为100 r·min-1。
溶出度测定(溶出仪的调试与参
参数设置
(3)时间设置 时段1按照供试品要求设置溶出时间,时段2-5为空。
溶出度测定(溶出液的处
溶出
待溶出介质温度恒定在37℃±0.5℃后,取供试品6片, 燥的转篮内,将转篮降入溶出杯中,自供试品接触溶出介质时 待蜂鸣器报警后,停止仪器。
g) g)
100%
溶出度测定(计算与结果判
结果判定
待溶符合下述条件之一者,可判为溶出度符合规定: (1)6片(粒、袋)中每片(粒、袋)的溶出度,按标示量 于规定限度 (Q); (2)6片(粒、袋)中,如有1~2片(粒、袋)低于Q,但不 其平均溶出度不低于Q; (3)6片(粒、袋)中,有1~2片(粒、袋)低于Q,其中仅 )低于Q-10%,但不低于Q-20%,且其平均溶出度不低于Q时, 、袋)复试;初、复试的12片(粒、袋)中有1~3片(粒、袋 仅有1片(粒、袋)低于Q-10%,但不低于Q-20%,且其平均溶
兽药检测技术
含量均匀度检查技术
【测定与计算 】
(1)测定每片以标示量为100的相对含量X, (2)求其均值、标准差S 、标示量与均值之 差的绝对值;
兽药检测技术
含量均匀度检查技术
【结果与判断】 (1)若A +2.2S≤L,即供试品的含量均匀度符合规定; (2)若A+S>L,则不符合规定; (3)若A +2.2S >L,且A+S<L,则应另取20片(个) 复试。复试的判定依据查看通则。 注:L为含量均匀度的限度,除另有规定外,L=15.0
重量差异检查技术
【定义】 ——每片重量与平均片重之差异 【操作】20片供试品 精密称定 平均片重
实用文档之片剂的质量检查项目

实用文档之"片剂的质量检查项目:外观性状、片重差异、硬度和脆碎度、崩解度(压制片崩解时限为15min,浸膏片、糖衣片、薄膜衣片为60min)、
溶出度或释放度、含量均匀度。
"
1.外观性状:完整光洁,色泽均匀,无异物,无杂斑,有效期内保持不
变。
2.片重差异:取20片称重,将每片片重与平均片重比较,超出差异限度的药片不得多于2片,并不得有1片超出限度1倍。
糖衣片、薄膜衣片应在包衣前查片芯的重量差异,包衣后不再检测。
查均匀度的片剂,不必查片重。
3.硬度和脆碎度:应用孟山都硬度计法和罗许脆碎仪法。
4.崩解度(崩解时限):吊篮法检查。
其中压制片(素片)为15min。
包衣片(浸膏片、糖衣片、薄膜衣片)为60min(素片的4倍)。
而肠溶衣片在人工胃液中2小时内不得有裂缝、崩解或软化等,医学教|育网收集整理在人工肠液中1小时内需全部溶散或崩解并通过筛网。
5.溶出度或释放度:如口含片、咀嚼片(不查崩解度)。
6.含量均匀度:取10片分别测定每片的相对含量,按《中国药典》法检
查判断是否合格。
QM-845-2片剂脆碎度检查操作程序
目的:建立片剂脆碎度检查标准操作程序.
范围:检品片剂脆碎度检查
依据:《中国药典》2005年版二部附录
职责:质检员对本标准的实施负责
程序:
1简述
本法用于检查非包衣片的脆碎度情况。
2仪器与用具
电子天平、吹风机、脆碎度测定仪
3操作步骤
3.1片重为0.65g或以下者取若干片,使其总重约为6.5g;片重大于0.65g者取10片。
用吹风机吹去脱落的粉末,精密称重,置圆筒中,转动100次。
取出,同法除去粉末,精密称重,减失重量不得过1%,且不得检出断裂、龟裂及粉碎的片。
本试验一般仅作1次。
如减失重量超过1%时,应复检2次,3次的平均减失重量不得过1%,并不得检出断裂、龟裂及粉碎的片。
3.2计算公式:
减失重量
脆碎度%= ×100%
取样量
4.注意事项
4.1如供试品的形状或大小使片剂在圆筒中形成不规则滚动时,可调节圆筒的底座,使与桌面成约10º的角,试验时片剂不再聚集,能顺利下落。
脆碎度检查标准操作程序第2页
4.2对于形状或大小在圆筒中形成严重不规则滚动或特殊工艺生产的片剂,不适于本法检查,可不进行脆碎度检查。
4.3对易吸水的制剂,操作时应注意防止吸湿(通常控制相对湿度小于40%)。
压片过程的质量控制
1、目的:阐述质管部质检员、片剂工段长和操作工在压片过程中进行质量控制的通则。
2、范围:适用于压片工序质量控制全过程。
3、试压过程的在压片工序质量控制全过程.————检查是否安装了的冲头;—---按SOPMC-—--514“片剂外观检查”(附件1);—-—-按下述SOPs中所规定的质量指标进行检查并记录在中间控制(IPC)记录上(附件2);——--平均片重和片重差异试验(附件3);-———药片厚度试验;—-——药片硬度试验;—-—-药片崩解试验;---—药片脆碎度试验;在IPC记录上记下测试结果,待试验合格后,通知质管部质检测员重复同样试验。
若测试结果符合要求,方正式压片。
否则对压片机进行调整,并重新取样重复上述试验.一旦测试结果符合要求,需更换新容器盛装药片.调整过程中的药片作报废处理。
4、压片过程的控制:4.1操作工取样检查:在压片过程中,每半小时检查一次平均片重.---—使用片重控制用(附件4)-——-在图表上部写上品名、批号、日期和操作者的姓名——--一天使用一张图表从压片机出口取决于10片,一起称重。
在图表的实际时间座标上方划十字,以记录重量差异,称重后的药片应废弃。
如果称重的结果超表中红色范围,经质管部质检员重新取样复查确实超过范围时,应立即停机进行调整并在收集容器上贴上“待处理”标签.若在压片过程中对压片机作了调整,则须在记录上记录,即围绕十字划个圆圈,以表示调整后结果。
调整后必须重复称重检查,并将结果如上述记录在控制表上.下列限度适用于片重检查:10片预计重量(g)允许的最大偏差(g)(±1.9%)0。
50——--———-0.99 ±0.0101。
00————----1.49 ±0。
0201.50-——-—---2.59 ±0.0302。
60——---——-3.59 ±0.0503。
60———--—--5.19 ±0.0705.20-——————-6。
西药执业药师药学专业知识(一)-9-2-2_真题(含答案与解析)-交互
西药执业药师药学专业知识(一)-9-2-2(总分100, 做题时间90分钟)配伍选择题• A.片重差异检查• B.硬度检查• C.崩解度检查• D.含量检查• E.脆碎度检查SSS_SIMPLE_SIN1.凡已规定检查含量均匀度的片剂,不必进行A B C D E分值: 2答案:ASSS_SIMPLE_SIN2.凡已规定检查溶出度的片剂,不必进行A B C D E分值: 2答案:C[解析] 本题考查片剂的质量标准。
每一片的含量合格比片重差异检查更为重要。
片剂药物溶出度合格,崩解度只是崩解,药物未溶出。
故已规定检查溶出度的片剂,不必进行崩解度检查。
• A.羟丙甲纤维素• B.硫酸钙• C.微晶纤维素• D.淀粉• E.蔗糖SSS_SIMPLE_SIN3.黏合力强,可用来增加片剂硬度,但吸湿性较强的填充剂是A B C D E分值: 2答案:ESSS_SIMPLE_SIN4.可作为粉末直接压片的“干黏合剂”使用的辅料是A B C D E答案:CSSS_SIMPLE_SIN5.可作为黏合剂使用和胃溶型薄膜包衣的辅料是A B C D E分值: 2答案:A[解析] 熟悉片剂各辅料的性质和作用。
蔗糖为吸湿性较强的填充剂。
粉末直接压片三种辅料:微晶纤维素、结晶乳糖和可压性淀粉。
低黏度羟丙甲纤维素既可作为黏合剂也可作为胃溶型薄膜包衣。
• A.气雾剂• B.醑剂• C.泡腾片• D.口腔贴片• E.栓剂SSS_SIMPLE_SIN6.主要辅料中含有氢氟烷烃等抛射剂的剂型是A B C D E分值: 2答案:ASSS_SIMPLE_SIN7.主要辅料是碳酸氢钠和有机酸的剂型是A B C D E分值: 2答案:C[解析] 气雾剂主要辅料为抛射剂氢氟烷烃类,片剂的主要辅料碳酸氢钠和有机酸反应可产生二氧化碳。
• A.丙二醇• B.醋酸纤维素酞酸酯• C.醋酸纤维素• D.蔗糖• E.乙基纤维素SSS_SIMPLE_SIN8.片剂包衣材料常用的致孔剂是A B C D E答案:DSSS_SIMPLE_SIN9.片剂包衣材料常用的增塑剂是A B C D E分值: 2答案:A[解析] 片剂的薄膜包衣材料通常由高分子成膜材料组成,并可添加增塑剂(丙二醇和甘油)、致孔剂(蔗糖和PEG)、着色剂与遮光剂(二氧化钛)等片剂的薄膜包衣材料。
片剂的质量检查项目
片剂的质量检查项目 Revised at 2 pm on December 25, 2020.
片剂的质量检查项目:外观性状、片重差异、硬度和脆碎度、崩解度(压制片崩解时限为15m i n,浸膏片、糖衣片、薄膜衣片为60m i n)、溶出度或释放度、含量均匀度。
1.外观性状:完整光洁,色泽均匀,无异物,无杂斑,有效期内保持不变。
2.片重差异:取20片称重,将每片片重与平均片重比较,超出差异限度的药片不得多于2片,并不得有1片超出限度1倍。
糖衣片、薄膜衣片应在包衣前查片芯的重量差异,包衣后不再
检测。
查均匀度的片剂,不必查片重。
3.硬度和脆碎度:应用孟山都硬度计法和罗许脆碎仪法。
4.崩解度(崩解时限):吊篮法检查。
其中压制片(素片)为15min。
包衣片(浸膏片、糖衣片、薄膜衣片)为60min(素片的4倍)。
而肠溶衣片在人工胃液中2小时内不得有裂缝、崩解或软化等,医学教|育网收集整理在人工肠液中1小时内需全部溶散或崩解并通过筛网。
5.溶出度或释放度:如口含片、咀嚼片(不查崩解度)。
6.含量均匀度:取10片分别测定每片的相对含量,按《中国药典》法检查判断是否合格。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
首先,在一般观察距离内检查100片药片样品的外观,得出外观的一般印象。把判断的结果记录在IPC记录上。
5.2.1.1把标准品的外观无差异 G1=0分
5.2.1.2与标准品的外观有一些差异 G1=1分
5.2.1.3与标准品的外观有很大差异 G1=3分
标准操作程序
STANDARD OPERATING PRO CEDRE
4.3碎片:一旦经脆碎度测定后,药片出现脱帽现象或脱帽,或已破碎,则必须及时记录在IPC记录上,并作结果超出控制限度处理。
4.4计算:根据下面公式计算脆碎度的百分率:
(a-b)÷a×100= %脆碎度
式中:a为测定前样品重量(g)b为测定后样品重量(g)
5、结果
5.1在控制限度内,如果测得的结果在控制限度内,压片可继续进行。但若测定的结果恰好在限度内或有接近限度的趋势,则须立即告知操作工对机器设备进行适当的调整。调整后,另取样品再进行试验。
5.2.2.4发现20片以上具有同类很明显的缺陷或10片以上具有同类很明显缺陷DE=10分或1片以上有损伤、变形、污染的片子。
5.2.2.5存在一种类型以上缺陷,每种缺陷分开记录,得总分。
DE记录的例子:
DE1+3分,其中:
-----20片存有同类小缺陷(2项)
-----20片有14片在片子缘有明显损缺陷(3项)
6、结果:G1和DE的总分在3分以上时,必须告知工段长和质管部。
标准操作程序
STANDARD OPERATING PRO CEDRE
部门:生产部
题目:药片脆碎度试验
共2页 第1页
MC-506
新订:
替代:
起草:
部门审核:
审阅:
批准:
执行日期:
1、目的:阐述生产过程中药片和成品脆度测定的指南。
2、范围:适用于压片工序全过程。
标准操作程序
STANDARD OPERATING PRO CEDRE
部门:生产部
题目:片剂(薄膜衣片)外观的检查
共2页 第1页
MC-507
新订:
替代:
起草:
部门审核:
审阅:
批准:
执行日期:
1、目的:阐述压片和包衣过程中,药片外观缺陷(包括片子大小)测定检查的规程。
2、范围:适用于压片和糖衣片工序全过程。
部门:生产部
题目:药片脆碎度试验
共2页 第2页
MC-506
新订:
替代:
起草:
部门审核:
审阅:
批准:
执行日期:
在调整前,最后一次测定结果合格与调整后重新得到合格品之间压出的药片必须与该批合格的药片分开放置,并在容器上标有待处理直到作出有关的决定。
如工艺过程调整后重仍超过控制限度,则必须立即报告工段长及质管部。
5.2超出控制限度:一旦测得的结果超出控制限度,则须重新取样称重,以证实结果。如果第二次测定的结果与前一次一致时,应立即通知操作工对过程进行适当的调整。
对压片机调整后,取一新样品,再次测定,一旦再次测定结果在控制范围内,则通知操作工必须更换另一收集容器收集药片。
标准操作程序
STANDARD OPERATING PRO CEDRE
部门:生产部
题目:片剂(薄膜衣片)外观:
替代:
起草:
部门审核:
审阅:
批准:
执行日期:
例如:几个很小的黑点,或表面有较小的损伤。
5.2.1.4明显次于标准品的外观 G1=10分
如果一般印象记录等于或小于3分钟不必再进行详细检查(DE),必须将下列内容记录在IPC记录上;
3、仪器:脆度仪。
4、方法:按IPC记录所规定的时间和次数进行测定。
4.1取样:从压片机的出口取15片,或至少6片,轻轻地吹去片子上的灰尘。
4.2脆碎度试验:在去皮重的天平盘内称取6-10g的干净药片(或至少15片)精确到±0.005g。将药片放入脆碎度仪的圆盘中,使圆盘按IPC记录所规定的转数旋转,取出药片,检查外观,除去片子上的粉层并称重。将所有的数据和观察到的现象记录在IPC记录上。
----哪方面的外观差异;
----有外观差异片的大致数量。
5.2.2详细检查:详细检查所有样品片的一面。
将缺陷分数记录在IPC记录上;
5.2.2.110以下带有同类小缺陷的药片
DE=0分
5.2.2.211-20片具有以上具有同类小缺陷或者5-10片具有明显同类缺陷DE=1分。
5.2.2.3发现20片以上具有同类小缺陷或11-20片具有明显缺陷DE=3分3-10片具有同类很明显的缺陷或1片明显损坏、变形或污染的片子。
3、仪器:正常室内光线200----500lux下,白均灯以纯白色背景作对照(一张白纸)进行检查。
用0.1mm精度,带有扁平测量端口的测量仪检查药片的大小。
4、取样:
4.1压片开始:直接从压口取出100药片。
4.2压片过程中:扫IPC所规定的时间间隔,每次取100片药片。
4.3包衣后:从每锅包衣片中取100片。
5、方法:将所取的药片全部放在一张白纸上。
5.1压片开始:检查所有的药片是否从同类冲头中压出。按IPC记录的规定比较药片的外观。
首先检查药片“一般印象”,然后按下面SOP5.2规定的内容作详细的检查。
将药片的颜色与标准片(每批至少由20片组成)比较。标准片预先由质管部门挑选出,并经过生产部门同意。
5.2压片过程和包衣后:
