鹅细小病毒与番鸭细小病毒差异分析及鉴别诊断方法研究进展_鲜思美
番鸭细小病毒病的诊治

番鸭细小病毒病的诊治番鸭细小病毒病是由番鸭细小病毒(Duck Parvovirus,DPV)引起的一种急性、传染性疾病。
该病在全球范围内广泛分布,对番鸭产业造成了严重的经济损失。
本文将介绍番鸭细小病毒病的诊断和治疗方法。
一、病毒特性番鸭细小病毒是一种无包膜、单链DNA病毒,属于细小病毒科,对番鸭繁殖器官中的上皮细胞引起明显的病理变化。
感染后,病毒可在番鸭体内广泛复制,并可通过直接接触、饮水、气溶胶和封闭性鸭舍环境等途径传播。
二、病症和临床表现番鸭细小病毒病的潜伏期约为3-5天。
感染后,番鸭呈现出明显的消瘦、食欲不振、腹泻等症状。
疾病早期可观察到呕吐、嗜睡、纳差等表现,后期可出现不同程度的出血、肾脏损伤和呼吸道症状等。
病情重的番鸭死亡率可达到30%以上。
三、诊断方法1. 病原学检测:通过病毒分离、酶联免疫吸附试验(ELISA)或聚合酶链反应(PCR)等方法检测番鸭体内是否存在番鸭细小病毒。
2. 组织病理学检查:对病死或临床病鸭进行组织解剖,观察病变情况,如肾脏发绀、肝脏肿大和脾脏增大等病理变化。
3. 血清学检查:采用血凝抑制试验或血球凝集抑制试验检测血清中的病毒抗体水平,以判断番鸭是否已产生抗体。
四、治疗方法目前对番鸭细小病毒病尚无特效药物。
针对该病的治疗主要是提高番鸭免疫力和预防二次感染。
1. 免疫增强:可给予疫苗接种,提高番鸭的免疫力,并定期进行强化免疫。
2. 注意饮食:提供营养丰富、易消化的饲料,保持番鸭的健康状态,增强其抵抗力。
3. 清洁消毒:定期清洁鸭舍,保持环境卫生。
使用有效的消毒剂对鸭舍和饮水设施进行消毒,降低病毒传播的风险。
4. 隔离治疗:发现患病番鸭时,应立即进行隔离,并对隔离场所进行消毒,以防止病毒传播。
5. 维持水电解质平衡:患病番鸭可能会出现腹泻和呕吐,导致水电解质失衡。
可给予适量的电解质溶液,维持水电解质平衡。
番鸭细小病毒病的诊断主要包括病原学检测、组织病理学检查和血清学检查。
鹅细小病毒研究进展

鹅细小病毒研究进展马磊;董浩;蒋运博;段小波;谷松至;胡桂学【摘要】小鹅瘟是由鹅细小病毒引起的一种急性、亚急性烈性传染病,是目前危害养鹅业的重要传染病之一.近年来关于鹅细小病毒的研究又有了新的发展和新的观点,作者从鹅细小病毒分子生物学、检测方法、致病机理和抗原位点的定位等方面进行了阐述.%Gosling plague, one of important infectious diseases,is an acute, subacute, spirited contagion caused by goose parvovirus,which cause serious economic loss in goose keeping. In recent years, the research about goose parvovirus have made new development and new viewpoint. Molecular biology of GPV, detecting methods, pathogenesis and positioning of antigen epitope were expounded in this paper.【期刊名称】《中国畜牧兽医》【年(卷),期】2011(038)006【总页数】4页(P165-168)【关键词】小鹅瘟;鹅细小病毒;致病机理;抗原表位【作者】马磊;董浩;蒋运博;段小波;谷松至;胡桂学【作者单位】吉林农业大学生命科学院,吉林长春130118;吉林农业大学动物科学技术学院,吉林长春130118;吉林农业大学生命科学院,吉林长春130118;吉林农业大学动物科学技术学院,吉林长春130118;吉林农业大学动物科学技术学院,吉林长春130118;吉林农业大学动物科学技术学院,吉林长春130118;吉林农业大学动物科学技术学院,吉林长春130118【正文语种】中文【中图分类】S852.65+9.2鹅细小病毒(goose parvovirus,GPV)是小鹅瘟(gosling plague,GP)的病原体,由于其传播快、病死率高,引起国内外学者的广泛重视。
新型鹅细小病毒研究进展

新型鹅细小病毒研究进展卞国志1,21,袁建丰2(1.广州 511400)摘 要:,MDPV)引起的一种传染病。
经典MDPV和GPV高。
但是2008年下半年以来,福建省、浙江省、安徽省及江苏省等地的雏半番鸭和樱桃谷鸭陆续出现一种新型细小病毒病,该病发病率10%~30%,病死率低于3%,临床症状主要为软脚、短嘴和生长障碍。
通过对该病病原进行全基因组测序及系统发育树分析,结果发现该病原与鹅细小病毒亲缘性很近。
本文通过比较新型鹅细小病毒(Novel goose parvovirus,N-GPV)与经典的MDPV和GPV在基因组、感染宿主范围和致病性的区别,为新型鹅细小病毒病的防控提供理论依据。
关键词:新型鹅细小病毒;鹅细小病毒;番鸭细小病毒中图分类号:S852.659.2 文献标志码:A 文章编号:1674-6422(2019)04-0102-06 PROGRESS OF A NOVEL GOOSE PARVOVIRUS VIRUS BIAN Guo-zhi1,2, MA Hai-bin2, LUO Meng-ping2, GONG Feng-ping2, WANG Gui-ping2,LIAO Ming1, YUAN Jian-feng2(1.Veterinary Medicine College of South China Agricultural University, Guangzhou 510642, China; 2.Guang dong Haid Institute of AnimalHusbandry&Veterinary, Guangzhou 511400, China)Abstract:Duck parvovirus disease is caused by Goose parvovirus or Muscovy duck parvovirus. The main clinical signs of classic MDPV and GPV infections are diarrhea, foot soft and exudative enteritis. The morbidity and mortality of Muscovy ducks are high. However a new type duckling parvovirus (N-GPV) emerged in Mule ducks and Cherry Valley ducks in the second half of 2008 in Fujian, Zhejiang, Anhui and Jiangsu provinces. The morbidity of N-GPV was 10-30% and the mortality was generally below 3%. The clinical signs of N-GPV were foot break easily, short beak and dwarfism syndrome. N-GPV caused serious economic loss to the duck industry in our country. The whole genome sequencing and phylogenetic analysis of N-GPV isolates revealed a similarity to goose parvovirus. This review provided the latest information on host range, genomic analysis, pathogenicity and prevention and control of N-GPV.Key words: Novel goose parvovirus; Goose parvovirus; Muscovy duck parvovirus收稿日期:2018-08-16基金项目:国家重点研发计划(2017YFD0500800);广州市科技计划项目(201704020083);广东省科技发展专项资金项目(2016B020234006,2017B090904029);广东省技术开发及产业化类别(2015B020203006);广州市科技发展专项资金项目重点项目专题(201804020006);广东省新型研发机构建设--初创期补贴专题作者简介:卞国志,男,博士研究生,预防兽医学专业;马海彬,男,硕士研究生,预防兽医学专业通信作者:袁建丰,E-mail:peteryuanfeng@年分离得到该病的病原体鹅细小病毒(G o o s e parvovirus,GPV)[1]。
鹅细小病毒和番鸭细小病毒鉴别诊断方法

增强 。在 临床 上 用和常规 的血 清 学方
法很难 将这 两种病毒 区分 .本 文 简要 介 绍 目前 的一些主要 鉴别诊 断方法。
抗体 。王 永坤等 采用交叉 免疫 转 印试 验发现 ,MD P V的多抗与 M D P V、G P V 都 出现 了两条 反应带 V P 2 、V P 3 :G P V 多抗和 M D P V 只有 1条 反 应 带 V P 3 ; 与 G P V 出 现 3条 反 应 带 V P 1 、V P 2 、
MD P V和 G P V的 二 重 P C R方 法 。 2 . 3 基 因芯 片检 测 技 术
不 同。番 鸭 细 小病毒 仅 见 番 鸭发 病 ; 而小鹅 瘟病毒 既可 感染鹅 也可 感染番
鸭 .近 年 来 番 鸭 小 鹅 瘟 的 流 行 也 逐 渐
特异性强 ,而且操作方便 和判断直观 。
( MD P V )和 鹅_ e n t d , 病毒 ( G P V)基 因 组 的同源序列 区域 结构基 因 R E P以及
番鸭 细小病毒 进行 交叉反 应 ,缺点是
特 异 性 不 强 。相 比较 而 言 L P A和 L A P I
非 同源 序列 区域结 构基 因 V P 3 ,设 计 了 2对 引物 .建 立 了一 种鉴 别 诊 断
性检测 出 G P V 和 MD P V.特 异 性 和 灵
为其 特征性 病变是 严重危 害养 鹅业 发
展 的重要 传染 病之一 。番鸭 细小 病毒
引起 的番 鸭细 小病毒病 临床 上 主要 发 生于 1 ~ 3周龄 雏番 鸭 以腹 泻软脚 喘气
鹅细小病毒和番鸭细小病毒 鉴别诊断方法
番鸭细小病毒(MPV)和鹅细小病毒(GPV)(鸭源)胶乳凝集抑制试验
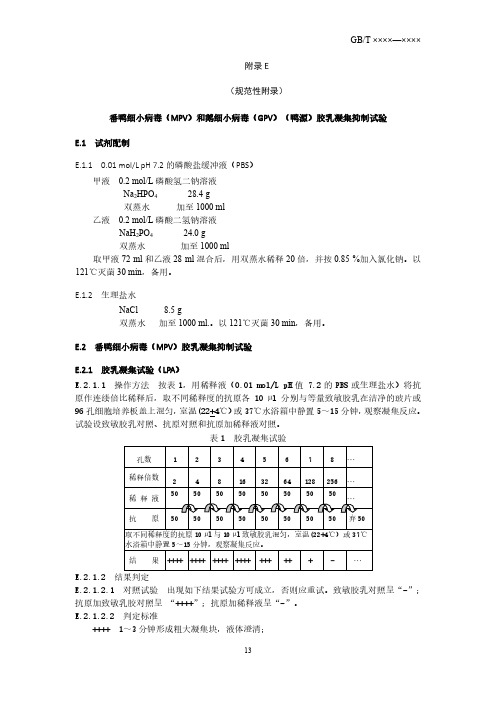
附录E(规范性附录)番鸭细小病毒(MPV)和鹅细小病毒(GPV)(鸭源)胶乳凝集抑制试验E.1 试剂配制E.1.1 0.01 mol/L pH 7.2的磷酸盐缓冲液(PBS)甲液 0.2 mol/L磷酸氢二钠溶液Na2HPO4 28.4 g双蒸水加至1000 ml乙液 0.2 mol/L磷酸二氢钠溶液NaH2PO4 24.0 g双蒸水加至1000 ml取甲液72 ml和乙液28 ml混合后,用双蒸水稀释20倍,并按0.85 %加入氯化钠。
以121℃灭菌30 min,备用。
E.1.2 生理盐水NaCl 8.5 g双蒸水加至1000 ml.。
以121℃灭菌30 min,备用。
E.2 番鸭细小病毒(MPV)胶乳凝集抑制试验E.2.1 胶乳凝集试验(LPA)E.2.1.1 操作方法按表1,用稀释液(0.01 mol/L pH值 7.2的PBS或生理盐水)将抗原作连续倍比稀释后,取不同稀释度的抗原各10 µl分别与等量致敏胶乳在洁净的玻片或96孔细胞培养板盖上混匀,室温(22+4℃)或37℃水浴箱中静置5~15分钟,观察凝集反应。
试验设致敏胶乳对照、抗原对照和抗原加稀释液对照。
表1 胶乳凝集试验E.2.1.2 结果判定E.2.1.2.1 对照试验出现如下结果试验方可成立,否则应重试。
致敏胶乳对照呈“-”;抗原加致敏乳胶对照呈 “++++”;抗原加稀释液呈“-”。
E.2.1.2.2 判定标准++++ 1~3分钟形成粗大凝集块,液体澄清;+++ 形成较大的凝集块,且液体澄清;++ 50%胶乳凝集,颗粒明显,液体较澄清;+ 少量胶乳凝集,液体较混浊;- 无凝集颗粒,液体呈均匀乳状。
以出现“++”以上凝集者判为阳性;“+”为可疑;“-”为阴性;以出现“++”凝集反应的最高稀释度作为判定终点。
如表1的抗原LPA效价为1︰64。
E.2.2 抗原凝集工作液的制备E.2.2.1 抗原凝集价(LPA)测定用稀释液(0.01mol/L pH值 7.2的PBS或生理盐水)将病毒抗原液连续倍比稀释后,各取10 µL不同稀释度的病毒液与等量致敏胶乳在洁净的玻片或96孔细胞培养板盖上混匀,室温(22+4℃)或37℃水浴箱中静置5~15分钟,按LPA 判定结果(见表1)。
番鸭细小病毒诊断与防治研究进展

本 病 潜 伏期 4  ̄ 9天 , 病程 2 ~ 7天 , 自然 发 病均 限于 1 月龄 以 内的番鸭 。 根 据病 程长 短分 为最急 性
型 、急性型 和亚 急性 型 三种 。最 急性 型 多发生 于 6
MD P V病 毒 对环 境 的抵抗 力 较强 ,对 乙醚 、 氯 仿、 酸、 热 和胰蛋 白酶 有 一定 的抵抗 力 , 对 紫外 线敏 感 。此 外 , MD P V对 实验 室 常用 的鸭 、 鸡、 绵羊 、 猪、 豚 鼠和人 的 0型红 细胞无 凝集 现象 。
【 收稿 E l J l J ] 1 2 0 1 3 - 1 卜2 0
・
作出初步诊断。在临床 中本病常与鹅细小病毒 、 鸭 病毒性肝炎 、 禽副伤寒 、 大肠杆菌 和鸭疫里 氏杆菌 等混淆 , 也存在几种疾病混合感染的情况 , 容 易造 成误诊 和漏 诊 。确诊需 要进 一步 的实验 室诊 断 。
MD P V只有一个 血 清型 ,与鹅 细小病 毒 ( G o o s e
日龄 内 的番鸭 , 病 势猛 , 病程 短 , 只有 数小 时 。多 数
病例 不见 先兆 症状 突然 死亡 ,伴 随 神经症 状 死亡 , 头颈 向一侧 扭 曲 , 两脚 乱划 。剖检病 变不 明显 , 可能 出现 急性 卡他性 肠炎 或肠粘 膜 出血 。 急性 型主要 见
该病的存在 , 随后广东 、 广西 、 湖南 、 浙江 、 江西等省 ( 区) 和法 国 、 日本 、 美 国等 地 陆续 报 道 了 该病 的流
行 。近年 来 , 该病 在 国 内多个省 份 的番 鸭养 殖 场存 在较 为普遍 , 制 约番 鸭养殖 的发 展 。
1病 原 学特性
番鸭细小病毒病的诊治
番鸭细小病毒病的诊治番鸭细小病毒病(DUCK VIRAL HEPATITIS,DVH)是一种常见的家禽病,主要传染于番鸭。
该病毒具有高度感染性、强烈的传染性和高度致死性。
病畜可迅速出现贫血、黄疸、肝脏病变、食欲下降、头部前倾等症状,如不及时诊治,可导致大规模死亡。
本文旨在探讨番鸭细小病毒病的诊断与治疗。
一、病原学DVH病毒属于痘病毒科,病原体为一种外形为45-50nm直径的非包膜DNA病毒。
病毒具有很高的稳定性,可在极端环境条件下存活数周。
在适宜的温度(4-25℃)和湿度条件下,病毒可在集体养殖环境中迅速扩散传播。
二、临床症状DVH病毒感染后,潜伏期为3到7天,发病期为2到3天。
感染的番鸭会表现出以下症状:1、食欲下降。
DVH病毒感染的鸭群通常会出现食欲下降的现象。
2、黄疸。
感染的番鸭通常会表现出明显的黄疸,特别是眼睛和嘴巴周围。
3、贫血。
感染的番鸭显示出明显的贫血,具有苍白和蚕豆样的粘附物。
4、肝脏病变。
病畜的肝脏会出现病变,显现出肝脏肿大,切面呈暗色等症状。
5、头部前倾。
感染的番鸭会表现出头部前倾、不争气等行为。
三、诊断方法番鸭细小病毒病的诊断主要依赖于以下几种方法:1、病原学检查。
通过收集患鸭的肝脏、脾脏、胆汁或肠道等标本,进行RT-PCR,PCR 检测等试验,以确认病毒存在。
2、临床表现分析。
根据病畜的表现,在排除其他可能性病因的情况下,可以初步诊断出番鸭细小病毒病。
3、病理学检查。
在那些死于DVH的病畜尸检后,对其死亡原因进行细致的病理学检查分析,以确认病因。
四、治疗方法1、疫苗预防。
为了预防DVH病毒感染,在鸭群中接种DVH疫苗是一种主要的预防措施。
疫苗接种可以大大降低鸭群中DVH的发生率,减少损失。
2、药物治疗。
目前没有特效药物可以治疗DVH病毒感染,针对不同症状和并发症的治疗措施应视具体情况而定。
例如,可以使用抗生素、肝保护剂、保肝解毒剂等药物缓解病畜的症状和疼痛,并加强营养。
3、加强饲养环境管理。
鹅细小病毒的分子生物学研究进展
鹅细小病毒的分子生物学研究进展蒋运博,董浩,马磊,徐楠楠,段小波,胡桂学关键词:鹅细小病毒; 分子生物学; 小鹅瘟摘要:鹅细小病毒( GPV) 病是危害养鹅业的主要传染病之一。
文章根据国内外对鹅细小病毒的分类地位、分子生物学特性、基因组的结构特点、非结构蛋白与结构蛋白的功能以及分子生物学诊断与防治等方面的研究作一综述,以期为鹅细小病毒及小鹅瘟的防控提供参考。
小鹅瘟是由鹅细小病毒( goose parvovirus,GPV)引起的雏鹅和雏番鸭的一种急性或亚急性败血性传染病。
该病主要侵害3 ~20 日龄的雏鹅和雏番鸭,以渗出性肠炎、小肠黏膜表层大面积坏死脱落、肠道栓塞为特征性病变,是一种主要侵害肠、肝脏、肾脏、心脏等实质脏器的急性、高度接触性传染病。
1956 年,小鹅瘟病毒首次由中国学者方定一在江苏扬州市发现并分离,是一类无囊膜的DNA 病毒。
1974 年,国际禽病学会( WPSA) 将其命名为Derzsys氏病。
近年来,许多国内外学者从不同角度,对鹅细小病毒进行了分子水平上的研究,更好地认识了鹅细小病毒的生物学特性,促进了对该病的有效防制,文章仅对鹅细小病毒分子生物学方面的研究进展作一综述。
1 分类地位及一般特性鹅细小病毒属于细小病毒科细小病毒亚科细小病毒属成员,国际病毒分类委员会将细小病毒科分为2 个亚科,即细小病毒亚科和浓核病毒亚科,细小病毒亚科又分为细小病毒属、红病毒属和依赖病毒属。
小鹅瘟病毒即鹅细小病毒属于单链线状DNA 病毒,外观呈圆形或六角形,是一种无囊膜的20 面体对称病毒,直径为20 ~25 nm。
该病毒只有 1 个血清型,与本属其他成员无交叉免疫反应,但区别于本属其他成员的一个显著特点是,迄今尚未发现其有凝集红细胞的性能。
研究表明,该病毒能凝集黄牛的精子[1 -2]。
鹅细小病毒对外界因素的抵抗力很强,对乙醚、氯仿、胰酶的处理有抵抗力,对紫外线敏感,56 ℃加热1 h,病毒仍能使鹅胚死亡,在50 ℃条件下经3 h或37 ℃条件下经7 d 对感染效价无影响。
一例雏番鸭细小病毒病的诊断与治疗
一例雏番鸭细小病毒病的诊断与治疗雏番鸭细小病毒病是一种由雏番鸭细小病毒引起的急性传染病,主要表现为呼吸道症状、神经系统症状和肠道症状。
这种疾病对雏番鸭的生长发育具有严重的影响,严重的时候还会导致死亡。
及时的诊断和治疗对于减少疾病的传播和降低死亡率至关重要。
本文将介绍雏番鸭细小病毒病的诊断和治疗方法。
一、诊断1. 临床表现雏番鸭细小病毒病的临床表现主要包括呼吸道症状、神经系统症状和肠道症状。
呼吸道症状包括打喷嚏、流清鼻涕、咳嗽等;神经系统症状包括头部后仰、颈部侧弯、羽毛拴弯等;肠道症状主要表现为腹泻。
若发现雏番鸭出现上述症状,应及时进行诊断并排除其他呼吸道、神经系统和肠道疾病。
2. 病理学检查对于怀疑感染雏番鸭细小病毒的病例,可以对其进行病理学检查以明确诊断。
在病理学检查中,可以发现呼吸道、神经系统和肠道组织的变化,如出现充血、水肿、出血和坏死等病变。
3. 实验室检查实验室检查是确诊雏番鸭细小病毒病的主要方法之一。
可通过病毒分离、血清学检测、免疫组化检测等方法来检测雏番鸭细小病毒的存在。
病毒分离是最为直接和准确的方法,通过在病变组织上进行病毒分离培养,再通过电镜观察和免疫荧光等方法鉴定病毒的类型。
二、治疗1. 对症治疗对于感染雏番鸭细小病毒病的雏番鸭,应根据其临床症状进行对症治疗。
对于呼吸道症状,可给予抗生素治疗;对于神经系统症状,可给予镇痛和抗炎治疗;对于肠道症状,可给予抗菌药物和止泻药物治疗。
同时还应注意保持环境卫生,保持雏番鸭的温暖和干燥。
2. 传染病防控在治疗雏番鸭细小病毒病的过程中,还应注重传染病的防控工作,避免病毒的传播。
首先应对感染的雏番鸭进行隔离,避免传染给其他健康的雏番鸭。
对笼舍和饲养环境进行彻底的消毒,避免病毒在环境中存活和传播。
还应加强对饲养人员的卫生教育,避免通过人传播病毒。
3. 免疫措施预防胜于治疗,因此雏番鸭细小病毒病的免疫工作也是非常重要的。
可以通过接种疫苗来提高雏番鸭的免疫力,减少感染的发生。
番鸭细小病毒病的诊治
番鸭细小病毒病的诊治
番鸭细小病毒病是由番鸭细小病毒引起的一种急性传染病。
该病毒主要感染番鸭,但也可感染其他一些家禽,如家鸭、鹅等。
病毒通过呼吸道、消化道等途径传播,具有很强的传染性。
番鸭细小病毒病的临床表现多样,主要包括呼吸道症状、消化道症状和神经系统症状等。
呼吸道症状主要表现为喘息、喘鸣、咳嗽、流鼻涕等;消化道症状主要表现为食欲不振、腹泻、消瘦等;神经系统症状主要表现为抽搐、瘫痪等。
病程一般为2-10天,病死率较高。
对于番鸭细小病毒病的诊断,主要依靠疫情学资料、临床症状和病原学检测。
病毒分离和鉴定对于确诊极为重要,目前主要采用RT-PCR和ELISA等方法进行检测。
还可以通过血清学检测、病理学检查等方法,辅助诊断和监测。
对于番鸭细小病毒病的治疗,目前没有特效药物。
一般采取支持治疗和预防措施。
在疫情发生时,应立即采取隔离、消毒和封锁等措施,以防止病毒的传播。
还可以加强番鸭的营养,提高免疫力,减少病毒的侵袭。
预防番鸭细小病毒病的关键是加强番鸭的免疫力和疫苗接种。
番鸭细小病毒疫苗已经开发出来,并且在番鸭养殖中广泛使用。
疫苗的接种可以显著降低发病率和死亡率,对于控制番鸭细小病毒病具有重要意义。
番鸭细小病毒病是一种严重的传染病,对番鸭养殖业造成了很大的经济损失。
通过临床症状和病原学检测可以进行准确的诊断。
目前尚无特效药物,主要采取支持治疗和预防措施。
加强番鸭的免疫力和疫苗接种是预防和控制该病的关键。
希望随着科学的进步,能够尽快找到解决该病的方法,以保障番鸭养殖业的健康发展。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
根据核苷酸全序列分析,基因组有两个开放阅 读框( ORF) ,左侧阅读框( LORF) 编码非结构蛋白 ( Rep1,Rep2) ,右侧阅读框( R0RF) 编码 3 种核衣 壳蛋白 VP1、VP2、VP3,这 3 种蛋白起始密码子位 于不同部位,但终止密码子处于同一位置 。关于 MDPV 对其结构蛋白说法不一,法国学者 C. LeCall - Recule 等[14]( 1994) 进行 SDS - PAGE 电泳时,发 现在 51kD 左右处有 1 条淡染的蛋白带; 匈牙利学 者 Z. Zadori[6]( l995) 根据蛋白凝胶电泳分析,MDPV 有 3 条结构多肽,分子量分别为 VP1 91kD、VP2 78kD、VP3 58kD。而我国孟松树等[15]( 1994 ) 、王 永坤等[16]( 2004 ) 研究表明,MDPV 有 4 条结构多 肽,分别为 VP1、VP2、VP3、VP4,分子量分别为 VP1 89kD、VP2 68kD、VP3 58kD、VP4 为 40kD。其 中, VP3 为主要结构多肽,占总含量的 78. 5% ,而 VP1 含量为 9. 4% ,VP2 为 7. 2% ,VP4 为 4. 9% 。GPV 出现 3 条结构多肽,即 VP1 分子量为 85 000,VP2 为 61 000,VP3 为 57 500。其中,VP3 为主要结构 多肽,占总含量的 79. 9% ,而 VP1 为 8. 3% ,VP2 为 11. 8% 。Chapaman 等[17]( 1993) 分析了几种细小 病毒粒子核衣壳,发现 GPV、MDPV 位于病毒粒子 表面的 VP3 多肽略有差异。最大不同之处是位于 VP2、VP3 启动子之间 162 位和 178 位氨基酸,而其 蛋白分 子 差 异 不 明 显。张 建 珍 等[18] 也 报 道 MDPV、GPV 有一定的交叉反应性,两者的共同抗原基 因主要 位 于 VP3 上,而 主 要 差 异 存 在 于 VP1 和 VP2。Chu 等[19]发现,GPV 与 MDPV 差异最多的序 列集中于 VP3 的 203 - 266 及 482 - 534 位的氨基 酸残基( VP1 的 401 - 464 和 680 - 732 位氨基酸残 基) 。黎明等[20]采用生物信息学方法,预测 MDPV
小鹅瘟( Gosling plague,GP) 是由鹅细小病毒 ( Goose Parvovirus,GPV) 引起雏鹅的一种高致死性 疾病,又称鹅细小病毒感染( Goose parvovirus infection,GPVI) 或 Derzsy’s 病。该病是以急性肠炎及 肝、肾、心脏实质脏器败血性病变为特征的烈性传 染病,传播迅速,以 4 ~ 20 日龄雏鹅消化道,尤以小 肠部位的纤维素性、栓塞性病变为主要特征。该病 病程短促,传染性强,传播快,死亡率高 [1]。
68
山地农业生物学报
2013 年
采用限制性核酸内切酶酶切技术对 MDPV 和 GPV 退火形成的双链 DNA 和经 Klenow 酶合成的双链 DNA 进行分析,证明 MDPV 和 GPV 核酸的 EcoR I、 Kpn I 和 Sac I 酶切位点不同,合成的双链 MDPV 和 GPV 核酸的 Sac I、BstX I、Bg Ⅲ、Pst I 和 EcoR I 酶 切位点不同,从而表明 MDPV 和 GPV 核酸在结构 上有明显差异。李雪梅等[13] ( 2001 ) 对国内 4 株 GPV 和 2 株 MDPV 的 Rep 基因进行酶切分析 比 较,发现酶切位点有较大差异,即 GPV 缺乏 Sac I 位点,但有 Pst I 位点,不同毒株间 EcoR I 位点有差 异; 而 MDPV 则有 Sac I 和 EcoR I 位点,但无 Pst I 位点。
Advancement of Differential Diagnostic Methods of Muscovy Duck Parvovirus from Goose Parvovirus
XIAN Si-mei( College of Animal Sciences,Institute of Animal Disease of Guizhou Province,Guizhou University, Guiyang Guizhou 550025,China)
67
构、病毒编码蛋白方面进行比较分析,概述两种病 毒在基因组结构和抗原性上存在的差异及已建立 的鉴别诊断方法。
1 病毒的基因组结构比较
GPV 与 MDPV 两者同属于细小病毒科细小病 毒属,基因组为单股、线状 DNA,正极性 DNA 链的
病毒粒子和含有负极性 DNA 链的病毒粒子数目基 本相等[5]。匈牙利学者 Zadori[6]( 1995) 对 GPV 和 MDPV 毒株进行了核苷酸序列测定,并与禽和哺乳 动物的细小病毒进行了比较。MDPV FM 株核苷酸 长为 5 132 bp,GPV B 株核苷酸长为 5 106 bp,两者 在核苷酸水平上有 81. 9% 相同。GPV 全基因结构 见图 1。
Abstract: Goose parvovirus is quite similar to muscovy duck parvovirus in size,shape,physi-chemical characteristics,nucleic acid type and genomic structure,loemic epidemiologies,clinical symptoms as well as pathological changes,Also the conventional serology detection method hardly differentiates the two virus due to the interactive protective ability. In the present paper,the comparison of genomic characteristics and virus codogenic proteinum was conducted. Further,the variance of the two types of virus in the structure and antigenicity were analyzed,and the diagnostic methods were also summarized herein. Key words: Muscovy duck parvovrius; Goose parvovirus; difference; differentiation diagnosis
图 1 GPV 基因组结构图( 5 106 bp) Fig. 1 Genome structure of GPV( 5106 bp)
贺娟[7]( 2007) 将 GPV 和 MDPV 的基因序列进 行了 比 对: ( 1 ) GPV 179 ~ 4 910 bp 序 列 与 MDPV187 ~ 4 927 bp 序列方向相同,同源性为 82% ; ( 2) GPV 4919 ~ 5 105 bp 与 MDPV187 ~ 1 的同源性 为 85% ,但方向相反; ( 3 ) GPV93 ~ 177 bp 序列与 MDPV 5083 ~ 4 998 bp 同源性为 94% ,但 方 向 相 反; ( 4 ) GPV 的 2 ~ 151 bp 序 列 与 MDPV5132 ~ 4 980 bp同 源 性 为 88% ,方 向 也 是 相 反。GPV 较 MDPV 基因组序列少的 26 bp 分布于: 左侧 ITR 序 列中,GPV 缺失 11 bp; 右侧 ITR 中,GPV 较 MDPV 少 10 bp; 在结构蛋白( VP) 终止子后,GPV 较 MDPV 少 5 bp。GPV 较 MDPV 基因组序列少的 26 bp 全部分布于非编码序列中。GPV 较 MDPV 基因组 中编码蛋白质的区域,两者之间大小相同,不存在 缺失或额外的插入序列,而是表现为碱基替代。张 云等[8]( 2008) 发现鹅和番鸭细小病毒非结构蛋白 基因( NS) 全长为 1 884 bp,编码 627 个氨基酸; 结构 基因( VP) 全长为 2 199 bp,编码 732 个氨基酸; 鹅细 小病毒和番鸭细小病毒 NS 之间的核苷酸和氨基酸 同源性分别为80. 9% ~ 82. 9% 和 89. 5% ~ 91. 2% , 而鹅 细 小 病 毒 间 为 93. 7% ~ 99. 8% 和 96. 8% ~ 99. 7% ,番 鸭 细 小 病 毒 间 为 98. 8% ~ 99. 8% 和 98. 6% ~ 99. 5% ; 鹅细小病毒和番鸭细小病毒 VP1 之间 核 苷 酸 和 氨 基 酸 同 源 性 分 别 为 79. 7% ~ 88. 7% 和 85. 5% ~ 93. 3% ,而相应的鹅细小病毒 间为 88. 8% ~ 99. 6% 和 91. 5% ~ 99. 2% ,番鸭细 小病毒间为 98. 1% ~ 99. 6% 和 97. 1% ~ 98. 8% 。 娄华等[9]( 2001) 将 MDPV - Q VP2 蛋白基因序列
收稿日期: 2012 - 03 - 26; 修回日期: 2013 - 01 - 12 作者简介: 鲜思美( 1974 - ) ,女,贵州遵义人,博士,副教授。研究方向: 预防兽医学。E - mail: xiansimei2005@ 163. com
第1 期
鲜思美: 鹅细小病毒与番鸭细小病毒差异分析及鉴别诊断方法研究进展
与 GPV VP2 蛋白基因序列进行了比较,发现其同 源性只有 80. 5% 。季芳等[10]( 2004) 比较了 MDPV GD 株和 GPV GD 株,基 因 组 同 源 性 达 81. 30% , VP1 基因编码的核苷酸的同源性为 87% ,VP2 基因 核苷酸同源性为 84% ,VP3 基因核苷酸同源性为 80% 。两种病毒的 VP2 至 VP3 起始密码子之间的 核苷酸存在较大差异,其同源性仅为 64% 。GPV 和 MDPV 的 Rep 基因的同源性达 90. 6% 。孔宪刚 等[11]( 2005 ) 将 GPV HG5 /82 株基 因 与 MDPV 的 NS 基因进行序列比较,核苷酸同源性为 81% ,氨 基酸同源性为 89% ,有 65 个氨基酸发生变异,主 要集中在 NS 蛋白的羧基端。将HG5 /82 与国外发 表的 MDPV FM 株的结构基因进行比较,其核苷酸 及氨基酸序列同源性分别为 80% 和 85% 。其中有 102 个氨基酸发生变异,主要集中在 VP2 和 VP3 起 始密码子之间的 146 ~ 198 位氨基酸。GPV VP2 起 始密码子为不典型的 ACG,而 MDPV VP2 的起始 密码子为典型的 ATG。GPV 结构基因中的 4 个糖 基化位点有 3 个,与 MDPV 相同,而位于结构基因 700 ~ 702 位的 NFS 在 MDPV 中变为 NFG。MDPV 结构基因共有 6 个糖基化位点,位于 3 个结构基因 的共同区。GPV 与 MDPV 氨基酸序列在 440 ~ 530 位变化较大,其中 GPV 结构基因在 443 ~ 445 位为 NFN,而 MDPV 在 此 为 糖 基 化 位 点 NFS; GPV 在 493 ~ 495 位为 NWN,而 MDPV 为 NWS。糖基化位 点与病毒和宿主细胞的吸附有关,是病毒感染宿主 的必需区,因此推测这些糖基化位点的差异可能与 病毒感染宿主的特异性有关。程由铨等[12]( 2001)
