铁及其化合物知识点、练—整理

铁及其化合物知识点
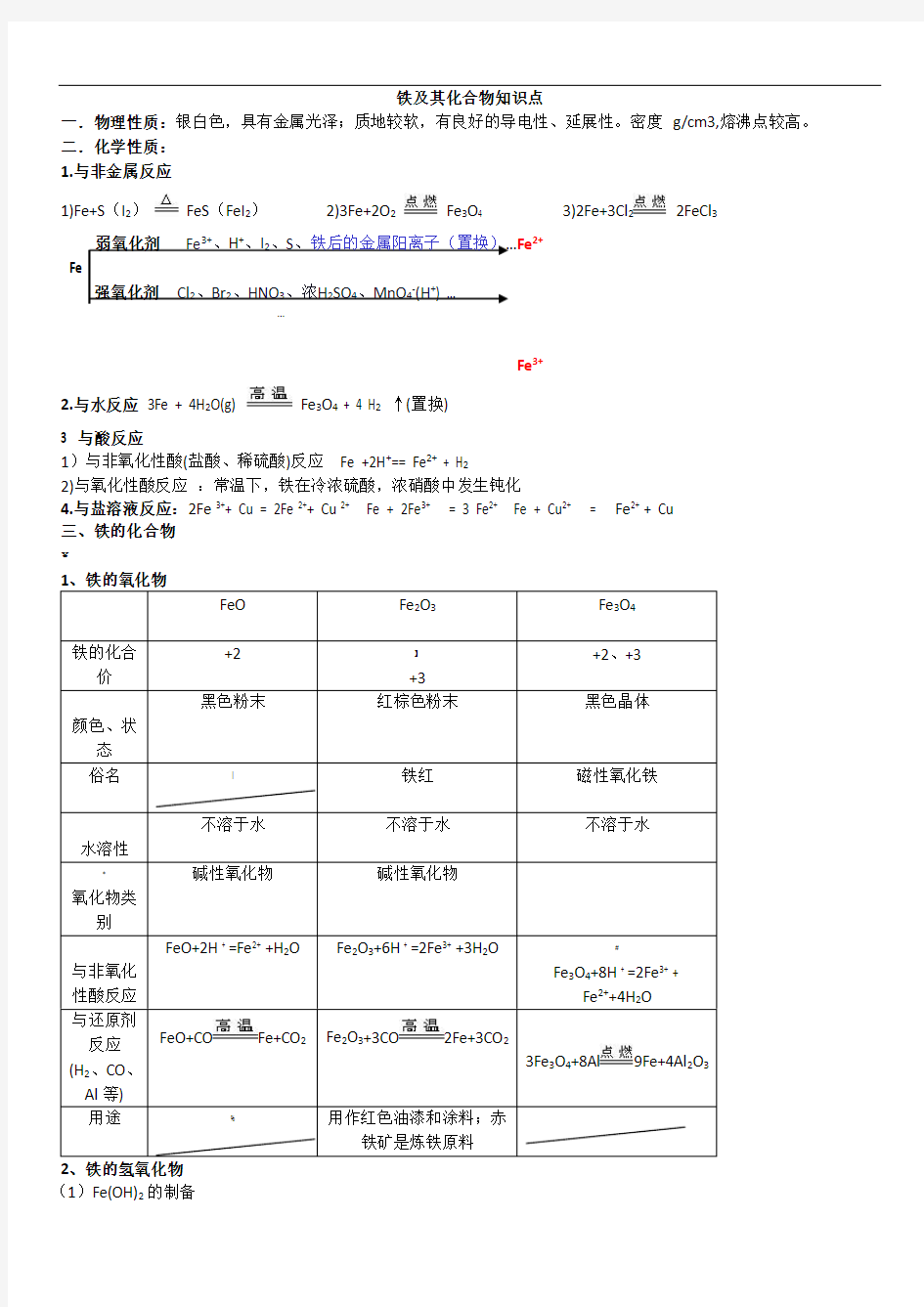
一.物理性质:银白色,具有金属光泽;质地较软,有良好的导电性、延展性。密度g/cm3,熔沸点较高。二.化学性质:
1.与非金属反应
1)Fe+S(I2)FeS(FeI2)2)3Fe+2O2Fe3O4 3)2Fe+3Cl22FeCl3
弱氧化剂Fe3+、H+、I2、S、铁后的金属阳离子(置换)…Fe2+
Fe
强氧化剂Cl2、Br2、HNO3、浓H2SO4、MnO4-(H+) …
…
Fe3+
2.与水反应3Fe + 4H2O(g) Fe3O4 + 4 H2↑(置换)
3 与酸反应
1)与非氧化性酸(盐酸、稀硫酸)反应Fe +2H+== Fe2+ + H2
2)与氧化性酸反应:常温下,铁在冷浓硫酸,浓硝酸中发生钝化
4.与盐溶液反应:2Fe 3++ Cu = 2Fe 2++ Cu 2+Fe + 2Fe3+ = 3 Fe2+ Fe + Cu2+ = Fe2+ + Cu
三、铁的化合物
¥
FeO Fe2O3Fe3O4
铁的化合
价+2】
+3
+2、+3
颜色、状
态
黑色粉末红棕色粉末黑色晶体俗名|铁红磁性氧化铁水溶性
不溶于水不溶于水不溶于水
*
氧化物类
别
碱性氧化物碱性氧化物
与非氧化性酸反应FeO+2H + =Fe2+ +H2O Fe2O3+6H + =2Fe3+ +3H2O#
Fe3O4+8H + =2Fe3+ +
Fe2++4H2O
与还原剂
反应(H2、CO、Al等)FeO+CO Fe+CO2Fe2O3+3CO2Fe+3CO2
3Fe3O4+8Al9Fe+4Al2O3
用途%用作红色油漆和涂料;赤
铁矿是炼铁原料
2、铁的氢氧化物
(1)Fe(OH)2的制备
Fe(OH)2易被氧化,在制备时应注意(1)配制后的FeSO4溶液中要加入少量铁粉;(2)配制溶液的蒸馏水以及所用NaOH 溶液均须煮沸以除去其中溶解的氧气;(3)Fe2+容易被氧化,所以FeSO4溶液要新配制. (4)为了防止滴加NaOH时带入空气,可将吸收NaOH的长滴管伸入FeSO4溶液液面下,再挤出NaOH溶液.(5)为了防止Fe2+被氧化,还可以向盛有FeSO4溶液的试管中加入少量煤油或其它密度比水小但不溶于水的有机物以隔绝空气.
实验:FeSO4溶液中加NaOH.
】
现象:生成白色沉淀,后又迅速转变为灰绿色,最后生成红褐色
化学方程式:FeSO4 + 2NaOH = Fe(OH)2↓+Na2SO4Fe2++ 2OH -= Fe(OH)2↓(白色)
4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3(红褐色)
(白色→灰绿色→红褐色)
(2)Fe(OH)3的制备
实验:FeCl3溶液中加NaOH溶液.
①现象:生成红褐色沉淀
~
②化学方程式:FeCl3+3NaOH= Fe(OH)3↓+3NaCl Fe 3++ 3OH -= Fe(OH)3↓(红褐色)
③热稳性:Fe(OH)3对热不稳定,受热能失去水生成红棕色的Fe2O3粉末.
化学方程式:2Fe(OH)3Fe2O3 +3H2O
[小结]难溶性或微溶性的碱受热不稳定,容易分解。生成相应的氧化物和水
(3)Fe(OH)3胶体的制备
向加热沸腾的蒸馏水中加入FeCI3溶液,待出现红褐色时,停止加热,便可得到Fe(OH)3胶体。制备时要注意:⑴不可长时间加热,因为加热会使胶体凝聚;⑵不能用自来水,因为自来水中的电解质也可使胶体凝聚。
四.铁盐和亚铁盐
(1)Fe3+、Fe2+的检验:
[
Fe3+的检验:
+盐溶液中滴加KSCN溶液。
现象是溶液变红色,反应方程式:FeCl3+3KSCN= Fe(SCN)3+3KClFe 3++3SCN -= Fe(SCN)3(红色)
2.向Fe3+盐溶液中滴加NaOH溶液。
现象是产生红褐色沉淀,反应方程式:FeCl3+3NaOH= Fe(OH)3↓+3NaClFe 3++ 3OH -= Fe(OH)3↓(红褐色)
3.观察法:Fe3+黄色或棕黄色的溶液
Fe2+的检验:
①"
②向Fe2+盐溶液中滴加KSCN溶液,再滴加氯水(硝酸、H2O2等)。现象是先无现象,加氯水后溶液呈红色
反应方程式:2FeCl2+Cl2=2FeCl3FeCl3+3KSCN= Fe(SCN)3+3KCl
②向Fe2+盐溶液中滴加NaOH溶液。现象是产生白色沉淀迅速转变为灰绿色,最后变成红褐色沉淀
反应方程式:FeCl2+2NaOH= Fe(OH)2↓+2NaCl 4Fe(OH)2+O2+2H2O=4Fe(OH)3(红褐色)
③观察颜色:Fe2+溶液呈浅绿色
(2)Fe3+的氧化性、Fe2+的还原性
①Fe3+的氧化性:
:
向FeCl3溶液中加入铁粉,现象是溶液由棕黄色变为浅绿色
化学反程式2FeCl3+Fe=2FeCl2 对应离子方程式:2Fe3+(棕黄色)+Fe=3Fe2+(浅绿色)
②Fe2+的还原性:Fe2+在较强的氧化剂的作用下会被氧化为Fe3+
向FeCl 2溶液中通入氯气,现象是溶液由浅绿色变为棕黄色
化学反程式:2FeCl 2+Cl 2=2FeCl 3 对应离子方程式:2Fe 2++Cl 2= 2Fe 3++2Cl - 除杂: FeCl 3(FeCl 2) 滴加氯水 FeCl 2 (FeCl 3) 加入铁粉
跟踪练习
·
①③
⑥Fe 3O 4 Fe FeCl 2 Fe(OH)3
⑩
—————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————— 1.能说明一定是金属元素的事实是( )
A 原子最外层只有1个电子的元素
B .在化学反应中能失去电子的原子
C . 在化合物中只有正价没有负价的元素
D .能跟非金属反应的物质
2.往浅绿色的Fe (NO 3)2 溶液中逐滴加入稀盐酸时,溶液的颜色变化应该是( ) A .绿色变深 B .变棕黄色 C .颜色变浅 D .无现象 -
3.制印刷电路时常用氯化铁溶液作为“腐蚀液”,发生的反应为2FeCl 3+Cu =2FeCl 2+CuCl 2。
向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,反应结束后,下列结果不可能出现的是( )
A. 烧杯中有铜无铁
B. 烧杯中有铁无铜
C. 烧杯中铁、铜都有
D. 烧杯中铁、铜都无 4.为了除去FeCl 2溶液中混有的少量FeCl 3,最好的方法是向此溶液中( ) A .通入氯气 B .加入Zn C .加入Fe D .加入Cu 5.能使铁溶解,但不能生成沉淀的溶液是( )
A .稀H 2SO 4
B .FeCl 3溶液
C .CuSO 4溶液
D .FeSO 4溶液
6.下列各物质中,不能由组成它的两种元素的单质直接化合得到的是( ) A. FeS B. FeCl 2 C. FeCl 3
7.硫酸亚铁溶液含有杂质硫酸铜和硫酸铁,为除去杂质,提纯硫酸亚铁,应该加入下列哪种物质( )A .锌粉 B .镁粉 C .铁粉 D . 铝粉 |
8.证明某溶液只含有Fe 2+
而不含有Fe 3+
的实验方法是( )
A .先滴加氯水,再滴加KSCN 溶液后显红色
B .先滴加KSCN 溶液,不显红色,再滴加氯水后显红色
C .滴NaOH 溶液,先产生白色沉淀,后变灰绿,最后呈红褐色
D .只需滴加KSCN 溶液
9.把a g 铁铝合金粉末溶于足量盐酸中,加入过量NaOH 溶液。过滤出沉淀,经洗涤、干燥、灼烧,得到红棕色粉末的质量仍为a g ,则原合金中铁的质量分数为( )
A. 70%
B. 52%
C. 47%
D. 30% 10.证明溶液中是否有Fe 2+,其操作正确的顺序是
①加少许酸化的KMnO 4溶液 ②加少许氯水 ③滴加少许KSCN 溶液 A .①② B .②③ C .①②③ D .③②
…
11.在含有1molFeSO4的溶液中投入一小块金属钠,反应完全后,滤出沉淀并洗涤之,然后在空气中灼烧沉淀得到的固体物质是
A.Fe B.FeO C.Fe(OH)3D.Fe2O3
12.将Na2O2投入FeCl2溶液中,可观察到的实验现象是
A.有白色沉淀生成
B.有红棕色沉淀生成
C.没有沉淀生成
D.有无色气体产生
13.下列离子在溶液中能大量共存的是
A.Fe3+、NH4+、SCN-、Cl-B.Na+、H+、NO3-、SO42-
C.Fe2+、Fe3+、Na+、NO3D.Fe2+、NH4+、Cl-、OH-
14.将Fe、Cu、FeCl2、FeCl3、CuCl2盛于同一容器中充分反应,如Fe有剩余,则容器中只能有的金属或金属离子是A.Cu、Fe3+B.Fe2+、Fe3+C.Cu、Cu2+、Fe D.Cu、Fe2+、Fe
15.下列反应,其产物的颜色按红、红褐、淡黄、蓝色顺序排列的是
①金属钠在纯氧中燃烧;②FeSO4溶液中滴入NaOH溶液,并在空气中放置一段时间;
③FeCl3溶液中滴入KSCN溶液;④无水硫酸铜放入医用酒精中。
A.②③①④
B.③②①④
C.③①②④
D.①②③④
16.把金属铁加入含FeCl3、FeCl2、CuCl2的混合液中充分反应后,
(1)铁全部溶解,且没有固体,则滤液中肯定有阳离子,肯定不存在阳离子,可能有阳离子
(2)过滤,滤出不溶物有铜,则滤液中肯定有阳离子,肯定不存在阳离子,可能有阳离子
(3)过滤,滤出不溶物有铁,则滤液中肯定有阳离子,肯定不存在阳离子,可能有阳离子
高考化学铁及其化合物考点全归纳
铁及其化合物 [考纲要求] 1.了解铁及其重要化合物的主要性质及其应用。2.以Fe2+、Fe3+的相互转化为例,理解变价金属元素的氧化还原反应。3.能鉴别溶液中的Fe2+、Fe3+。 考点一 用物质分类思想认识铁及其重要化合物 1.铁的存在 2.铁的性质 (1)物理性质 纯铁具有金属的共性,如具有银白色金属光泽和良好的延展性,是电和热的良导体,具有能被磁铁吸引的特性,纯铁有很强的抗腐蚀能力。 (2)化学性质:铁是较活泼的金属,发生化学反应时可生成+2、+3两种价态的化合物。 用化学方程式或离子方程式表示下列变化 Fe +???? —O2――→① ①3Fe+2O2=====点燃Fe3O4—Cl2――→② ②2Fe+3Cl2=====点燃2FeCl3—S ――→③ ③Fe+S=====△FeS Fe +H2O(g)――→④④3Fe+4H2O(g)=====高温Fe3O4+4H2 Fe —???? ――→⑤Fe2+ ⑤Fe+2H +===Fe2++H2↑、 Fe +Cu2+===Cu +Fe2+――→⑥Fe3+⑥Fe+4H ++NO -3===Fe3++NO↑+2H2O 3.铁的氧化物和氢氧化物 (1)铁的氧化物
(2)铁的氢氧化物 深度思考 1.铁有很强的抗腐蚀能力,为什么日常生活中的铁制品容易生锈? 答案 主要因为铁不纯,往往含有碳等杂质,当这些铁制品在潮湿的空气中或接触到电解质溶液(如食盐水)时会发生电化学腐蚀。 2.铁、铝遇浓硫酸或浓硝酸发生钝化,是物理变化还是化学变化? 答案 常温下铁、铝遇冷的浓HNO3、浓H2SO4时表面会生成一层致密的氧化物薄膜,化学上称为钝化,属于化学变化。 3.铁元素是典型的变价金属元素,它在化合物中主要表现为+2价和+3价,请归纳总结: (1)Fe 单质通常与哪些氧化剂反应生成+2价?写出有关反应的化学方程式或离子方程式。 答案 Fe→Fe2+:铁与氧化性比较弱的非金属单质(如S 、I2),非氧化性酸(如盐酸、稀硫 酸),不活泼金属的盐溶液(如CuSO4溶液)反应,都可实现这种转化。如:Fe +S=====△FeS,2H ++Fe===Fe2++H2↑,Cu2++Fe===Fe2++Cu 。 (2)Fe 单质通常与哪些氧化剂反应生成+3价?写出有关反应的化学方程式。 答案 Fe→Fe3+:铁与强氧化剂(如Cl2、HNO3、浓硫酸)在一定条件下反应都会实现这种 转化。例如:2Fe +3Cl2=====点燃2FeCl3,Fe +4HNO3(稀)===Fe(NO3)3+NO↑+2H2O,2Fe + 6H2SO4(浓)=====△Fe2(SO4)3+3SO2↑+6H2O 。 4.FeCl3、FeCl2和Fe(OH)3是否都可以通过化合反应制取? 答案 都可以。2Fe +3Cl2=====点燃2FeCl3 2FeCl3+Fe===3FeCl2 4Fe(OH)2+O2+2H2O===4Fe(OH)3
(完整版)高中思想政治必修一知识点:多彩的消费
高中思想政治必修一知识点:多彩的消 费 第三课多彩的消费 第一框消费及其类型 .影响消费水平的因素有哪些?(也可问成:提高消费水平的措施有哪些?) (1)根本原因:国家经济的发展水平; (2)居民的收入,它是消费的基础和前提;(居民的收入可以从以下三个情况来考虑:当前可支配收入;未来收入预期;社会收入差距) (3)物价总体水平:一般来说,物价上涨,人们的购买能力会降低; 物价下降,人们的购买能力会升高。 (4)其他因素:例如商品的质量、性能、服务、品牌等。 (提示:这四个都是影响消费水平的客观因素;影响消费水平的主观因素是人们的消费心理,如从众心理、求异心理、攀比心理和求实心理。) 2.收入与消费的关系是什么? (1)收入是消费的基础和前提; (2)具体说来,在其他条件不变的情况下,人们当前的可支配收入越高,人们对未来收入的预期越大,人们收入
的差距越小,人们的消费需求会越大,消费水平也会越高。 3.消费按照不同的划分依据可以分为几大类型? (1)根据交易方式的不同,可分为:钱货两清的消费、贷款消费和租赁消费; (贷款消费的显著特点:“花明天的钱,圆今天的梦”)(2)根据消费对象的不同,可分为:有形商品消费和劳务消费; (3)根据消费目的的不同,可分为:生存资料消费、发展资料消费和享受资料消费。 4.什么是消费结构?影响它的因素是哪两个? (1)含义:反映人们各类消费支出在消费总支出中所占的比重。 (2)影响因素/变化的原因:消费结构随着经济的发展和收入的变化而不断变化。 5.什么是恩格尔系数?它的计算公式是什么? (1)含义:恩格尔系数是指食品开支占家庭总支出的比重; (2)公式为:恩格尔系数=食品支出÷家庭总支出×100% (3)恩格尔系数减小有什么意义? ①恩格尔系数过大,必然影响其他消费支出,影响发展资料、享受资料的增加,限制消费层次和消费质量的提高。
人教版一年级上册语文知识点整理
人教版一年级上册语文知识点整理 一、反义词 大——小多——少来——回高——矮上——下里——外早——晚 远——近来——去黑——白笑——哭出——入天——地水——火 开——关东——西来——去长——短好——坏冷——热前——后 黑——白左——右东——西南——北高——低是——非远——近 外——内无——有慢——快老——少爱——恨有——无弯——直 降——胜圆——扁死——生反——正外——内古——今私——公 熟——生歪——正虚心——骄傲 诚实——虚伪冷淡——热情黑暗——光明失败——成功安全——危险 二、多音字组词 长zhǎnɡ(长大) 乐yuè(音乐) 行xínɡ(飞行) chánɡ(长江) lè(快乐) hánɡ(行业) 少shǎo(多少) 着zhe (看着) 都dōu(都是) 只zhī(一只) Shào(少年) zháo(着急) dū (首都) zhǐ(只要)
三、同音字练习 1、公,工 ( )园( )人( )正手( ) ( )开 (1)我家有只大( )鸡。(2 )小明的爸爸是木( ) 。 2、升,生,声 ( )日( )旗上( ) 花( ) 笑( ) 大( ) (1) 在走廊(lánɡ)上要小( )说话。(2) 今天是妈妈的( )日。 3、做,坐,座,作 工( ) ( ) 业( )下( ) 位事( ) 让( ) (1) 我家门前有一( ) 桥。(2)我在家里写( ) 业。 (3) 我( ) 汽车时给老爷爷让( ) 位。 4、木,目 耳( ) ( )光( )头( )耳树( ) (1 )妈妈让我吃( )耳。(2)老师的( )光很慈祥(cí xiánɡ )。 5、字,子,自 写( ) ( )己孩( ) 舍( ) 为人汉( ) 猴( ) 爸爸说:“儿( ),你要学会自( ) 写( ) 。” 6、金,今,巾,进,近 毛( ) ( )天远( ) ( )入黄( ) 纸( ) (1).妈妈给我买了一条( ) 黄色的头( ) 。 (2). ( )年我在离(lí)家很( )的学校上学。 (3)、我最( ) ( ) 步了。
高一地理必修一第二章知识点总结梳理
第二章地球上的大气;第一节冷热不均引起大气运动;一、大气的组成及氮、氧、二氧化碳、水汽、臭氧和固;氧--生命活动必需的物质;二氧化碳--光合作用原料;保温作用臭氧--地球生;水汽和固体杂质--成云致雨;杂质:凝结核二、大气;1.对流层的特点:①随高度增加气温降低②大气对流;三、大气的受热过程;1、根本能量源:太阳辐射(各类辐射的波长范围及太;吸收(选择性)臭氧 第二章地球上的大气 第一节冷热不均引起大气运动 一、大气的组成及氮、氧、二氧化碳、水汽、臭氧和固体杂质等主要成分的作用低层大气组成:稳定比例的干洁空气(氧氮为主)、含量不稳定的水汽、固体杂质氮--生物体基本成分 氧--生命活动必需的物质 二氧化碳--光合作用原料;保温作用臭氧--地球生命保护伞,吸收紫外线 水汽和固体杂质--成云致雨;杂质:凝结核二、大气的垂直分层及各层对人类活动的影响1.对流层的特点:①随高度增加气温降低②大气对流运动显著③天气复杂多变2.平流层的特点:①随高度增加温度升高②大气平稳有利于高空飞行③包含臭氧层 三、大气的受热过程 1、根本能量源:太阳辐射(各类辐射的波长范围及太阳辐射的性质--短波辐射) 2、大气的受热过程(大气的热力作用)--太阳晒热大地,大地烤热大气 3、大气对太阳辐射的削弱作用:三种形式及各自现象(用实例说明) 吸收(选择性臭氧-紫外线、CO2-红外线)、散射(有一点选择性小颗粒优先散射短波光-兰紫光)、反射(无选择性云层) 影响削弱大小的主要原因:太阳高度角(各纬度削弱不同)4、大气对地面的保温作用:了解地面辐射(红外线长波辐射);大气辐射(红外线长波辐射)保温作用的过程:大气强烈吸收地面长波辐射;大气逆辐射将热量还给地面(图示及实例说明--如霜冻出现时间;日温差大小的比较) 保温作用的意义:减少气温的日较差;保证地球适宜温度;维持全球热量平衡5、太阳辐射(光照)的影响因素:纬度、天气、地势、大气透明度、太阳高度四、热力环流 1、大气运动的根本原因:冷热不均(各纬度之间;海陆之间) 2、大气运动形式: 最简单形式:热力环流(图示及说明);举例:城郊风;海陆风;季风主要原因3、热力环流分解:冷热不均引起大气垂直运动4、水平气压差:水平气流由高压流向低压5、形成风的根本原因:冷热不均 形成风的直接原因:水平压差(或水平气压梯度力) 6、影响风的三个力:水平气压梯度力;地转偏向力;地表磨擦力 风向的决定:1力风(理论风)--垂直于等压线,高压指向低压.2力风(高空风)--平行于等压线,北右偏,南左偏.3力风(实际地表风)--斜穿等压线,北右偏,南左偏 7、风向:1、风向-—风来的方向;2、根据等压线的分布确定风向
铁及其化合物知识点
铁和铁的化合物知识点归纳 一、铁的结构和性质 1、铁是26号元素,位于第四周期第Ⅷ族,属于过渡元素。 原子结构示意图: 2.铁的物理性质:纯净的铁是光亮的银白色金属,密度为7.86g/㎝3,熔沸点高,有较好的导电、传热性,能被磁铁吸引,也能被磁化。还原铁粉为黑色粉末。 3.铁的化学性质:鉄是较活泼的金属,在金属活动性顺序表中排在氢的前面。 ①跟非金属反应:与氧气: 与氯气: 与硫: ②跟水反应: ③跟酸作用: (遇冷浓硝酸、浓硫酸钝化;与氧化性酸反应不产生H ,且氧化性酸过量时生成Fe3+) 2 ④与部分盐溶液反应:与硫酸铜溶液反应 与氯化铁溶液反应 二、铁的氧化物和氢氧化物 三、Fe、Fe2+和Fe3+之间相互转化及检验 1.具体反应有: (1)Fe2+→Fe3+
①2Fe2++Cl 2 =2Fe3++2Cl-(在亚铁盐溶液中通入氯气,溶液由浅绿色变为棕黄色)。 ②3Fe2++NO 3-+4H+=3Fe3++2H 2 O+NO↑ ③2Fe2++H 2O 2 +2H+=2Fe3++2H 2 O (2)Fe3+→Fe2+ ①2Fe3++Fe=3Fe2+,在FeSO 3 溶液中往往要加铁的原因是可以防止Fe2+被氧化为Fe3+。 ②2Fe3++Cu=2Fe2++Cu2+,电路板的制作是利用FeCl 3 溶液与裸露的铜反应。 ③2Fe3++2I-=2Fe2++I 2 2.Fe2+和Fe3+的检验 (1)Fe2+的检验: 方法一:滴加KSCN溶液,无明显现象,再滴加新制氯水,溶液立即变红色。 方法二:滴加NaOH溶液,生成白色絮状沉淀,该沉淀迅速变为灰绿色,最后变为红褐色。 (2)Fe3+的检验: 方法一:滴加KSCN溶液或NH 4 SCN溶液,溶液立即变为血红色。 方法二:滴加NaOH溶液,出现红褐色沉淀。 3.例题精讲 例1.把铜粉和过量的铁粉加入到热的浓硝酸中,充分反应后,溶液中大量存在的金属阳离子是() A.只有Fe2+ B.只有Fe3+ C.有Fe2+和Cu2+ D.有Fe3+和Cu2+ 例2.由FeO、Fe 2O 3 和Fe 3 O 4 组成的混合物,测得其中铁元素与氧元素的质量比 为21:8,,则这种混合物中FeO、Fe 2O 3 和Fe 3 O 4 的物质的量之比是()。 A.1:2:1 B. 2:1:1 C. 1:1:1 D. 1:1:3 例3.将8gFe 2O 3 投入150mL某浓度的稀硫酸中,再投入7g铁粉收集到1.68LH 2 (标准状况),同时,Fe和Fe 2O 3 均无剩余,为了中和过量的硫酸,且使溶液中铁元 素完全沉淀,共消耗4mol/L的NaOH溶液150mL。则原硫酸的物质的量浓度为()。 A.1.5mol/L B.0.5mol/L C.2mol/L D.1.2mol/L 4.实战演练 一、选择题 1.(2002年全国高考题)铁屑溶于过量的稀硫酸,过滤后向滤液中加入适量硝酸,再加入过量的氨水,有红褐色沉淀生成。过滤,加热沉淀物至质量不再发生变 化,得到红棕色的残渣。上述沉淀和残渣分别为 A.Fe(OH)3;Fe2O3 B.Fe(OH)2;FeO C.Fe(OH)2、Fe(OH)3;Fe3O4 D.Fe2O3;Fe(OH)3 2.要证明某溶液中不含Fe3+而可能含有Fe2+进行如下实验操作时最佳顺序为 ①加入足量氯水②加入足量KMnO4溶液③加入少量NH4SCN溶液
多彩的消费知识点总结
多彩的消费知识点总结 多彩的消费知识点总结 1、影响消费的因素 A、最主要的是居民收入和消费品价格 B、影响消费的根本因素:经济发展水平 (1)收入是消费是前提和基础。 收入增长较快的时期,消费增长也比较快;收入增长速度下降时,消费增幅也下降。 要提高居民的生活水平,必须保持经济的稳定增长,增加居民收入。 居民消费水平不仅取决于当前的收入,而且受未来收入预期的影响。 社会总体消费水平的高低与人们收入差距的大小有密切的联系。人们的收入差距过大,总体消费水平会降低。 (2)商品价格高低影响人们的消费选择。 物价上涨,购买力普遍降低;物价下跌,购买力普遍提高。 基本生活消费品受价格水平变动的影响要远远低于奢侈品。 活学活用:请说出几种促销手段: 提示:商品的性能、外观、质量、包装、购买方式、商店位置、服务态度、售后维修、保养情况等方面的变化都可能带来消费者不同的消费选择。 2、分析 由俭入奢易,由奢入俭难。一个过去收入水平和消费水平都较高的人,
在可支配收入减少的情况下,短期内仍然会力图保持已经达到的较高的消费水平,而不会立即削减消费支出。 3、消费的类型 (1)按照产品类型不同分为有形商品消费和劳务消费。 (2)按照交易方式不同分为钱货两清的消费、贷款消费、租赁消费三种。 (3)按照消费目的不同分为生产资料消费、发展资料消费、享受资料消费 4、食品支出、发展资料支出、享受性资料支出哪一项支出在家庭消费总支出占比重越小,证明该家庭消费水平越高? 答:消费结构反映人们各类消费支出在消费总支出中所占的比重。食品支出占家庭总支出的比重,被称为恩格尔系数。恩格尔系数越小,人们生活水平越高。反之,越低。 相关材料分析题型: 济南市统计局发布信息:私家车和商品房成为省城居民2004年增势最强的主要消费品。到现在,全市私家汽车总量已达11.2万辆,按济南城乡居民统算,每百户居民拥有量已达6.5辆。而个人住房购买量也比上年增长了55.8%。 运用相关知识,回答材料体现的经济知识。 分析:材料表明汽车和住房消费已成为市民除食品消费外的最大的消费类别,消费结构反映人们各类消费支出在消费总支出中所占的比重。食品支出占家庭总支出的比重,被称为恩格尔系数。恩格尔系数越小,人们生活水平越高。反之,越低。所以由材料可知济南的社会消费结构正向发
人教版一年级上册知识点汇总(详细总结)
人教版一年级上册知识点汇总 第一单元: 数10以内的数:数数时,按一定的顺序数,从1开始,数到最后一个物体所对应的那个数,即最后数到几,就是这种物体的总个数。 一一对应法比较物体的多少:当两种物体一一对应后,都没有剩余时,就说这两种物体的数量同样多。当两种物体一一对应后,其中一种物体有剩余,有剩余的那种物体多,没有剩余的那种物体少。 第二单元: 用上下描述物体的相对位置:从两个物体的位置理解:上是指在高处的物体,下是指在低处的物体。 用前后描述物体的相对位置:一般指面对的方向就是前,背对的方向就是后。 用左右描述物体的相对位置:以自己的左手、右手所在的位置为标准,确定左边和右边。右手所在的一边为右边,左手所在的一边为左边。在确定左右时,除特殊要求,一般以观察者的左右为准。 第三单元: 1~5的认识:每个数都可以表示不同物体的数量。有几个物体就用几来表示。 比较5以内数的大小:前面的数等于后面的数,用“=”表示,即3=3,读作3等于3。前面的数大于后面的数,用“>”表示,即3>2,读作3大于2。前面的数小于后面的数,用“<”表示,即3<4,读作3小于4。填“>”或“<”时,开口对大数,尖角对小数。
认识5以内数的顺序:确定物体的排列顺序时,先确定数数的方向,然后从1开始点数,数到几,它的顺序就是“第几”。第几指的是其中的某一个。 5以内数的分与合:一个数(1除外)分成几和几,先把这个数分成1和几,依次分到几和1为止。例如:5的组成有1和4,2和3,3和2,4和1。把一个数分成几和几时,要有序地进行分解,防止重复或遗漏。 5以内数的加法的含义与计算:把两部分合在一起,求一共有多少,用加法计算。计算5以内数的加法,可以采用点数、接着数、数的组成等方法。其中用数的组成计算是最常用的方法。 5以内数的减法的含义与计算:从总数里去掉(减掉)一部分,求还剩多少用减法计算。计算减法时,可以用倒着数、数的分成、想加算减的方法来计算。 0的意义:表示一个也没有。 0与5以内数的加减:任何数与0相加都得这个数,任何数与0相减都得这个数,相同的两个数相减等于0。 第四单元: 认识长方体、正方体、圆柱、球:长方体的特征是长长方方的,有6个平平的面,面有大有小;正方体的特征是四四方方的,有6个平平的面,面的大小一样;圆柱的特征是直直的,上下一样粗,上下两个圆面大小一样。放在桌子上能滚动立在桌子上不能滚动;球的特征是圆圆的,很光滑,它的表面是曲面。放在桌子上能向任意方向滚动。
化学必修二 第二章知识点总结
第二章 化学反应与能量 第一节 化学能与热能 1、在任何的化学反应中总伴有能量的变化。 原因:当物质发生化学反应时,断开反应物中的化学键要吸收能量,而形成生成物中的化学键要放出能量。化学键的断裂和形成是化学反应中能量变化的主要原因。 一个确定的化学反应在发生过程中是吸收能量还是放出能量,决定于反应物的总能量与生成物的总能量的相对大小。 E 反应物总能量>E 生成物总能量,为放热反应。 E 反应物总能量<E 生成物总能量,为吸热反应。 2、常见的放热反应和吸热反应 ①所有的燃烧与缓慢氧化。 ②酸碱中和反应。 ③金属与酸反应制取氢气。 ④大多数化合反应(特殊:C +CO 22CO 是吸热反应)。 ① 多数分解反应,如KClO 3、、CaCO 3的分解等。 ②C +CO 22CO ③铵盐和碱的反应,Ba(OH)2·8H 2O +NH 4Cl =BaCl 2+2NH 3↑+10H 2O [思考]放热反应都不需要加热,吸热反应都要加热,这种说法对吗? 点拔:不对。如C +O 2=CO 2的反应是放热反应,但需要加热,只是反应开始后不再需要加热,反应放出的热量可以使反应继续下去。NH 4Cl 与Ba(OH)2·8H 2O 的反应是吸热反应,但反应并不需要加热。 第二节 化学能与电能 1、 能源的分类: 一次能源:直接从自然界取得的能源称为一次能源,如流水、风 力、煤、石油、天然气等、 △ △ 常见的放热反应: 常见的吸热反应:
二次能源:一次能源经过加工、转化得到的能源称为二次能源, 如电力、蒸汽等。 2、原电池 (1)概念:把化学能直接转化为电能的装置叫做原电池。 (2)原电池的工作原理:发生氧化还原反应(有电子的转移)。(3)构成原电池的条件: ①活泼性不同的两种金属做电极(或其中一种是非金属); ②电极材料均插入电解质溶液中; ③两级构成闭合回路。 (4)电极名称及发生的反应: 负极:较活泼的金属作负极,负极发生氧化反应, 电极反应式:较活泼金属-ne-=金属阳离子 【Zn-2e-=Zn2+ 】 负极现象:负极溶解,负极质量减少。 正极:较不活泼的金属或石墨作正极,正极发生还原反应,电极反应式:溶液中阳离子+ne-=单质【2H++2e-=H2↑】正极的现象:一般有气体放出或正极质量增加。 总反应方程式:把正极和负极反应式相加而得【Zn + 2 H+ = Zn2+ + H ↑】 2(5)原电池正负极的判断方法: ①依据原电池两极的材料: 较活泼的金属作负极(K、Ca、Na太活泼,不能作电极); 较不活泼金属或可导电非金属(石墨)等作正极。 ②根据电流方向或电子流向:(外电路)电子:负极→导线→正极。 (电流由正极流向负极); ③根据原电池中的反应类型: 负极:失电子,发生氧化反应,现象通常是电极本身消耗,质量减小。
铁和铜及其化合物知识点
铁及其化合物知识点 一.物理性质:银白色,具有金属光泽;质地较软,有良好的导电性、延展性。密度7.86 g/cm3,熔沸点较高。 位置:第四周期,第Ⅷ 族 二.化学性质:1.与非金属反应 1)Fe+S (I 2) FeS (FeI 2) 2)4Fe+3O 2 2Fe 3O 4 3)2Fe+3Cl 2(Br 2) 2FeCl 3 弱氧化剂 Fe 3+、H +、I 2、S 、铁后的金属阳离子(置换)… Fe 2+ Fe 3+ 2.与水反应 3Fe + 4H 2O(g) Fe 3O 4 + 4 H 2 ↑(置换) 注意:铁在常温下不会和水发生反应,但在水和空气中O 2和CO 2的共同作用下,铁却很容易被腐蚀(生锈/电化学腐蚀) 3 与酸反应 1)与非氧化性酸反应 Fe +2H + == Fe 2+ + H 2 2)与氧化性酸反应 a )常温下,铁在冷浓硫酸,浓硝酸中发生钝化 b )与浓硫酸反应:2Fe +6 H 2SO 4(浓) Fe 2(SO 4)3 +3SO 2 +6 H2O c)与稀硝酸反应:①当Fe 少量时,离子方程式为:Fe + 4H + + NO 3-== Fe 3++NO↑+2H 2O ②当Fe 过量时,,离子方程式为:3Fe+8H ++2NO 3-== 3Fe 2++2NO↑+4H 2O ③当1:4<n( Fe) :n (HNO 3)<3:8 时,此情况下,Fe 3+ 和Fe 2+ 共存。 4.与盐溶液反应 2Fe 3++ Cu = 2Fe 2++ Cu 2+ Fe + 2Fe 3+ = 3 Fe 2+ Fe + Cu 2+ = Fe 2+ + Cu 三、铁的化合物
浙教版科学七年级上第二章知识点整理
第2章观察生物 生物与非生物 1.生物对刺激有反应,非生物对刺激没有反应。所有生物都具有共同的特征:能呼吸、能生长、能繁殖后代、对外界刺激有反应、能遗传和变异、能进化。 蜗牛:触角两对,口(摄取食物);足(腹足)运动、爬行;眼;壳(保护)。有视觉、触觉、味觉、嗅觉。没听觉。 2.我们把生物对外界刺激做出反应的特征叫做生物的应激性。 3.生物与非生物的差别: 生物非生物 1对刺激有反应(有应激性)对刺激没有反应(无应激性) 2能生长不能生长 3需要营养(会新陈代谢)不需要营养(不会新陈代谢) 4有严整的结构无严整的结构 5能生殖和发育不能生殖和发育 6有遗传和变异的特性没有遗传和变异的特性 7能适应环境、影响环境不能适应环境、影响环境 4.动物与植物最主要的 2 个区别: (1)运动:有些植物可以局部运动,动物可以自由快速运动。 (2)光合作用:植物可以,动物不可以。 细胞 年,英国科学家罗伯特·胡克用自制的显微镜观察木栓切片时,发现了细胞。细胞很小,一般只有一到几十微米之间。 2.动物和植物都是由相同的基本单位—— 细胞构成的。 3.动物细胞 细胞膜:保护作用,并且控制细胞与外界 物质交换。 细胞质:许多生命活动的场所。
细胞核:球状,含有遗传物质,起传宗接代的作用。 4.植物细胞 细胞壁:最外层,由纤维素组成,具 有支持保护作用,使植物具有一定的形 状。 叶绿体:内含叶绿素,是进行光合作 用的场所,椭圆形。 液泡:含有细胞液。 细胞膜:保护作用,并且控制细胞与 外界物质交换。 细胞质:许多生命活动的场所。 细胞核:球状,含有遗传物质,起传宗接代的作用。 5.植物细胞和动物细胞的结构比较: 植物细胞和动物细胞都具有细胞膜,细胞质,细胞核。除此之外,植物细胞还有细胞壁,液泡,叶绿体。 年英国科学家布朗发现了植物细胞内有细胞核。19 世纪 40 年代,德国科学家施莱登和施旺提出了动物和植物都是由相同的基本单位——细胞所构成。 显微镜的结构与使用 (1)镜和物镜:两者结合起来,有放大作用。它们的放大倍数分别可在目镜和物镜上面,目镜和物镜放大倍数的乘积就是显微镜的放大倍数。物镜越长,倍数越高。目镜越短,倍数越高。
高一政治《消费及其类型》知识点汇总
高一政治《消费及其类型》知识点汇总 一、知识回顾 材料一:近年来,我国汽车特别是轿车的价格呈现不断下降的趋势,每年的下降幅度达两成左右。 材料二:近年来,在国内汽车市场旺盛需求的刺激下,我国汽车制造业和汽车服务贸易业的投资急剧扩张,但汽车产业组织结构与国际上相比明显落后,XX年共有123家整车生产厂,遍布全国27个省级单位。其中产量超过50万辆的只有2家,超过10万辆的只有8家,产量不足1万辆的达95家,其中产量在1000辆以下的有70家。XX年,我国取消汽车进口许可讧和进口配额限制之后,汽车市场与国际汽车市场融为一体,国内市场的国际化使我国汽车生产企业面临严峻的挑战。 材料三:XX年以来,由于汽油价格持续走高,虽然普通汽车价格不断下降,但销售依然没能走出低谷,大排量汽车由于受消费税增加影响,价格不断上升,人们把眼光更多的投向小排量汽车和电动自行车,从而带动了小排量汽车生产热潮,特别是电动自行车的生产和销售更是异常火爆。 为什么汽油价格的提高使得汽车销售遭遇尴尬?人们为什么把眼光更多的投向小排量汽车和电动自行车? 二、自主学习 (一)影响消费水平的因素
.根本因素是 。 2.主要因素是 、 。 (1)居民收入是消费的 。 ①在其他条件不变的情况下, 越多,对各种商品和服务的消费量就越大。 ②居民消费水平不仅取决于当前的收入,而且受的影响。 ③社会总体消费水平的高低与人们 的大小有密切的关系。 (2)物价总体水平 一般来说,物价 ,人们的购买力普遍降低,会 对商品的消费量;物价 ,人们的购买力普遍提高,会
对商品的消费量。 (二)消费的类型 .按照交易方式分为 、 、 。 2.按照消费对象分为 、 3.按照消费的目的分为 、 、 。其中 消费满足较低层次衣食住行的需要,是最 的消费。随着经济发展水平的提高,人们会越来越追求和 ,这时 资料和 资料的消费将逐渐增加。 (三)消费结构 .消费结构的含义
一年级数学上册概念知识点整理
一年级数学上册概念知识点整理 一、读数、写数。 1、读20以内的数。 顺数:从小到大的顺序0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 倒数:从大到小的顺序20 19 18 17 ······ 单数:1、3、5、7、9 、11、13、15、17、19 双数:2、4、6、8、10 、12、14、16、18、20 2、两位数 (1)十个“1”就是一个“10”,一个“10”就是十个“1”。 如: 11里有(1)个十和(1)个一; 11里有(11)个一。 12里有(1)个十和(2)个一; 12里有(12)个一 13里有(1)个十和(3)个一; 13里有(13)个一 14里有(1)个十和(4)个一; 14里有(14)个一 15里有(1)个十和(5)个一; 15里有(15)个一 ······ 19里有(1)个十和(9)个一;或者说,19里有(19)个一 20里有(2)个十; 20里有(20)个一 (2)在计数器上,从右边起第一位是什么位?(个位)个位上的1颗珠子表示什么?(表示1个一) 第二位是什么位?(十位)十位上的1颗珠子表示什么?(表示1个十)(3)先读11、12、13、14、15、16、17、18、19、20,再写出来。 如:14,读作:十四,写作:14。 个位上是4,表示4个一,十位上数字是1,表示1个十。 二、比较大小和第几。 1、例如给数字娃娃排队:5、6、10、3、20、17,可以按从大到小的顺序排列,也可以按从小到大的顺序排列。(注意:写一个数字,划去一个,做到不重不漏。) 20 2 、任意取 以内的两个数 能够用谁比谁大或谁比谁小说一句话。 , 如:16比15大,写出来就是16>15 读作:16大于15 9比13小,写出来就是9<13 读作:9小于13(开口朝左> 是“大于”,开口朝右是“小于”) 3、“比”字的用法看“比”字的后面是谁,比几大1就要在几的基础上加1,比几小1就要在几的基础上减1。 如:比5小2的数是(3), 比4多3的数是(7)。 4、几和第几 △▲▲★△☆☆△△△▲★★★☆★
七年级数学上册第二章知识点总结
第二章整式的加减 整式的概念: 单项式与多项式统称整式。 (分母含有字母的代数式不是整式) 一、单项式:都是数或字母的积的式子叫做单项式。 1.单项式的系数:单项式中的数字因数。 2.单项式的次数:一个单项式中所有字母的指数的和 。 注意 ① 圆周率π是常数; ② 只含有字母因式的单项式的系数是1或-1,“1”通常省略不写。 例:x 2 ,-a 2 b 等; ③ 单项式次数只与字母指数有关。例:23πa 6 的次数为 。 ④ 单项式的系数是带分数时,应化成假分数。 ⑤ 单项式的系数包括它前面的符号。 例:h 2.1-系数是 。 ⑥ 单独的一个数字是单项式,它的系数是它本身;非零常数的次数是0。 考点: 1.在代数式:n 2,33-m ,2 2-,3 2m -,22b π,0中,单项式的个数有( ) A. 1个 B.2个 C.3个 D.4个 2.单项式- 3 22 4c ab 的系数与次数分别是( ) A. -2, 6 B.2, 7 C.3 2-, 6 D.3 2-, 7 3.25ab π-的系数是_____________.
4.判断下列式子是否是单项式,是的√,不是的打X x ab 2 ; a ; 2 5ab - ; y x + ; 85.0- ; 21+x ; 2x ; 0 ; 7x ; 2(1)a - ;6 2a - ; 1xy ; x π ; x π 5.写出下列单项式的系数和次数 3 a -的系数是______,次数是______; 25ab 的系数是______,次数是______; a 2bc 3 的系数是_____,次数是_____; 23 7 x y π的系数是_____,次数是_____; 3 y x -2的系数是______,次数是______; 23xy z -的系数是_____,次数是_____; 53x 2 y 的系数是_____,次数是______; 6.如果1 2b x -是一个关于x 的3次单项式,则 b=_______;若6 a -1 -m b 是一个4次 单项式,则m=_____;已知28m x y -是一个6次单项式,求210m -+的值 。 7.写出一个三次单项式__________,它的系数是_______;写一个系数为3,含有两个字母a ,b 的四次单项式_______。 知识点回顾 1.单项式的定义:_________________________________叫做单项式。 2.单项式的系数:_________________________________叫做单项式的系数。 3.单项式的次数:_________________________________叫做单项式的次数
高一政治《多彩的消费》知识点总结新人教版
高一政治《多彩的消费》知识点总结新人教 版 影响消费的因素 生活消费发生如此大的变化是因为受多种因素的影响:社会经济发展水平、生产水平与结构、居民收入、家庭人口数量和结构,物价水平等。其中主要的是: 居民的收入 ①在其他条件不变的情况下,人们的可支配收入越多,对各种商品和服务的消费量就越大。 收入是消费的前提与基础收入增长较快的时期,消费增长也较快;反之,当收入增长速度下降时,消费增幅也下将。所以,要提高居民的生活水平,必须保持经济的稳定增长,增加居民收入。 ②居民消费不仅受当前收入水平的影响,而且受过去和未来收入水平的影响。特别是未来收入,即预期收入,如果预期收入高,消费水平可能就高,相反,预期收入低,人们就会节制当前的消费。 ③社会总体消费水平的高低与人们的收入差距的大小有密切的关系。人们的收入差距过大,总体消费水平会降低;反之,缩小过大的收入差距,会使总体消费水平提高。 消费品价格
首先,消费品价格的变化会影响人们的购买能力。人们在一定时期的总收入是有限的,如果消费品价格上涨,会引起购买力下降,因而消费需求就降低。反之,则购买力提高,消费需求就增加。因此,物价的稳定对保持人们的消费水平,安定生活和稳定社会具有重要意义。也因为此,使得稳定物价成为国家宏观调控的重要目标。 其次,不同消费品的价格变化,对人们消费的影响不同。一般说来,基本生活消费品受价格水平变动的影响要远远低于奢侈品。人们不会因为价格变化而导致对基本生活消费品消费的减少,那么,会使消费支出增加,对人们的生活产生重大影响,严重的会影响社会稳定。这也就是国家特别关注农产品,尤其是粮食、蔬菜等价格变化的原因。 商品的性能、外观、质量、包装等也能成为影响消费的原因。甚至购买方式、商店位置、服务态度、售后服务都能影响人们的消费。 消费的类型 按产品类型不同,可分为有形商品消费和劳务消费。 按交易方式不同,可分为钱货两清的消费、贷款消费和租赁消费。 a.钱货两清的消费,是人们最常用的交易方式。交易一旦完成,商品的所有权和使用权都发生了转移,商品如何使用一般由买主自己支配,不再受卖者的限制。但有些比较复
一年级上册语文知识点归纳总结
一年级上册语文知识点归纳总结 一,汉语拼音 声母表23个 b p m f d t n l g k h j q x zh ch sh r z c s y w 韵母表24个 a o e i u ü ai ei ui ao ou iu ie üe er an en in un ün ang eng ing ong 整体认读音节16个 zhi chi shi ri zi ci si yi wu yu ye yue yuan yin yun ying 前鼻韵母an en in un ün 后鼻韵母ang eng ing ong 平舌音z c s 翘舌音zh ch sh r 二,偏旁部首及代表字 氵三点水(江河沙)日日字旁(明晚)讠言字旁(语认识)忄竖心旁(快慢) 雨雨字头(雪霜)冫两点水(次冷) 犭反犬旁(猪狗猫)扌提手旁(打把拉)鸟鸟字旁(鸭鸡鹅) 竹字头(笑笔笛) 彳双人旁( 往)目目字旁(眼睛)
足足字旁(跳跑)亻单人旁(休体住)口口字旁(唱听叶)月月字旁(肚朋腿)人人字头(会合全)门门字框(闪问闻)宀宝盖头(字家宁)土提土旁(地场城)王王字旁(球玩)石石字旁(砍码)火火字旁(炒烧)口方框(国园圆)辶走之底(过远近)禾禾字旁(秋秒)八八字头(谷分公)饣食字旁(饱饭馒)女女字旁(好妈奶)心心字底(想思念)三、量词的使用 一条鱼一条路一条毛巾一条小河 一条尾巴一条(架)彩虹一座桥一座山一座房一座城市一座天安门一只猫 一只猴子一只鹅一只耳朵一只鸡 一个家一个果子一个人一个故事 一个影子一个西瓜一个肚子一个朋友 一颗星星一颗宝石一颗心一群人 一群鹅一群猴子一块田一块面包一块草地一块西瓜一本书一本作业本一朵白云一朵花一片叶子一片风光一双手一双耳朵一双鞋一把尺子 一把扇子一头牛一匹马一阵风
高中物理必修一第二章知识点整理
第二章知识点整理 2.1实验:探究小车速度随时间变化的规律 1.实验步骤: (1)把一端附有滑轮的长木板平放在实验桌上,并使滑轮伸出桌面,把打点计时器固定在长木板上没有滑轮的一端,连接好电路。 (2)把一条细绳栓在小车上,细绳跨过滑轮,并在细绳的另一端挂上合适的钩码,试放手后,小车能在长木板上平稳的加速滑行一段距离。把纸带穿过限位孔,复写纸在压在纸带上,并把它的一端固定在小车后面。 (3)把小车停在靠近打点计时器处,先接通电源,后释放小车,让小车运动,打点计时器就在纸带上打出一系列的点。关闭电源,取下纸带,换上新纸带,重复实验两次。 2.数据处理 (1)纸带的选取:选择两条比较理想的纸带,舍掉开头的比较密集的点;确定零点,选取5-6个计数点,标上0、1、2、3、4、5; 应区别打点计时器打出的点和人为选取的计数点(一般相隔0.1s取一个计数点),选取的计数点最好5-6个。 (2)采集数据的方法:先量出各个计数点到计时零点的距离,然后再计算出相邻的两个计数点的距离。 不要分段测量各段位移,应尽可能一次测量完毕(可先统一量出到计数点0之间的距离),读数时应估读到最小刻度(毫米)的下一位。 (3)数据处理 ①表格法 ②图像法:做v-t图象,注意坐标轴单位长度的选取,应使图像尽量分布在坐标平面中央。应让尽可能多的点处在直线上,不在直线上的点应对称地分布在直线两侧,偏差比较大的点忽略不计。 ?运用图像法求加速度(求图像的斜率)。 ★常考知识点: 1、求瞬时速度(注意单位的换算,时间间隔的读取,是否要求保留几位有效数字)说明:“每两个计数点间还有四个点没有标出”和“每隔五个点取一个计数点”都表明每两个计数点间的时间间隔为0.1s。“有效数字”指从左边第一个不为零的数字数起。 2、求加速度:逐差法(具体公式运用见下文) 3、要求用公式表示时,注意使用题意中提供的字母,而不能自己编撰。 2.2匀变速直线运动的速度与时间的关系 1.匀变速直线运动 (1)定义:沿着一条直线,且加速度不变的运动,叫做匀变速直线运动。 (2)特点:任意相等时间内的△v相等,速度均匀变化。 (3)分类: ①匀加速直线运动:物体的速度随时间均匀增加的匀变速直线运动。 ②匀减速直线运动:物体的速度随时间均匀减小的匀变速直线运动。 2.速度与时间的关系式:v=v0+at 公式的适用条件:匀变速直线运动 解题步骤: (1)认真审题,弄清题意,确定正方向(一般以初速度的方向为正方向); (2)画草图,根据正方向确定各已知矢量的大小和方向; (3)运用速度公式建立方程,代入数据(注意单位换算),根据计算结果说明所求量的大小和方向。 (4)如果要求t或v0,应该先由v= v0 + at变形得到t或v0的表达式,再将已知物理量代入进行计算。 ★典型例题:如果汽车以108km/h在高速公路上行驶,紧急刹车时加速度的大小仍是6m/s2,则(1)3s后速度为多大?(2)6s后速度为多大? 解:取汽车初速度方向为正方向, 由题意知a= -6m/s2,v0=108km/h=30m/s, (1)3s后速度v= v0 + at =30m/s+(-6m/s2)×3s=12m/s (2)设汽车刹车至停止时用时为t, 由v= v0 + at 得s s s m s m a v v t6 5 / 6 / 30 2 0< = - - = - = 所以汽车刹车6s秒后速度为零。 ?对于刹车问题,一要注意方向,二要注意刹车时间。 2.3匀变速直线运动的位移与时间的关系
铁和铜及化合物知识点
专题复习八 ----铁及其化合物 一.物理性质:银白色,具有金属光泽;质地较软,有良好的导电性、延展性。密度7.86 g/cm3,熔沸点较高。位置:第四周期,第Ⅷ族 二.化学性质:1.与非金属反应 1)Fe+S(I2) FeS(FeI2) 2)4Fe+3O2 2Fe3O4 3)2Fe+3Cl2(Br2) 2FeCl3 弱氧化剂Fe3+、H+、I2、S、铁后的金属阳离子(置换)… Fe2+ Fe3+ 2.与水反应 3Fe + 4H2O(g) Fe3O4 + 4 H2↑(置换) 注意:铁在常温下不会和水发生反应,但在水和空气中O2和CO2的共同作用下,铁却很容易被腐蚀(生锈/电化学腐蚀) 3 与酸反应1)与非氧化性酸反应 Fe +2H+== Fe2+ + H2 2)与氧化性酸反应 a)常温下,铁在冷浓硫酸,浓硝酸中发生钝化 b)与浓硫酸反应:2Fe +6 H2SO4(浓)Fe2(SO4)3 +3SO2 +6 H2O c)与稀硝酸反应: 4.与盐溶液反应2Fe 3++ Cu = 2Fe 2++ Cu 2+ Fe + 2Fe3+ = 3 Fe2+ Fe + Cu2+ = Fe2+ + Cu 三、铁的化合物 Fe+CO+3CO+8Al
2、铁的氢氧化物 (1)Fe(OH)2的制备 Fe(OH)2易被氧化,在制备时应注意:⑴ FeS O 4晶体中不能有 Fe 3+ ;⑵配制后的FeSO 4溶液中要加入少量铁粉;⑶配制溶液的蒸馏水以及所用NaOH 溶液均须煮沸以除去其中溶解的氧气; 实验:FeSO 4溶液中加NaOH. ①现象: 生成白色沉淀,后又迅速转变为灰绿色,最后生成红褐色 ②Fe 2+ 容易被氧化,所以FeSO 4溶液要新配制. ③为了防止滴加NaOH 时带入空气,可将吸收NaOH 的长滴管伸入FeSO 4溶液液面下,再挤出NaOH 溶液. ④为了防止Fe 2+ 被氧化,还可以向盛有FeSO 4溶液的试管中加入少量煤油或其它密度比水小但不溶于水的有机物以隔绝空气. 化学方程式: FeSO 4 + 2NaOH = Fe(OH)2↓+Na 2SO 4 Fe 2++ 2OH -= Fe(OH)2↓(白色) 4Fe(OH)2 + O 2 + 2H 2O = 4Fe(OH)3(红褐色) (白色→灰绿色→红褐色) (2)Fe(OH)3的制备 实验:FeCl 3溶液中加NaOH 溶液. ①现象:生成红褐色沉淀 ②化学方程式:FeCl 3+3NaOH= Fe(OH) 3↓+3NaCl Fe 3++ 3OH -= Fe(OH)3↓(红褐色) ③热稳性:Fe(OH)3对热不稳定,受热能失去水生成红棕色的Fe 2O 3粉末. 化学方程式: 2Fe(OH)3 Fe 2O 3 +3H 2O [小结]难溶性或微溶性的碱受热不稳定,容易分解。生成相应的氧化物和水 (3)Fe (OH )3胶体的制备 向加热沸腾的蒸馏水中加入FeCI 3溶液,待出现红褐色时,停止加热,便可得到 Fe(OH)3胶体。制备时要注意:⑴不可长时间加热,因为加热会使胶体凝聚;⑵不能用自来水,因为自来水中的电解质也可使胶体凝聚。 四.铁的两种氢氧化物的比较 化学式 Fe(OH)2 Fe(OH)3 色、态 白色固体 红褐色固体 溶解性 难溶于水 难溶于水 物质类别 二元弱碱 三元弱碱 与非氧化性酸的 反应 Fe(OH)2+H 2SO 4=FeSO 4+2H 2O Fe(OH)2+2H + =Fe 2+ +2H 2O 2Fe(OH)3+3H 2SO 4=Fe 2(SO 4)3+6H 2O Fe(OH)3+3H + =Fe 3+ +3H 2O 与氧化性酸的反 应 3Fe(OH)2+10HNO 3(稀)=3Fe(NO 3)3+NO ↑+8H 2O 3Fe(OH)2+10H + +NO 3 -=3Fe 3+ +NO ↑+8H 2O Fe(OH)3+3HNO 3(稀)=Fe(NO 3)3+3H 2O Fe(OH)3+3H +=Fe 3+ +3H 2O 与还原性酸的反 应 Fe(OH)2+2HI=FeI 2+2H 2O Fe(OH)2+2H + =Fe 2+ +2H 2O 2Fe(OH)3+6HI=2FeI 2+6H 2O+I 2 2Fe(OH)3+6H + +2I -=2Fe 2++6H 2O+I 2 热稳定性 分解产物复杂 2Fe(OH)3 Fe 2O 3 +3H 2O
