第八章 配位平衡和配位滴定课后答案
--------第八章---配位平衡和配位滴定法答案
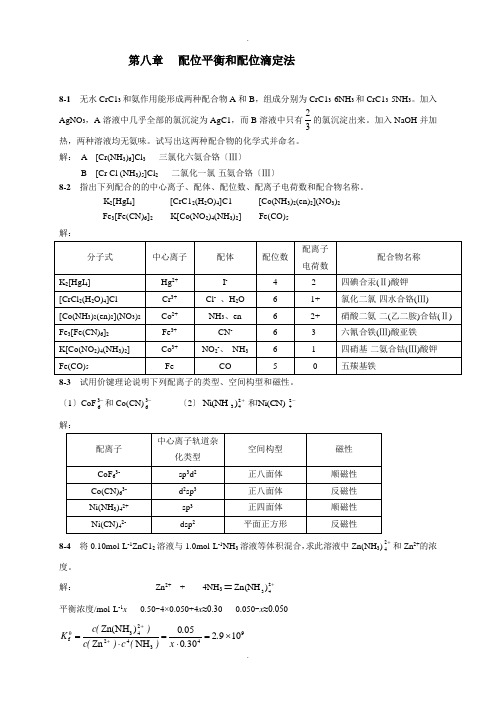
第八章 配位平衡和配位滴定法8-1 无水CrC13和氨作用能形成两种配合物A 和B ,组成分别为CrC13·6NH 3和CrC13·5NH 3。
加入AgNO 3,A 溶液中几乎全部的氯沉淀为AgC1,而B 溶液中只有32的氯沉淀出来。
加入NaOH 并加热,两种溶液均无氨味。
试写出这两种配合物的化学式并命名。
解: A [Cr(NH 3)6]Cl 3 三氯化六氨合铬〔Ⅲ〕 B [Cr Cl (NH 3)5]Cl 2 二氯化一氯·五氨合铬〔Ⅲ〕8-2 指出下列配合的的中心离子、配体、配位数、配离子电荷数和配合物名称。
K 2[HgI 4] [CrC12(H 2O)4]C1 [Co(NH 3)2(en)2](NO 3)2 Fe 3[Fe(CN)6]2 K[Co(NO 2)4(NH 3)2] Fe(CO)5解:8-3 试用价键理论说明下列配离子的类型、空间构型和磁性。
〔1〕CoF -36和Co(CN)-36〔2〕+243)Ni(NH -24Ni(CN)和解:8-4 将0.10mol·L -1ZnC12溶液与1.0mol·L -1NH 3溶液等体积混合,求此溶液中Zn(NH 3)+24和Zn 2+的浓度。
解: Zn 2+ + 4NH 3ᆖ+243)Zn(NH平衡浓度/mol·L -1x 0.50-4×0.050+4x ≈0.30 0.050-x ≈0.05094342243θf1092300050NH Zn )Zn(NH ⨯=⋅=⋅=++..x .)(c )(c )(c Kx = c (Zn 2+) = 2.1×10-9 mol·L -18-5在100.0 mL0.050 mol·L -1+23)Ag(NH 溶液中加入1.0 mL 1.0 mol·L -1NaC1溶液,溶液中NH 3的浓度至少需多大才能阻止AgC1沉淀生成?解: +23)Ag(NH +Cl -ᆖ AgCl + 2NH 3平衡浓度/mol·L -1 0.050 0.010c (NH 3)107θspθf 2332θJ1077.1101.111))Ag(NH ()Cl ()NH (-+-⨯⨯⨯=⋅=⋅=K K c c c K 11073L mol 51010771101101000500)NH --⋅=⨯⨯⨯⨯=.....(c8-6 计算AgC1在0.10 mol·L -1氨水中的溶解度。
配位滴定法课后练习题及参考答案

配位滴定法课后练习题及参考答案配位滴定法课后练习题及参考答案一、选择题1. 直接与金属离子配位的EDTA 型体为()(A) H 6Y 2+ ( B ) HY ( C HY 2 - (D )才2. 一般情况下,EDTA 与金属离子形成的络合物的络合比是()(A) 1: 1 (B ) 2: 1 (C ) 1: 3 (D ) 1: 23. 铝盐药物的测定常用配位滴定法。
加入过量EDTA 加热煮沸片刻后,再用标准锌溶液滴定。
该滴定方式是()。
(A )直接滴定法 (B )置换滴定法(A ) M 与L 没有副反应 (B ) M 与L 的副反应相当严重(C ) M 的副反应较小 (D ) [M]=[L]5. 以下表达式中正确的是()6. 用EDTA ft 接滴定有色金属离子 M 终点所呈现的颜色是() (A )游离指示剂的颜色 (B ) EDTA-昭合物的颜色(C )指示剂-M 络合物的颜色 (D )上述A+B 的混合色7. 配位滴定中,指示剂的封闭现象是由()引起的(A) 指示剂与金属离子生成的络合物不稳定(B) 被测溶液的酸度过高(C)指示剂与金属离子生成的络合物翁定性小于MY 的稳定性 (D)指示剂与金属离子生成的络合物稳定性大于MY 的稳定性8. 下列叙述中错误的是()(A) 酸效应使络合物的稳定性降低(B) 共存离子使络合物的稳定性降低(C) 配位效应使络合物的稳定性降低(D) 各种副反应均使络合物的稳定性降低9. 用Zn 2+标准溶液标定EDTA 寸,体系中加入六次甲基四胺的目的是()(A )中和过多的酸 (B )调节pH 值(C )返滴定法 (D )间接滴定法 4 .a M (L )=1 表示(A ) >(B )(C ) (D )配位滴定法课后练习题及参考答案(C)控制溶液的酸度(D)起掩蔽作用10. 在配位滴定中,直接滴定法的条件包括()(A)>< 8 (B)溶液中无干扰离子(C)有变色敏锐无封闭作用的指示剂(D)反应在酸性溶液中进行11. 测定水中钙硬时,Mg+的干扰用的是()消除的。
配位滴定答案

配位滴定(答案)一、单项选择1. 采用铬黑T 作指示剂终点颜色变化为(A ) A. 紫红→蓝色 B. 蓝色→紫红C. 无色→蓝色D. 无色→紫红2. K CaY =1010.69,当pH=9.0时,lgαr(H)=1.29,则K 'C aY 等于( D )A. 101.29B. 1011.98C. 1010.69D. 109.403. 滴定分析中为了掩蔽Fe 3+的干扰,可选用以下的哪种物质( A ) A. H 3PO 4 B. NH 3 C. HCl D. NaAc4. 在 EDTA 络合滴定中,( B )A. 酸效应系数愈大,络合物的稳定性愈大B. 酸效应系数愈小,络合物的稳定性愈大C. pH 值愈大,酸效应系数愈大D. 酸效应系数愈大,络合滴定曲线的 pM 突跃范围愈大 5 . 一般情况下,EDTA 与金属离子形成的配合物的配位比是( A ) A. 1:1 B. 2:1 C. 1:3 D. 1:2 6. 可用于测定水硬度的方法有( A )A.EDTA 法B.K 2Cr 2O 7C.碘量法D. 酸碱滴定法7. 在Ca 2+、Mg 2+的混合液中,用EDTA 法滴定Ca 2+,要消除Mg 2+ 的干扰。
宜用( D ) A. 控制酸度 B. 配位掩蔽法 C. 氧化还原掩蔽法 D. 沉淀掩蔽法8. 当溶液中有两种(M 、N )金属离子共存时,欲以EDTA 溶液滴定M 而N 不干扰,则要求( A ) A.M M Y N N YC K C K θθ≥105B.M M Y N N YC K C K θθ≥10-5C.M M Y N N YC K C K θθ≥108D.M M Y N N YC K C K θθ≥10-89. 以 EDTA 滴定 Zn 2+ ,选用( B )作指示剂A. 酚酞B. 二甲酚橙C. 二苯胺磺酸钠D. 淀粉10. 用EDTA 测定水中的Ca 2+的含量时,Mg 2+有干扰,实验中采用何种方法消除其干扰( B ) A. 加三乙醇胺 B. 调节pH 值≈12 C. 加KCN D. 分离 11. 络合滴定中,金属指示剂应具备的条件是( A )A. 金属指示剂络合物易溶于水B. 本身是氧化剂C. 必须加入络合掩蔽剂D. 必须加热 12. 在pH 值为13的水溶液中,EDTA 存在的主要形式是( D ) A . H 3Y - B. H 2Y 2- C. HY 3- D. Y 4-13. 某溶液主要含有Ca 2+、Mg 2+及少量Fe 3+,Al 3+。
配位平衡习题及答案

配合平衡习题及答案一、判断题:1. Cu (Ⅱ) 、Zn (Ⅱ) 、Cd (Ⅱ) 的易溶盐较多。
()2. 金属锌可以与过量的氨水反应生成氢气。
()3. Zn 、Cd 、Hg 的金属活泼性分别比Cu 、Ag 、Au 强。
.................... ()4. [ Cu (NH3 )4 ]2+ 的空间构型为正四面体,Cu2+ 以sp3 杂化轨道与NH3 形成配位键。
.........................................................................................................................()5. Zn2+ 、Cd2+ 、Hg2+ 与EDTA 形成配位数为4 的螯合物。
()二、选择题:1.下列物质在酸性溶液中可以将Mn2+氧化为MnO4-的是.................()。
(A) PbO;(B) Bi3+;(C) NaClO;(D) (NH4 )2 S2O8。
2. 下列金属中,延展性最好的是 ............................................................... ()。
(A) 银;(B) 金;(C) 铜;(D) 锌。
3. 下列反应中,配离子作氧化剂的是 .................................................. ()。
(A) [Cu (OH)4]2- 与甲醛反应;(B)[ Fe (CN)6]4- 与FeCl3 反应;(C) [Co (NH3 )6]2+ 与O2 反应;(D)[ Ag (NH3 )2]+ 与KI 反应。
4. 下列化合物中易溶于水的是.................................................................. ()。
《分析化学》习题参考答案-滴定部分

(2)0.1248 > 0.1238,结果偏高
(3)HCl浓度比真实浓度低,需要消耗更多的HCl,结果偏低
(4)相同质量的碳酸氢钠比碳酸钠消耗的盐酸少,导致消耗盐酸体积减小,盐酸浓度测定值偏高
4、写出下列各体系的质子条件式。
解:(1)NH4H2PO4:
[H+]+[H3PO4]=[OH-]+[HPO42-]+2[PO43-]+[NH3]
终点误差计算略,计算结果相等均为0.03%。
7、解:酚酞做指示剂,消耗盐酸12.00mL,说明试样中有Na3PO4。
Na3PO4+HCl = Na2HPO4+NaCl
8、解:
9、解:只简单提示思路,尿素分子式为CO(NH2)2;每分子尿素能产生2分子能被吸收滴定的NH3。因此滴定剂HCl物质的量为尿素物质的量2倍。
解:①
②
③
④
8、在用氯丁二烯氯化生产二氯丁二烯时,产品中总有少量的三氯丁二烯杂质存在。分析表明,杂质的平均含量为1.60%。改变反应条件进行试生产,取样测定,共取6次,测定杂质含量分别为:1.46%、1.62%、1.37%、1.71%、1.52%及1.40%。问改变反应条件后,产品中杂质百分含量与改变前相比,有明显差别吗?(α=0.05时)
解:HCl+NaOH==NaCl+H2O 2HCl+CaO==CaCl2+H2O
9、解:CaCO3~ 2HCl
10、二元弱酸H2A,已知pH=1.92时,δH2A=δHA-;pH=6.22时,δHA-=δA2-。计算:①H2A的pKa1和pKa2②HA-溶液的pH。
解:①pKa1=1.92,pKa2=6.22
分析化学:第8章课后习题答案

第八章思考题与习题1.什么叫沉淀滴定法?沉淀滴定法所用的沉淀反应必须具备哪些条件?答:沉淀滴定法是以沉淀反应为基础的一种滴定分析方法。
沉淀滴定法所应的沉淀反应,必须具备下列条件:(1)反应的完全程度高,达到平衡的速率快,不易形成过饱和溶液。
,即反应能定量进行。
(2)沉淀的组成恒定,沉淀的溶解度必须很小,在沉淀的过程中不易发生共沉淀现象。
(3)有确定终点的简便方法。
2.写出莫尔法、佛尔哈德法和法扬斯法测定Cl-的主要反应,并指出各种方法选用的指示剂和酸度条件。
答:(1)莫尔法主要反应:Cl-+Ag+=AgCl↓指示剂:铬酸钾酸度条件:pH=6.0∽10.5(2)佛尔哈德法主要反应:Cl-+Ag+(过量)=AgCl↓Ag+(剩余)+SCN-=AgSCN↓指示剂:铁铵矾。
酸度条件:0.1∽1 mol/L(3)法扬斯法主要反应:Cl-+Ag+=AgCl↓指示剂:荧光黄酸度条件:pH=7∽10.53.用银量法测定下列试样:(1)BaCl2,(2)KCl,(3)NH4Cl,(4)KSCN,(5)NaCO3+NaCl,(6)NaBr,各应选用何种方法确定终点?为什么?答:(1)BaCl2用佛尔哈德法或法扬斯法。
因为莫尔法能生成BaCrO4沉淀。
(2)Cl-用莫尔法。
此法最简便。
(3)NH4Cl用佛尔哈德法或法扬斯法。
因为当、[NH4+]大了不能用莫尔法测定,即使[NH4+]不大酸度也难以控制。
(4)SCN-用佛尔哈德法最简便。
(5)NaCO3+NaCl用佛尔哈德法。
如用莫尔法、法扬斯法时生成Ag2CO3沉淀造成误差。
(6)NaBr 用佛尔哈德法最好。
用莫尔法在终点时必须剧烈摇动,以减少AgBr吸附Br-而使终点过早出现。
用法扬斯法必须采用曙红作指示剂。
4.在下列情况下,测定结果是偏高、偏低,还是无影响?并说明其原因。
(1)在pH=4的条件下,用莫尔法测定Cl-;(2)用佛尔哈德法测定Cl-既没有将AgCl沉淀滤去或加热促其凝聚,有没有加有机溶剂;(3)同(2)的条件下测定Br-;(4)用法扬斯法测定Cl-,曙红作指示剂;(5)用法扬斯法测定I-,曙红作指示剂。
分析化学课后答案第8章
分析化学课后答案第8章第八章电位分析法思考题1. 参比电极和指示电极有哪些类型?它们的主要作用是什么?答:参比电极包括标准氢电极(SHE),标准氢电极是最精确的参比电极,是参比电极的一级标准。
实际工作中常用的参比电极是甘汞电极和银-氯化银电极。
参比电极电位恒定,其主要作用是测量电池电动势,计算电极电位的基准。
指示电极包括金属-金属离子电极,金属-金属难溶盐电极,汞电极,惰性金属电极,离子选择性电极。
指示电极能快速而灵敏的对溶液中参与半反应的离子活度或不同氧化态的离子的活度比,产生能斯特响应,主要作用是测定溶液中参与半反应的离子活度。
2. 直接电位法的依据是什么?为什么用此法测定溶液pH时,必须使用标准pH缓冲溶液?答:直接电位法是通过测量电池电动势来确定待测离子活度的方法,其主要依据是E=Φ参比—ΦMn+/M= Φ参比—ΦθMn+/M —lnαMn+式中Φ参比和ΦθMn+/M在温度一定时,都是常数。
由此式可知,待测离子的活度的对数与电池电动势成直线关系,只要测出电池电动势E,就可求得αMn+。
测定溶液的pH时是依据:E = ΦHg2Cl2/Hg —ΦAgCl/Ag— K + 0.059 pH试+ ΦL , 式中ΦHg2Cl2/Hg ,ΦAgCl/Ag ,K ,ΦL在一定的条件下都是常数,将其合并为Kˊ,而Kˊ中包括难以测量和计算的不对称电位和液接电位。
所以在实际测量中使用标准缓冲溶液作为基准,并比较包含待测溶液和包含标准缓冲溶液的两个工作电池的电动势来确定待测溶液的pH值,即:25℃时Es = Ksˊ+ 0.059pHs, Ex = Kxˊ+ 0.059pHx,若测量Es和Ex时的条件保持不变,则Ksˊ= Kxˊ,pHx =pHs+ (Ex -Es)/0.059 ,由此可知,其中标准缓冲溶液的作用是确定Kˊ。
3. 简述pH玻璃电极的作用原理。
答:玻璃电极的主要部分是一个玻璃泡,泡的下半部是对H+ 有选择性响应的玻璃薄膜,泡内装有pH一定的0.1mol·L-1的HCl内参比溶液,其中插入一支Ag-AgCl电极作为内参比电极,这样就构成了玻璃电极。
配位滴定答案
配位滴定(答案)一、单项选择1. 采用铬黑T 作指示剂终点颜色变化为(A ) A. 紫红→蓝色 B. 蓝色→紫红C. 无色→蓝色D. 无色→紫红2. K CaY =1010.69,当pH=9.0时,lgαr(H)=1.29,则K 'C aY 等于( D )A. 101.29B. 1011.98C. 1010.69D. 109.403. 滴定分析中为了掩蔽Fe 3+的干扰,可选用以下的哪种物质( A ) A. H 3PO 4 B. NH 3 C. HCl D. NaAc4. 在 EDTA 络合滴定中,( B )A. 酸效应系数愈大,络合物的稳定性愈大B. 酸效应系数愈小,络合物的稳定性愈大C. pH 值愈大,酸效应系数愈大D. 酸效应系数愈大,络合滴定曲线的 pM 突跃范围愈大 5 . 一般情况下,EDTA 与金属离子形成的配合物的配位比是( A ) A. 1:1 B. 2:1 C. 1:3 D. 1:2 6. 可用于测定水硬度的方法有( A )A.EDTA 法B.K 2Cr 2O 7C.碘量法D. 酸碱滴定法7. 在Ca 2+、Mg 2+的混合液中,用EDTA 法滴定Ca 2+,要消除Mg 2+ 的干扰。
宜用( D ) A. 控制酸度 B. 配位掩蔽法 C. 氧化还原掩蔽法 D. 沉淀掩蔽法8. 当溶液中有两种(M 、N )金属离子共存时,欲以EDTA 溶液滴定M 而N 不干扰,则要求( A ) A.M M Y N N YC K C K θθ≥105B.M M Y N N YC K C K θθ≥10-5C.M M Y N N YC K C K θθ≥108D.M M Y N N YC K C K θθ≥10-89. 以 EDTA 滴定 Zn 2+ ,选用( B )作指示剂A. 酚酞B. 二甲酚橙C. 二苯胺磺酸钠D. 淀粉10. 用EDTA 测定水中的Ca 2+的含量时,Mg 2+有干扰,实验中采用何种方法消除其干扰( B ) A. 加三乙醇胺 B. 调节pH 值≈12 C. 加KCN D. 分离 11. 络合滴定中,金属指示剂应具备的条件是( A )A. 金属指示剂络合物易溶于水B. 本身是氧化剂C. 必须加入络合掩蔽剂D. 必须加热 12. 在pH 值为13的水溶液中,EDTA 存在的主要形式是( D ) A . H 3Y - B. H 2Y 2- C. HY 3- D. Y 4-13. 某溶液主要含有Ca 2+、Mg 2+及少量Fe 3+,Al 3+。
高等教育出版社 无机化学 第八章 课后习题答案
6.在699K时,反应H2(g) + I2(g) 2HI(g)的平衡常数Kp=55.3,如果将2.00molH2和2.00molI2作用于4.00dm3的容器内,问在该温度下达到平衡时有多少HI生成?
解
7.反应H2+ CO2 H2O + CO在1259K达平衡,平衡时[H2]=[CO2]=0.44mol·dm ,[H2O]=[CO]=0.56mol·dm 。
Ⅰ
Ⅱ
Ⅲ
Ⅳ
Ⅴ
Ⅵ
Ⅶ
p = p
p = p
0.253
1.773
0.507
1.520
0.760
1.266
1.013
1.013
1.266
0.760
1.520
0.507
1.773
0.253
表中单位为105Pa。
将△G对反应混合物的组成作图,标出图中哪个区域里正向反应可能发生,哪个区域里逆向反应可能发生。
解ⅠK = =0.194
(2)[HI]=0.01+2×1.35×10 =0.0127mol·dm
(3) = ×100%=21.3%
14.反应SO2Cl2(g) SO2(g)+ Cl2(g)在375K时,平衡常数K =2.4,以7.6克SO2Cl2和1.013×105Pa的Cl2作用于1.0 dm—3的烧瓶中,试计算平衡时SO2Cl2、SO2和Cl2的分压。
当Q〉K 时△rG 〉0逆反应自发进行
22.反应H2O(g) + CO(g) H2(g) + CO2(g)在某温度下平衡常数Kp=1,在此温度下,于6dm3的容器中加入2 dm33.04×104Pa的CO,3dm32.02×105Pa的CO2,6dm32.02×105Pa的H2O(g)和1dm32.02×105Pa的H2。问净反应向哪个方向进行?
(完整版)配位滴定
配位滴定一、选择题1、用EDTA 标准溶液连续滴定Fe 3+,Al 3+,需要的条件是: A.pH=2时滴定Al 3+,pH=4时滴定Fe 3+; B.pH=2时滴定Fe 3+,pH=4时返滴定Al 3+; C.pH=1时滴定Fe 3+,pH=4时滴定Al 3+;D.pH=2时滴定Fe 3+,pH=4时间接滴定Al 3+2、在EDTA 配位滴定中,下列有关PAN 指示剂的叙述错误的是: A.用于配制PAN 的溶剂是乙醇; B.PAN 适用的pH 范围很宽,为2~12;C.PAN 指示剂最适用于EDTA 滴定钙镁总量;D.PAN 与大多数金属离子(Cu 2+,Zn 3+除外)形成难溶配合物3、已知K ZnY =1016.50,K MgY =108.69,pH=5时,lg αY(H)=6.6。
今用含有Mg 2+的溶液中,在pH=5下用EDTA 滴定Zn 2+二甲酚橙作指示剂,测得结果是: A.准确,Mg 2+不干扰;B.偏高,Mg 2+亦被滴定;C.偏高,因Mg 2+封闭指示剂;D.K'ZnY 太大,不能准确滴定4、在EDTA(Y)滴定金属离子M 时,下列有关金属指示剂的叙述中错误的是: A.指示剂的僵化是由于K K MIn MY ''≈; B.指示剂的封闭是由于K K MIn MY''<<; C.K MIn '太小时,使滴定终点的色变僵化,不敏锐;D.若K K MIn MY ''>,则引起指示剂的全封闭5、用EDTA 滴定Ca 2+,Mg 2+时,为消除Fe 3+的干扰,应选用的掩蔽剂是: A.KCN 或抗坏血酸; B.盐酸羟胺或三乙醇胺;C.三乙醇胺或KCN ;D.盐酸羟胺或抗坏血酸6、某试样中含0.5%左右的铁,要求测定的相对误差为2%,可选用的测定方法是:A.KMnO 4滴定法;B.K 2Cr 2O 7滴定法;C.EDTA 滴定法;D.邻菲罗啉比色法7、EDTA 滴定Ca 2+的pCa 突跃范围本应较大,但实际滴定中却表现为很小,这可能是由于滴定时:A.溶液的pH 值太低了;B.被滴定物浓度太大了;C.指示剂变色范围太宽了;D.反应产物的副反应严重了8、在配位滴定法中,要求所用的金属指示剂与被测离子形成配合物的条件稳定常数K MIn ':A.>K MY '; B.<K MY '; C.≈K MY ';D.≈1100K MY'9、在配位滴定中,必须在酸性溶液中使用的指示剂是: A.铬黑T ; B.钙指示剂; C.磺基水杨酸; D .二甲酚橙10、在EDTA 配位滴定过程中,下列有关物质的浓度变化关系的叙述错误的是:A.被滴定物M 的浓度随滴定反应的进行,其负对数值增大;B.A 项中的负对数值应当随之减小;C.A 项中的负对数值,在其化学计量点附近有突跃;D.滴定剂的浓度,随滴定的进行而增大11、某金属指示剂与金属离子M 形成的配合物的K'MIn =102,而K K MY MIn''>104,当用该指示剂,以EDTA 滴定M 时,终点将:A.合适,结果正确;B.提前,测得M 偏低;C.提前,测得M 偏高;D.拖后,测得M 偏高12、在EDTA 配位滴定中,下列有关指示剂的叙述中,错误的是:A.酸性铬蓝K 常与萘酚绿B 配成混合指示剂应用;B.PAN 指示剂常用于Cu 2+溶液滴定EDTA 溶液;C.在EDTA 滴定Fe 3+,Al 3+,Ca 2+,Mg 2+混合物中的Ca 2+时,常用铬黑T 为指示剂;D.用EDTA 滴定Fe 3+常用磺基水杨酸为指示剂13、用EDTA 测定Zn 2+,Al 3+混合溶液中的Zn 2+,为了消除Al 3+的干扰可采用的方法是:A.加入NH 4F ,配位掩蔽Al 3+;B.加入NaOH ,将Al 3+沉淀除去;C.加入三乙醇胺,配位掩蔽Al 3+;D.控制溶液的酸度14、AgCl在1mol⋅L-1氨水中比在纯水中的溶解度大。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第八章 配位平衡与配位滴定法
(1)CoCl 3·6NH 3 (2)CoCl 3·5NH 3 (3)CoCl 3·4NH 3 (4)CoCl 3·3NH 3
若用AgNO 3溶液沉淀上述配合物中的Cl -,所得沉淀的含氯量依次相当于总含氯量的
03
13233、、、,根据这一实验事实确定四种氨钴配合物的化学式? 答:[Co(NH 3)6]Cl 3 [Co(NH 3)5Cl]Cl 2 [Co(NH 3)4Cl 2]Cl [Co(NH 3)3 Cl 3] 4、在1.0L 氨水中溶解0.10molAgCl ,问氨水的最初浓度是多少?
=2.16×10–3
)mol.L (22.210
02.21.01.01002.2)(Cl )])[Ag(NH ()(NH 1-3
3-1233=⨯⨯=⨯⋅=--+c c c 在溶解的过程中要消耗氨水的浓度为2×0.1=0.2mol·L -1,所以氨水的最初浓度为
2.22+0.2=2.42mol·L -1
5①AgI 不能溶于NH 3而能溶于KCN,因为溶解反应K ⊙
=Ksp*K (稳),K(稳)Ag (CN )2>>K(稳)Ag (NH 3)2 ∴AgI 溶于KCN 的平衡常数很大而溶于NH 3的平衡常数很少
②AgBr 能溶于KCN 而Ag 2S 不能,,∵K ⊙
=Ksp*K (稳) Ag 2S 的Ksp<<AgBr 的Ksp ∴溶解反应的K 会很小 ③Fe 与SCN -会生成血红色的配合物
6、0. l0mol ∙L -1的AgNO 3溶液50mL ,加密度为0.932g ∙ mL -1含NH 3 18.24%的氨水30mL ,加水稀释到100mL ,求算这溶液中的Ag +浓度。
答: Ag + + 2NH 3 [Ag(NH 3)2]+ 初始 0.05
1
.0171824
.030932.0⨯⨯⨯=3
假设反应x x 2x x 平衡 0.05-x 3-2x x
)
(Ag )(NH )
])[Ag(NH (32
23+
+=c c c K θ
稳
=
1.12⨯107 ]/)Ag ([])/(NH []/)Ag ([]/)Cl ([])/])([Ag(NH [])/(NH []/)Cl ([]/])Ag(NH [[θ2θ3θθθ232θ3θθ23c c c c c c c c c c c c c c c c K ++-+-+⋅⋅⋅=⋅=
平衡时Ag +=5.04×10-10mol/L
7.在第6题的混合液中加0.10mol ∙L -1的KBr 溶液10mL ,有没有AgBr 沉淀析出?如果欲阻止AgBr 沉淀析出,氨的最低浓度是多少?
答:因为Ag +×Br ->Ksp 所以会生成沉淀若不能生成沉淀,则Ag+的浓度必须小于
12
100.5--
+⨯=<
Br
Ksp Ag 设氨的最低浓度为y Ag + + 2NH 3 [Ag(NH 3)2]+ 初始 0.05×100/110 =0.045 y 假设反应
平衡 5.0× 10-12 y-(0.045-5.0× 10-12) 0.045-5.0× 10-12
)
(Ag )(NH )])[Ag(NH (32
23+
+=c c c K θ
稳
=
1.12⨯107
代入得y=8.67mol/L 9、当溶液的pH=11.0时并含有0.001mol/L 游离的CN-时,计算'
HgY lgK θ的值
解:查表得5.21lgK HgY =θ
当pH=11.0时,lg αY(H) =0.07
当含有0.001mol/L 的CN-时:
当pH=11.0时,αHg(OH)=1015.9 所以αM =αM(L) + αM(OH)-1=1026.4+1015.9-1≈1026.4
说明此时HgY 已经被破坏
10解:该缓冲溶液的76.4lg
==-=θ
θ
b b pK ca
cb pK pOH 所以pH=14-4.76=9.24 当pH=9.24时,lg αY(H) ≈1.28 αNi (OH)=100.1
αM =αM(L) + αM(OH)-1=2.1×104+100.1-1≈2.1×104 11.解: lg αY(H) = lg K (ZnY) – 8 =16.36-8 =8.36
查表可知最高酸度为pH=4.0
13.解: 水的总硬=0.01050mol ⋅L -1⨯19.00⨯10-3L ⨯56.08⨯103mg·mol -1/100.0⨯10-3L
= 111.9mg ⋅L -1
15.解: w (Mg) = (0.05000⨯4.10⨯100⨯24.31)/(25⨯0.5000⨯1000) = 0.0399
w (Zn) = (0.05000⨯13.40⨯100⨯65.39)/(25⨯0.5000⨯1000) = 0.3504
w (Cu) = [0.05000⨯(37.30-13.40)⨯100⨯63.55]/(25⨯0.5000⨯1000) = 0.6075
16.Solution: Cu 2+ + 4NH 3 = [Cu(NH 3)4]2+
1
134
1133
34f 2432342243f L
mol 108.4)100.1(1009.2100.1 )
(NH ])[Cu(NH )(Cu )(NH )(Cu ])[Cu(NH ----+
+
++⋅⨯=⨯⨯⨯⨯=⋅=
⋅=c K c c c c c K
17. Solution: c (Cu 2+) = [0.05083⨯16.06 – (0.05083⨯25.00 –0.01883⨯19.77)/2] /25.00
= 0.01468 mol·L -1
97.407.04.265.21lg lg lg lg )(M(L)MY 'MY -=--=--=H Y K K ααθ
θ4.264.415221M(L)1010001.01)L ()L ()(L 1=⨯+=+⋅⋅⋅+++=n n
βc βc βc α9
.1228.13.45.18lg lg lg lg )(M(L)MY 'MY =--=--=H Y K K ααθ
θ4
74.7671.8596.7477.6304.5280.2221Ni(NH3)101.2101.0101.0101.0101.0101.0101.01)L ()L ()(L 1⨯=⨯+⨯+⨯+⨯+⨯+⨯+=+⋅⋅⋅+++=n
n βc βc βc α。
