关于混合物中阿伏伽德罗常数的计算方法
有关阿伏伽德罗常数的计算的探究

有关阿伏伽德罗常数的计算的探究作者:刘睿花来源:《新课程·中学》2014年第11期关于阿伏伽德罗常数的计算是历年高考的“热点”问题,多年全国高考化学试题重现率几乎为100%。
之所以能成为高考的热点,是因为该类试题以中学所学过的一些重点物质为平台,能考查学生对阿伏伽德罗常数及与其有联系的物质的量、摩尔质量、气体摩尔体积、物质的量浓度、阿伏伽德罗定律等概念与原理的理解是否准确深刻,各类守恒关系、平衡的有关原理掌握的是否牢固。
题目涉及的知识面广,灵活性强,思维跨度大,高考中对这些知识反复进行考查,对考生思维能力的品质——严密性、深刻性是一个很好的检验。
命题者往往有意设置一些陷阱,增大试题的区分度,导致学生实际的得分率并不高。
所以我们应该掌握高考的考试要求,明确高考的命题趋势,完善知识要点梳理,认清题目陷阱设置,培养学生良好的思维品质。
经过十年的高中化学教学,我就阿伏伽德罗常数计算的常见题型及解题方法进行分析并小结如下,供高考学子们参考。
一、计算物质中所含微粒的数目这类题目往往是给出一定质量、一定物质的量或一定体积的物质(或微粒)来计算该物质(或微粒)中所含的微粒(分子、原子、质子、中子、电子、共价键、离子)数。
(1)计算物质中的分子数只要计算出其物质的量即可。
(2)计算溶液中的离子数。
做这类题要遵循“先看是否完全电离,再看是否水解”的思路。
对于完全电离且不水解的物质,根据电离方程式列比例式即可求出离子的物质的量,对于不完全电离或要水解的离子则无法算出具体的数值。
(这类题目中还常常出现“只已知溶质的物质的量浓度求算某离子数目”的陷阱。
遇此陷阱只需直接判断其错误无需计算。
)(3)计算较大微粒中的较小粒子。
即计算分子或离子中的原子、质子、中子、电子、共价键、离子数等。
做这类题的思路是:先计算出一个较大微粒中的较小粒子,在根据粒子数之比等于其物质的量之比列比例式求出较小粒子的物质的量即可。
(4)计算混合物中的粒子数。
阿伏加德罗常数的测定

阿伏加德罗常数的测定
阿伏加德罗常数是化学中一项非常重要的常数,通常表示为Avogadro constant,记
作N_A,它表示1摩尔物质中所含有的基本粒子(如原子、分子等)的个数。
阿伏加德罗
常数的值为6.022×10^23/mol。
阿伏加德罗常数的测定是实验室中极其重要的课题,也是困扰化学家很长时间的问题。
它的测定方法有许多种,以下是其中几种典型的方法:
1.油滴实验
这种方法是利用油滴在电场中运动的受力情况,根据对油滴的运动所受到的电场力和
重力的平衡关系,可以求出电荷的大小,进而求出元电荷的大小,从而计算出阿伏加德罗
常数。
2. 气体扩散法
利用气体分子自身的运动特性,通过测定气体分子的平均自由程、膨胀系数等参数,
可以得到阿伏加德罗常数的值。
3. X射线测定法
通过对晶体材料中的晶胞参数等参数的测定,可以得到阿伏加德罗常数的值。
这三种方法各有优缺点,但它们都经过了科学家们的认真研究和大量实验验证,可以
得到比较准确的结果。
目前,国际标准化组织根据多个不同的实验结果,确定了阿伏加德罗常数的值为
6.02214076×10^23/mol。
这一值在国际上得到了广泛的认可和应用,在化学和物理等领
域都有重要的应用。
总之,阿伏加德罗常数的测定是化学中的一项重要课题,各种实验方法都经过了科学
家们的系统研究和验证,现在得到了广泛认可的结果。
阿伏加德罗常数是化学中一个非常
基础、非常重要的常数,它的正确值对于化学领域的理论研究和应用都有着巨大的影响。
物质的量及其阿伏伽德罗常数
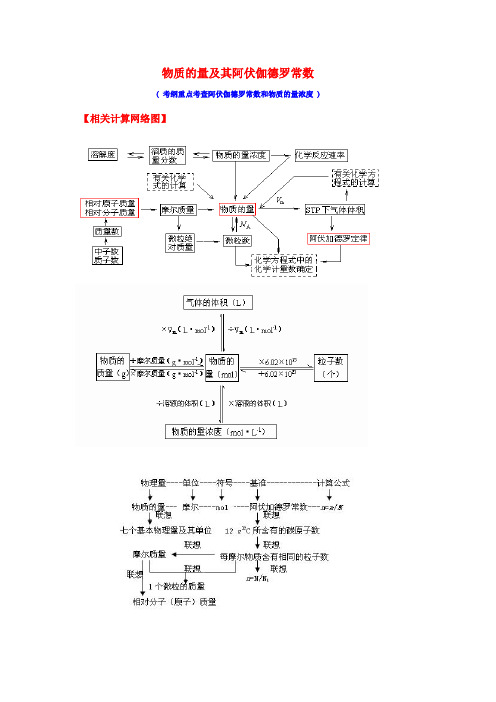
物质的量及其阿伏伽德罗常数( 考纲重点考查阿伏伽德罗常数和物质的量浓度 )【相关计算网络图】【知识点梳理】一、物质的量:1﹑物质的量(n):表示物质含指定粒子多少的物理量注:专有名词,表示微观粒子单位:摩尔(mol),简称为摩规定0.012kg12C中所含碳原子数为1mol阿伏加德罗常数N A =6.02×1023mol-1计算公式:n=N/ N A2﹑摩尔质量(M):单位物质的量的物质所具有的质量单位:g/mol 或 g﹒mol-1计算公式:M=m/n二、阿伏伽德罗常数(一)阿伏加德罗定律(1)在相同的温度和压强下,相同体积的任何气体都含有相同数目的分子(2)注意:①使用范围:气体;②使用条件:同温、同压、同体积;③特例:气体摩尔体积(3)推论:用n表示物质的量,V表示体积,P表示压强,M表示摩尔质量(式量),ρ表示密度。
(注意语言表达)①同温同压:V1/V2 = n1/n2 = N1/N2②同温同体积:P1/P2 = n1/n2 = N1/N2③同温同压:ρ1/ρ2 = M1/M2④同温同压同质量:V1/V2 = M1/M2⑤同温同压同体积:m1/m2 = M1/M2(二)阿伏伽德罗常数的考查方式1,考查物质的状态考查气体摩尔体积时,常用在标准状况下非气态的物质来迷惑考生,如H2O、SO3、CCl4、苯、辛烷等,要清醒地看到气体摩尔体积适用的对象是气体,对非气态物质不适用。
因此,要掌握常见物质的状态,在常见有机物中C≤4的烃、CH3Cl、甲醛为气态,其它一般为非气体。
2,考查气体摩尔体积应用条件气体摩尔体积适用于0℃、1.01×105Pa,而在许多考题中常给出非标准状况如:常温常压;在25℃、1.01×105Pa时等,要注意气体摩尔体积适用的条件。
另外,要明确物质的质量或物质的量与状态无关,因此,这时的判断不涉及22.4L/mol。
“如常温常压下,1 mol 氦气含有的核外电子数为2N A”这句话是正确的。
阿伏伽德罗常数

阿伏加德罗常数一、相关知识点:1、摩尔:表示物质的量的单位,每摩尔物质含有阿伏加德罗常数个微粒。
即:n=N/NA。
2、阿伏加德罗常数:0.012kg 12C含有的碳原子数就是阿伏加德罗常数。
阿伏加德罗常数经过实验已测得比较精确的数值。
在这里,采用6.02×1023这个非常近似的数值。
3、摩尔质量:单位物质的量的物质所具有的质量叫做摩尔质量,摩尔质量的单位是g/mol或kg/mol。
4、物质的量(n)、物质的质量(m)和物质的摩尔质量(M)之间的关系:M=m/n.5、气体摩尔体积:单位物质的量的气体所占有的体积叫做气体摩尔体积。
即:Vm=V/n.在标准状况下,1mol的任何气体所占的体积都约是22.4L,这个体积叫做气体摩尔体积。
6、阿伏加德罗定律:在相同的温度和压强下,相同体积的任何气体都含有相同数目的分子。
7、物质的量浓度:以单位体积溶液里所含溶质B的物质的量来表示的溶液组成的物理量,叫做溶质B的物质的量浓度。
即:cB =nB/V。
8、相关原理:电子守恒、电荷守恒、电离平衡、水解平衡、物质结构、晶体结构方面的知识等。
1.(14年广东-10)设nA为阿伏加德罗常数的数值。
下列说法正确的是A.1mol甲苯含有6nA个C-H键B.18gH2O含有10nA个质子C.标准状况下,22.4L氨水含有nA 个NH3分子D.56g铁片投入足量浓H2SO4中生成nA个SO2分子2.(13·广东·9)设nA为阿佛加德罗常数的数值,下列说法正确的是A.常温常压下,8gO2含有4nA个电子B.1L0.1molL-1的氨水中有nA 个NH4+C.标准状况下,22.4L盐酸含有nA个HCl分子D.1molNa被完全氧化生成Na2O2,失去个2nA电子3、(12·广东11)设nA 为阿伏伽德罗常数的数值,下列说法正确的是A 常温下,4gCH4含有nA 个C-H共价键B 1 mol Fe 与过量的稀HNO3反应,转移2 nA 个电子C 1 L 0.1 mol ·1L NaHCO3液含有0.1nA 个HCO3—D 常温常压下,22.4L的NO2和CO2合气体含有2 nA 个O 原子4.(11广东9)设nA为阿伏伽德罗常数的数值,下列说法正确的是A、常温下,23g NO2含有nA个氧原子B、1L0.1mo l•L-1的氨水含有0.1nA个OH―C、常温常压下,22.4LCCl4含有个nA个CCl4分子D、1molFe2+ 与足量的H2O2溶液反应,转移2nA个电子5. (10广东)设 A n 为阿伏加德罗常数的数值,下列说法正确的是A.16g 4CH 中含有4A n 个C-H 键B.1mol ·1L -NaCl 溶液含有A n 个Na +C.1mol Cu 和足量稀硝酸反应产生 A n 个NO 分子D.常温常压下,22.4L 2CO 中含有 A n 个2CO 分子二、解题注意点 首先要见量化摩1.运用22.4求气体物质的量,只适合标况下的所有气体,(包括混合气体)( C>4烃,大部分卤代烃,醇, SO 3 ,H 2O , Br 2 ,I 2在标况下为液体或固体) 2. Na 2O 2与水或二氧化碳反应时,1mol Na 2O 2转移1mol 电子。
例析高三化学“阿伏伽德罗常数”计算

例析高三化学“阿伏伽德罗常数”的计算摘要:计算是化学知识的重要组成部分,计算贯穿于整个化学学习过程。
在初中化学中,计算一直以质量为中心,但进入高中后,化学计算便以物质的量为中心,在历年的高考化学选择题中,物质的量的计算又以微粒数目的计算为考查重点,联系微粒数目的重要物理量便是阿伏伽德罗常数,微粒数目的计算实际就是关于阿伏伽德罗常数的计算。
关键词:阿伏伽德罗常数;计算;化学一、直接利用物质的量求微粒数根据公式:n(微粒)=n(微粒)×na,要求计算物质中的微粒数目,必须求得物质中微粒的物质的量,如果已知组成物质的微粒的物质的量,便可以直接求算微粒数。
但在解该类问题时,审题一定要仔细,弄清题干具体要求计算的微粒种类。
1.直接考查组成物质的微观粒子例如.(2011全国新课标)下列叙述正确的是a.1.00molnacl中含有6.02×1023个nacl分子b.1.00molnacl中,所有na+的最外层电子总数为8×6.02×1023c.欲配制1.00l1.00mol·l—1的nacl溶液,可将58.5gnacl溶于1.00l水中d.电解58.5g熔融的nacl,能产生22.4l氯气(标准状况)、23.0g金属钠分析:b项中,直接已知了nacl的物质的量是1.00mol,但是题意要求我们算na+的最外层电子总数,一个na+的最外层电子数是8。
1.00molnacl中含有1.00molna+,1.00molna+含有8mol的电子,所以最外层电子总数为8×6.02×1023。
因此,b项正确。
2.氧化还原反应中转移电子数的计算例如.(2011广东高考9)设na为阿伏伽德罗常数的数值,下列说法正确的是a.常温下,23gno2含有na个氧原子b.1l0.1mol·l—1的氨水含有0.1na个oh—c.常温常压下,22.4lccl4含有个na个ccl4分子d.1molfe2+与足量的h2o2溶液反应,转移2na个电子分析:d项中直接已知了fe2+的物质的量是1.00mol,题意要求我们计算转移的电子数,因此我们必须弄清楚实际参加反应的物质的物质的量,1molfe2+与足量的h2o2溶液反应时,fe2+被完全氧化fe3+,1个fe2+转化为fe3+时失去1个e—,1molfe2+转化为fe3+时,失去1.00mole—,1molfe2+与足量的h2o2溶液反应,转移na个电子。
阿伏加德罗常数公式及推导公式

阿伏加德罗常数公式及推导公式阿伏加德罗常数公式由意大利数学家阿伏加德罗(LeonhardEuler)在1734年提出,是有史以来最重要的数学公式之一。
阿伏加德罗常数公式是一个复杂而又有趣的数学公式,它由一些数学符号和π(圆周率)组成。
这种公式是由阿伏加德罗在他的一个数学论文中提出的结果,他用一系列演绎旨在将它推导出来。
阿伏加德罗常数公式如下:e^(πi)+1=0其中“e”表示指数,“π”表示圆周率,“i”表示虚数单位。
它的意思是把π乘以虚数单位,然后求e的指数函数的值,再加上1,结果会等于0。
也就是说,这个数学结论是:虚数单位和π的乘积的指数函数的值加上1,等于0。
推导阿伏加德罗常数公式非常有趣且具有挑战性,因为它涉及到了指数函数、虚数单位和圆周率。
首先,我们从定义指数函数开始,指数函数代表一个数字被指定次幂扩大:x^n = x*x*x**x(n次)。
其中x表示一个指定的数,n表示该数的次幂。
其次,我们从虚数单位开始,它是一个复数的特殊形式,由等式i^2 = -1来定义,其中i表示虚数单位,-1表示虚数单位的平方。
最后,我们从圆周率π开始,它是一个定义圆周长与直径之比的常数,其值约为3.1415926。
在推导阿伏加德罗常数公式之前,我们先将上述3个概念结合起来。
下面是推导公式过程:(1)先利用指数函数的性质:x^m * x^n = x^(m+n),将虚数单位i乘以圆周率π:i^2 * = * (-1) = -π(2)然后利用指数函数的性质:e^x * e^y = e^(x+y),上述结果带入公式:e^(-π) * e^(π * i) = e^(-π + * i) (3)接下来利用指数函数的性质:e^(x + y) = e^x + e^y,上述结果带入公式:e^(-π)*e^(π*i) = e^(-π) + e^(π*i) (4)最后将1带入公式:e^(-π) + e^(π*i) + 1 = 0因此,将上述4个步骤推导结果结合起来就是阿伏加德罗常数公式:e^(πi)+1=0。
关于阿伏伽德罗常数的公式

关于阿伏伽德罗常数的公式1. 阿伏伽德罗常数的由来说到阿伏伽德罗常数,可能很多人脑海里浮现出的是化学课上老师那个严肃的脸,或者是实验室里一堆复杂的公式。
其实,这个常数背后还有个故事呢!阿伏伽德罗(Avogadro)这个名字听起来就像个意大利的音乐家,其实他是个牛逼的科学家,生活在19世纪。
他提出的这个常数,告诉我们在同样的温度和压力下,不同气体的分子数是相同的,简直就是化学界的一次小革命。
人们就根据他得出的结论,给这个常数起了个名字:阿伏伽德罗常数。
要知道,这可不是个小数字哦!它的值大约是 (6.022times 10^{23),听起来像是个天文数字,实际上是指1摩尔物质中含有的粒子数量。
1.1 阿伏伽德罗常数的公式那么,阿伏伽德罗常数到底有什么用呢?其实,它在化学、物理,甚至生活中都能派上用场。
用公式来表达,阿伏伽德罗常数 (N_A) 可以写成:N_A = frac{N{n这里的 (N) 代表粒子的总数,而 (n) 是摩尔数。
简单来说,如果你手里有一摩尔的糖果,想知道里面一共有多少颗糖果,你只需要把摩尔数乘以阿伏伽德罗常数就可以了。
说到这里,想必大家都知道一摩尔的巧克力大概能填满一个小碗吧?哈哈,真是让人流口水的计算啊!1.2 阿伏伽德罗常数的实际应用说到实际应用,阿伏伽德罗常数在化学反应中可不是摆设。
比如说,当你在厨房里煮东西时,知道每种食材的量,就能更好地控制味道。
想象一下,如果你做的蛋糕里每样材料都用对了量,那么就能做出一个完美的蛋糕!这里面的每个成分都可以用阿伏伽德罗常数来帮助你精确计算。
这个小常数,虽然名字拗口,却能帮你在厨房里成为烘焙小达人。
2. 为什么阿伏伽德罗常数如此重要那么,为什么大家都说阿伏伽德罗常数那么重要呢?首先,它让我们能在微观世界和宏观世界之间搭起一座桥梁。
就像是一个翻译官,帮助我们理解微小的分子和我们日常生活中看到的物体之间的关系。
想想看,当你在超市里买一瓶水,瓶子里的水分子数量可真是数不胜数,只有阿伏伽德罗常数才能让我们明白这一切。
有关阿伏伽德罗常数的计算的探究

评价研究新课程NEW CURRICULUM关于阿伏伽德罗常数的计算是历年高考的“热点”问题,多年全国高考化学试题重现率几乎为100%。
之所以能成为高考的热点,是因为该类试题以中学所学过的一些重点物质为平台,能考查学生对阿伏伽德罗常数及与其有联系的物质的量、摩尔质量、气体摩尔体积、物质的量浓度、阿伏伽德罗定律等概念与原理的理解是否准确深刻,各类守恒关系、平衡的有关原理掌握的是否牢固。
题目涉及的知识面广,灵活性强,思维跨度大,高考中对这些知识反复进行考查,对考生思维能力的品质———严密性、深刻性是一个很好的检验。
命题者往往有意设置一些陷阱,增大试题的区分度,导致学生实际的得分率并不高。
所以我们应该掌握高考的考试要求,明确高考的命题趋势,完善知识要点梳理,认清题目陷阱设置,培养学生良好的思维品质。
经过十年的高中化学教学,我就阿伏伽德罗常数计算的常见题型及解题方法进行分析并小结如下,供高考学子们参考。
一、计算物质中所含微粒的数目这类题目往往是给出一定质量、一定物质的量或一定体积的物质(或微粒)来计算该物质(或微粒)中所含的微粒(分子、原子、质子、中子、电子、共价键、离子)数。
(1)计算物质中的分子数只要计算出其物质的量即可。
(2)计算溶液中的离子数。
做这类题要遵循“先看是否完全电离,再看是否水解”的思路。
对于完全电离且不水解的物质,根据电离方程式列比例式即可求出离子的物质的量,对于不完全电离或要水解的离子则无法算出具体的数值。
(这类题目中还常常出现“只已知溶质的物质的量浓度求算某离子数目”的陷阱。
遇此陷阱只需直接判断其错误无需计算。
)(3)计算较大微粒中的较小粒子。
即计算分子或离子中的原子、质子、中子、电子、共价键、离子数等。
做这类题的思路是:先计算出一个较大微粒中的较小粒子,在根据粒子数之比等于其物质的量之比列比例式求出较小粒子的物质的量即可。
(4)计算混合物中的粒子数。
遇到此类题目时,首先要判断一下混合物之间是否反应,反应是否完全及产物是否稳定。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
关于混合物中阿伏伽德罗常数的计算方法
作者:施竹卿
来源:《新课程·教研版》2010年第15期
阿伏伽德罗常数和粒子数的分析与比较是多少年来经久不衰的高考必考题。
本文就混合物中阿伏伽德罗常数的计算的常见题型及解题技巧进行分析。
常见的混合物中阿伏伽德罗常数的计算问题中有如下种题目:
1.在标准状况下,11.2L甲烷和乙烯的混合物所含氢原子的数目为2Ⅳ^
2.标准状况下,2.24LNH3和CH4的混合气体,所含电子总数为2N A
3.常温常压下,16羁氧气与14g氮气混合气体中,含有的分子总数为N A
4.常温常压下,imol碳烯:(CH)和氧原子的混合物中所含电子总数为8N A
5.室温下。
28.0g乙烯和丙烯混合气体中含有的碳原子数为2N A
6.3%甲醛与乙酸混合物中所含原子数为4N A
7.常温常压下,8.8gCO2和N2O的混合物中所含有的原子数为0.6N A
解决此类题常用的方法有三种:
一、把混合物当纯净物
例1.14g乙烯和丙烯的混合物中含氢原子数为2N A。
解析:将乙烯和丙烯的混合物当纯净物C n H2n对待,即氢原子数为(14/14n)x2nxN A。
例2.在标准状况下。
11.2L甲烷和乙烯的混合物所含氢原子的数目为2N A
解析:将甲烷和乙烯的混合物当纯净物CxH4对待,即在标准状况下,11.2LCxH4气体中所含氢原子的数目为(11.2/22.4)x4 N A=2N A
二、用极限法解决
当两种物质的混合物不能当纯净物对待时,可采用极限法强行将其当纯净物对待。
例1,由Co2和O2:组成的混合物中共有Ⅳ^个分子,其中氧原子数为2N,
解析:由于CO2:为三原子分子O2:为双原子分子,所以不能将其当做纯净物。
只好采用极限法将其强行当成纯净物。
即CO2和O2共Imol,若1mol全是CO2其中氧原子数为2N A,若1mol 全是O2,其中氧原子数为2N A。
所以CO2和O2共Imol,其中氧原子数也为2N A。
例2,标准状况下,2.24LNH3和Ch4的混合气体,所含电子总数为10N A
解析:由于若0.1mol全是NH3,若0.1mol全是CH4所含电子总数均为N A所以标准状况
下,2.24LNH3和CH4的混合气体,所含电子总数为N A
三、利用结构的相似点解决
等质量的同素异形体或同分异构体或实验式相同的有机物中所含的原子数目一定相同如16g氧气和16g臭氧中含氧原子数均为N A、14g乙烯和14g丙烯含氢原子数均为2N A、30g甲醛与30g乙酸中所含原子数总数均为4N A。
所以当出现一定质量的上述物质的混合物时,所含原子数不变。
即16g氧气和臭氧的混合物中含氧原子数为N A、30g甲醛与乙酸的混合物中所含原子数总数为4N A。
