依达拉奉注射液稳定性试验资料
依达拉奉注射液的质量标准

依达拉奉注射液的质量标准
依达拉奉注射液是一种用于治疗风湿性关节炎和类风湿性关节炎的药物。
为了保证患者的用药安全和疗效,制定一份严格的质量标准至关重要。
下面是一份关于依达拉奉注射液的质量标准的示范,包括药物的外观、成分、纯度、稳定性以及生产工艺等方面的要求。
1. 外观要求
依达拉奉注射液应该是一种清澈、无色透明的液体,不得有悬浮物或沉淀物。
瓶身应干净完整,无破损或渗漏。
2. 成分及含量测定
(1)依达拉奉注射液的主要成分为依达拉奉。
(2)依达拉奉的含量应符合国家药典中规定的标准要求。
3. 纯度要求
(1)依达拉奉注射液中有关杂质的含量应符合国家药典中规定的限量要求。
(2)微生物限度应符合国家药典中规定的要求。
4. 稳定性
依达拉奉注射液在常温下应该能保持稳定,不分解、不氧化或不发生其他化学变化。
5. 生产工艺要求
(1)生产车间应符合GMP标准。
(2)所有原辅料应当有详细的质量控制记录。
(3)生产过程中的所有关键步骤均应定期进行验证。
(4)设备应当定期维护、清洁,并进行有效的验证。
6. 包装要求
依达拉奉注射液的包装材料应符合药物包装的相关要求,确保能有效地保护药品的质量和稳定性。
总结
依达拉奉注射液的质量标准应当覆盖药品的外观、成分、纯度、稳定性和生产工艺等方面,并严格按照国家药典的要求进行检测和验证。
生产企业在生产过程中应该始终遵守GMP等相关质量标准,并建立健全的质量管理体系。
这样才能确保依达拉奉注射液的质量稳定可靠,从而在临床应用中发挥出预期的疗效。
依达拉奉在不同注射液中配伍稳定性的研究

依达拉奉在不同注射液中配伍稳定性的研究摘要】目的:对依达拉奉注射液与碳酸氢钠注射液,乳酸钠林格注射液,复方电解质注射液的配伍稳定性进行探讨分析。
方法:对配伍注射液中的依达拉奉注射液含量采用高效液相色谱仪进行检测,并观察配伍注射液的ph值和外观。
结果:依达拉奉注射液分别与三种不同注射液进行配伍,在配伍后8小时之内,其外观和ph值没有出现明显变化,依达拉奉含量稳定。
结论:依达拉奉注射液分别与碳酸氢钠注射液,乳酸钠林格注射液,复方电解质注射液这三种不同注射液进行配伍,在配伍8小时之内使用稳定,但是在临床上需要谨慎使用。
【关键词】依达拉奉;注射液;配伍;稳定性【中图分类号】R969.2 【文献标识码】A 【文章编号】1007-8231(2016)34-0254-02依达拉奉注射液在临床上的主要作用是进行自由基的清除,对脂质过氧化得到抑制,进而对血管内皮细胞、脑细胞以及神经细胞氧化损伤进行控制,其是一种脑保护剂,也被称为自由基清除剂[1]。
本研究就对依达拉奉与碳酸氢钠注射液、复方电解质注射液以及乳酸钠林格注射液这三种不同注射液的配伍进行探讨分析。
现具体报告如下:1.所需仪器和试药本研究所采用的试验仪器包括:waters2695-2488高效液相色谱仪、赛多利斯pb-10酸度计、电子天平型号为赛多利斯bt125d以及型号为gwj-8jd的微粒检测仪。
试药包括:依达拉奉注射液(南京先声东元制药有限公司,国药准字H20031342);依达拉奉对照品;依达拉奉杂志I对照品;碳酸氢钠注射液(生产厂家:湖南康源制药有限公司,批准文号:国药准字H43020168);乳酸钠林格注射液(生产厂家:四川科伦药业股份有限公司,批准文号:国药准字H20055488);复方电解质注射液(生产厂家:河北天成药业股份有限公司,批准文号:国药准字H20123411);色谱纯乙腈;分析纯磷酸二氢氨。
2.方法与结果2.1 含量测定在进行含量测定的过程中,首先需要具备色谱条件,采用InertiaSustainC18色谱柱,磷酸二氢氨溶液0.10mol/L,先用15%的磷酸溶液将ph值调节到3.5,流动相为甲醇,240nm的检测波长,其进量为12μL。
依达拉奉注射液安全性实验研究

有明确疗效,可明显提高患者自理能力,改善预后,其 机制与依达拉奉能增加超氧化物歧化酶活性,有效维 持线粒体的结构完整有关[6]。本试验的受试药物依达 拉奉注射液对红细胞未见明显溶血和凝集作用; 家兔 静脉注射给药后未见明显血管刺激性; 豚鼠静脉注射 后第 21 天未见明显全身主动过敏反应。以上结果提 示依达拉奉注射液安全性较好,可供临床静脉注射给 药。
1 材料与方法
1. 1 实验材料 依达拉奉注射液,规格: 7. 5 mg /5ml / 支( 合肥久诺医药科技有限公司,批号: 2009091541) ; 氯化 钠 注 射 液 ( 中 国 大 冢 制 药 有 限 公 司,批 号: OE75B) ; 白色家兔,体质量( 2. 4 ± 0. 19) kg; 白色豚鼠, 体质量 300 ~ 350 g,由安徽长临河医药科技有限公司
[关键词] 处方分析; 不合理用药; 门诊 doi: 10. 3969 / j. issn. 1000 - 0399. 2011. 09. 053
Analysis of irrational drug use in outpatient prescriptions Wang Tao,Xu Guosheng Department of Pharmacy,105 th Hospital of PLA,Hefei 230031,China [Abstract] Objective To investigate the quality of the outpatient prescriptions in our hospital and analyze the reasons for the irrational drug use. Methods 6 000 outpatient prescriptions were randomly selected for the analysis of prescription rationality. Results 371 ( 6. 18% ) prescriptions were found to be unqualified. The main problems laied in the unreasonable combination,repeated medication,incorrect medicine,incorrectness of dosage and administration and unreasonable dissolvent. Conclusion As the causes for irrational drug use vary and tend to be complicated,pharmacists should strengthen monitoring on rational use of prescription drugs. [Key words] Prescription analysis; Irrational drug use; outpatient department
依达拉奉注射液临床前研究工作综述

依达拉奉注射液临床前研究工作综述依达拉奉是日本日本三菱东京制药株式会社研制开发的新型脑保护剂,2001年4月经后生省批准在日本上市。
国外上市剂型为水针剂,规格为30mg/20ml,参照国外上市剂型及规格,按照我国《新药审批办法》的有关规定,完成以下研究工作:2.1、依达拉奉注射液完整处方主、辅料重量(g)依达拉奉30.0亚硫酸氢钠20.0L-半胱氨酸盐酸盐一水合物10.00.5mol/L氢氧化钠溶液调节至pH3.5~4.0注射用水加至20L制成 1000支2.2、制备工艺按处方量称取L-半胱氨酸盐酸盐一水合物置加有适量注射用水的配液罐中溶解,加入0.1%的针用活性炭,搅拌30分钟,过滤除炭,称取处方量依达拉奉加入上述滤液中,加热搅拌30分钟使依达拉奉完全溶解;另称取处方量亚硫酸氢钠溶解后,加入0.1%的针用活性炭过滤除炭,滤液加入依达拉奉和L-半胱氨酸盐酸盐一水合物溶液中,0.5mol/L氢氧化钠溶液调节至pH3.5~4.0,注射用水加至全量,0.45µm滤膜过滤。
中间体检查pH、含量等合格后,灌装到安瓿中,熔封,115℃热压灭菌30分钟,质量检查合格后包装,即得。
2.3、理化常数、纯度检查、含量测定等与质量标准研究有关的研究工作本品外观性状为无色的澄明液体。
本品的鉴别采用紫外法、化学法和高效液相色谱法。
本品纯度考察了装量、pH值、颜色和有关物质等,其它各项均符合注射液项下的有关各项规定。
含量测定采用了高效液相色谱法,经方法学考察,高效液相色谱法专属性强,灵敏度高,回收率好,可做为依达拉奉注射液的含量测定方法。
根据上述研究结果制定了质量标准。
2.4、制剂的初步稳定性研究本品经影响因素试验表明:本品对光照、40℃高温等条件,各项指标无影响;60℃高温条件下有关物质略有增加,其他各项指标无影响;加速试验六个月,各项指标均无变化;室温留样考察六个月,各项指标无变化。
因此本品应室温保存。
2.5、药理及毒理研究详见原料药资料。
依达拉奉注射液的质量标准

依达拉奉注射液的质量标准依达拉奉注射液是一种用于治疗心血管疾病的药物,其质量标准对于保障患者的安全和治疗效果至关重要。
以下是依达拉奉注射液的质量标准的详细内容。
一、通用规定1.1 规格依达拉奉注射液的规格应符合国家药典或相关法规的规定。
1.2 外观依达拉奉注射液应为无色透明液体,无悬浮物和沉淀物。
1.3 标注依达拉奉注射液的包装上应标注药品的通用名称、生产厂家、生产批号、生产日期、有效期、贮藏条件等信息,以确保患者和医护人员能够准确识别和使用药品。
二、理化性质2.1PH值依达拉奉注射液的pH值应在指定范围内,通常为7.0~8.0。
2.2 清晰度依达拉奉注射液在透明度方面应符合规定标准,不得出现浑浊或沉淀物。
2.3 溶解度依达拉奉注射液的溶解度应符合相关规定,确保其在临床使用中能够充分溶解,提高药效。
2.4 物理稳定性经稳定性测试后,依达拉奉注射液应在指定条件下保持其理化性质的稳定,不得出现明显变化。
三、成分含量3.1 主要成分依达拉奉注射液主要含有依达拉奉,其含量应符合国家药典或相关法规的规定。
3.2 杂质限量依达拉奉注射液中的杂质应符合相关规定,不得超过规定的限量,以确保药品的纯度和安全性。
3.3 有关物质含量依达拉奉注射液可能含有辅料或保护剂,这些物质的含量和限量也需要符合相应的规定,以确保药品的稳定性和安全性。
四、微生物限度针对依达拉奉注射液,应进行微生物限度测试,确保药品符合相关微生物限度的规定,保证使用安全。
五、稳定性依达拉奉注射液应进行长期稳定性测试和加速稳定性测试,以确保在存储和使用过程中不会因环境条件的变化而影响药品的质量和疗效。
六、附加要求根据依达拉奉注射液的特殊性质,可能还需要对其进行一些附加的质量标准的测试和要求,以确保其在临床使用中能够发挥应有的药效。
七、质量控制生产依达拉奉注射液的企业应建立和执行严格的质量控制体系,包括从原材料采购到生产工艺的全程控制,确保每一批产品都符合质量标准的要求。
依达拉奉注射液检验报告
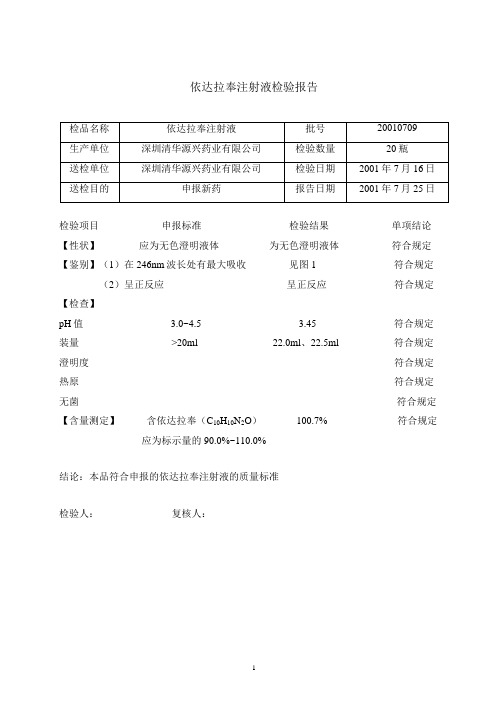
依达拉奉注射液检验报告检验项目申报标准检验结果单项结论【性状】应为无色澄明液体为无色澄明液体符合规定【鉴别】(1)在246nm波长处有最大吸收见图1 符合规定(2)呈正反应呈正反应符合规定【检查】pH值 3.0~4.5 3.45 符合规定装量 >20ml 22.0ml、22.5ml 符合规定澄明度符合规定热原符合规定无菌符合规定【含量测定】含依达拉奉(C10H10N2O) 100.7% 符合规定应为标示量的90.0%~110.0%结论:本品符合申报的依达拉奉注射液的质量标准检验人:复核人:依达拉奉注射液检验报告检验项目申报标准检验结果单项结论【性状】应为无色澄明液体为无色澄明液体符合规定【鉴别】(1)在246nm波长处有最大吸收见图2 符合规定(2)呈正反应呈正反应符合规定【检查】pH值 3.0~4.5 3.50 符合规定装量 >20ml 21.8ml、22.2ml 符合规定澄明度符合规定热原符合规定无菌符合规定【含量测定】含依达拉奉(C10H10N2O) 100.5% 符合规定应为标示量的90.0%~110.0%结论:本品符合申报的依达拉奉注射液的质量标准检验人:复核人:依达拉奉注射液检验报告检验项目申报标准检验结果单项结论【性状】应为无色澄明液体应为无色澄明液体符合规定【鉴别】(1)在246nm波长处有最大吸收见图3 符合规定(2)呈正反应呈正反应符合规定【检查】pH值 3.0~4.5 3.53 符合规定装量 >20ml 20.6ml、21.5ml 符合规定澄明度符合规定热原符合规定无菌符合规定【含量测定】含依达拉奉(C10H10N2O) 100.2% 符合规定应为标示量的90.0%~110.0%结论:本品符合申报的依达拉奉注射液的质量标准检验人:复核人:。
依达拉奉注射液检验报告
依达拉奉注射液检验报告依达拉奉(英文名Yidafen)是一种抗癌药物,主要用于治疗肺癌、胃癌、食管癌等恶性肿瘤。
依达拉奉注射液(以下简称“依达注射液”)是一种针剂,每支剂量为50mg,作为化疗的辅助药物使用。
作为一种抗癌药物,依达注射液的质量是非常重要的,因此需要进行严格的检验。
本次检验旨在验证依达注射液的药物成分、效力以及质量控制等方面的情况。
首先,我们对依达注射液的药物成分进行了检验。
经过分析,我们发现依达注射液的主要成分是依达替尼(Yidathini)和辅料。
依达替尼是一种经过精密合成的化合物,是这种药物的主要有效成分。
辅料包括溶剂和稀释剂等辅助成分,主要用于增强依达替尼的药效。
其次,我们对依达注射液的效力进行了检验。
经过体外试验,我们发现依达注射液对肿瘤细胞的抑制作用非常显著。
在一系列浓度下,依达注射液都能有效地抑制肿瘤细胞的增殖,并且浓度越高,抑制作用越明显。
这表明依达注射液具有良好的抗肿瘤效力。
最后,我们对依达注射液进行了质量控制的检验。
在此过程中,我们对依达注射液的pH值、温度稳定性以及外观等方面进行了检测。
结果显示,依达注射液的pH值稳定在5.5-7.0的范围内,并且在不同温度下的稳定性也非常好。
此外,依达注射液外观无任何异物,并且无悬浮物或沉淀的现象,符合药品的标准。
综上所述,依达注射液在药物成分、效力以及质量控制等方面均符合标准要求。
它作为一种抗癌辅助药物,具有良好的抑制肿瘤细胞增殖的效果,并且质量稳定可靠。
在临床应用中,医生们可以根据患者的具体情况选择合适的剂量,以达到最佳的治疗效果。
但是,需要注意的是,依达注射液属于处方药物,应在医生指导下使用,避免自行使用或滥用。
依达拉奉资料参考翻1
Ⅱ.有关名称的项目1.商品名(1)和名:Radicut注射用30mgRadicut静脉点滴用30mg (袋装输液)(2)洋名:RADICUT BAG for I.V. Infusion30mg(3)名称的由来:因本品可清除自由基而得名。
2.通用名(1)和名(命名法):依达拉奉(日本※)※1997年5月在日本将本品原来的名称Meferaven(Meferaven)变更为依达拉奉(Edaravone)。
(2)洋名(命名法):Edaravone(日本※,INN)※1997年5月在日本将本品原来的名称Meferaven(Meferaven)变更为依达拉奉(Edaravone)。
(3)起源:不明3.结构式或示性式4.分子式及分子量分子式:C10H10N2O分子量:174.205.化学名(命名法)3-甲基-1-苯基-2-吡唑啉-5-酮6.惯用名,别名,缩写,记号药物号:MCI-186(MY-7906)别名:meferaven7.CAS登录号89-25-8Ⅲ.有关有效成分的项目1.物理化学的性质(1)外观・性状:本品为白色~微黄白色的结晶或结晶性的粉末。
(2)溶解性:※溶解依达拉奉1g(3)吸湿性:在室温下约0%相对湿度,约64%相对湿度,约93%相对湿度及在40℃下,75%相对湿度的条件下保存38日,均未见重量的变化,表明本品没有吸湿性。
(4)熔点(分解点),沸点,凝固点:熔点:127~131℃(5)酸碱解离常数:pKa=7.0(6)分配系数:(7)其他的主要示性值:吸光度2.有效成分在各种条件下的稳定性试验项目:性状,确认试验,pH,熔点,纯度试验,干燥减量,含量3.有效成分的确认试验法(1)紫外可见吸光度测定法(2)红外吸收光谱法测定法(溴化钾片剂法)4.有效成分的定量法电位差滴定法Ⅳ.有关制剂的项目1.剂形(1)剂形的区别,规格及性状:(2)溶液及溶解时的pH,渗透压比,粘度,比重,稳定的pH域等:*1.对生理盐水之比(3)注射剂的容器中的特殊的气体的有无及种类:Radicut注射用30mg:氮Radicut静脉点滴用(袋装输液):氮2.制剂的组成(1)有效成分(活性成分)的含量:(2)添加物:参照上记(1)项(3)电解质的浓度:没有相关资料。
CTD模板依达拉奉(资料02)
依达拉奉研制工作综述依达拉奉是日本日本三菱东京制药株式会社研制开发的新型脑保护剂,2001年4月经后生省批准在日本上市,现未列入任一国药典, 按《新药研究审批办法及有关规定》本品列为新药二类(化学药品)。
按照我国《新药审批办法》的有关规定,完成以下研究工作:2.1、原料药合成:将苯肼与乙酰乙酸乙酯在乙醇中回流制得1-苯基3-甲基-2-吡唑啉-5-酮,收率49%。
2.2、结构确证:结构确证经元素分析、红外、紫外、核磁碳谱、核磁氢谱、质谱、X-光衍射和差热分析,证明合成样品结构与依达拉奉结构一致。
2.3、理化常数、纯度检查、含量测定的研究及质量标准的制订:对三批样品进行理化性质的研究,如外观性状、色,嗅、味、溶解度、熔点、摩尔吸光系数等。
对本品的鉴别采用了紫外鉴别法、化学法和红外光谱法。
本品的纯度检查考察了乙醇溶液的澄清度与颜色、有关物质、硫酸盐、氯化物、干燥失重、炽灼残渣、重金属、砷盐等。
含量测定采用了非水滴定法,经研究此方法测定含量精密度好,本品含量均大于99.0%。
根据理化常数、纯度检查、含量测定的研究结果制定了质量标准。
2.4、稳定性研究本品经影响因素试验表明:本品对光照、高温、高湿等条件,除光照条件下性状微有变黄外,各项指标无变化;加速试验六个月,各项指标均无变化。
长期留样考察六个月,各项指标无变化。
因此本品应遮光保存。
2.5、主要药效学研究依达拉奉为强效自由基清除剂,可抑制脑组织缺血-再灌注引起的大量自由基和脂质过氧化物的产生,从而保护脑组织,减轻脑神经症状,促进神经功能恢复。
药效研究文献资料表明:本品能抑制谷氨酸对神经细胞的损伤作用,大鼠全脑缺血动物模型、大鼠半脑缺血动物模型以及临床脑梗塞病例研究结果表明,依达拉奉静脉注射给药后能抑制脑缺血所致的神经细胞损害以及抑制脑水肿和脑梗塞进展过程,临床试验显示依达拉奉能抑制梗塞周边血流量的下降,保护梗塞区脑组织。
2.6、药理、毒理研究2.6.1. 一般药理试验:依达拉奉10 mg/kg低剂量组静脉给药后对小鼠和大鼠的一般症状均无影响,30 mg/kg以上剂量组可见眼睑下垂,流泪,流涕,活动低下症状。
依达拉奉注射液资料05
处方、工艺研究资料及文献资料5.1、处方以1000支计主、辅料重量(g)依达拉奉30.0亚硫酸氢钠20.0L-半胱氨酸盐酸盐一水合物10.00.5mol/L氢氧化钠溶液调节至pH3.5~4.0注射用水加至20L5. 2、工艺:5.2.1 、前处理5.2.1.1、安瓿的处理:首先用水冲洗,再用2%氢氧化钠溶液(50~60℃)浸泡(超声15分钟),刷洗至呈中性,用蒸馏水冲洗3次,注射用水冲洗2次。
口朝下125℃干燥1小时,备用;5.2.1.2、微孔滤膜的处理:取0.45µm的醋酸、硝酸纤维素混合酯膜,浸泡于注射用水中1小时,煮沸5分钟,重复3次,备用;5.2.1.3、乳胶管的处理:用水揉洗,然后加适量0.5~1.0%的氢氧化钠溶液煮沸,洗去碱水,加适量0.5~1.0%盐酸溶液,煮沸30分钟,蒸馏水洗至中性,注射用水煮沸,备用;5.2.1.4、设备处理:制备过程中的设备和用具清洗、检验合格后,备用;5.2.2 、配液、灌装:按处方量称取L-半胱氨酸盐酸盐一水合物置加有适量注射用水的配液罐中溶解,加入0.1%的针用活性炭,搅拌30分钟,过滤除炭,称取处方量依达拉奉加入上述滤液中,加热搅拌30分钟使依达拉奉完全溶解;另称取处方量亚硫酸氢钠溶解后,加入0.1%的针用活性炭过滤除炭,滤液加入依达拉奉和L-半胱氨酸盐酸盐一水合物溶液中,0.5mol/L氢氧化钠溶液调节至pH3.5~4.0,注射用水加至全量,0.45µm 滤膜过滤。
中间体检查pH、含量等合格后,灌装到安瓿中,熔封,115℃热压灭菌30分钟,质量检查合格后包装,即得。
5.3、 工艺流程图↓↓ ↓↓↓↓↓↓ ↓↓5.4、处方、工艺筛选过程:5.4.1、处方设计依据5.4.1.1、被仿制品简介本品是参照日本三菱东京制药株式会社商品名为ラジカット注30mg[1]的上市产品进行研制的,ラジカット注30mg是依达拉奉的注射剂,规格为每支20ml中含依达拉奉30mg。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
依达拉奉注射液稳定性试验资料
按照中国药典2000年版二部附录XIX C 药物稳定性试验指导原则,对依达拉奉注射液进行了稳定性考察。
10.1、样品来源:自制,批号:20010709、20010711、20010713。
10.2、样品包装:由影响因素试验可知,本品在光照条件下无变化,60C高温有
关物质略有增加,40C无变化,因此包装仍采用无色安瓶密封。
10.3、考察项目及方法:
外观性状:目测。
pH 值:照中国药典2000年版二部附录VI H 测定。
有关物质:质量研究中有关物质测定法(高效液相色谱法)。
色谱条件与系统适用性试验以十八烷基硅烷键合硅胶为填充剂( 4.6mm2
x 150mm);以0.02mol/L的磷酸二氢钠溶液(用NaOH调pH7.0)-甲醇(70: 30)为流动相;流速为1ml/min ;检测波长为244nm。
理论塔板数按依达拉奉峰计算应不低于1500。
供试品溶液的制备精密量取本品5ml,置25ml量瓶中,并用流动相稀
释至刻度,摇匀。
对照溶液的制备取供试品溶液加流动相制成每1ml中约含依达拉奉3卩
g的溶液。
吸取对照溶液10卩l,注入液相色谱仪,调节仪器使主峰高为满量程的20~25%,再将供试品溶液10卩l进样,记录色谱图至保留时间的2倍。
计算杂质峰的峰面积总和,不得大于对照品主成分峰的峰面积( 1.0%)。
含量:同质量标准中含量测定方法(高效液相色谱法)。
10.4、加速试验:
将三批模拟上市包装的样品置于恒温箱(40土2C)内,放置六个月。
分别于第1、2、3和6个月各取样一次检测有关指标,试验结果见表1,有关物质检查的色
谱图见附图。
表1依达拉奉注射液加速试验结果
结果:经6个月的加速试验,本品的外观、pH值、有关物质及含量与试验
前相比均无明显变化,本品在加速条件下稳定。
10.5、长期试验:
将三批模拟上市包装的样品于25± 2C的条件下放置,分别于0、3、6个月各取样一次,按其考察项目进行检测,结果见表2,有关物质检查的色谱图见附图。
表2依达拉奉注射液长期留样试验结果
结果:经6个月的长期留样试验,本品的外观、pH值、有关物质及含量与试验前相比均无明显变化,本品在长期留样条件下稳定。
10.6、有效期的确定
本品采用无色安瓶包装的样品,经6个月加速试验和长期试验,各项指标均无明显变化,证明包装后的本品较稳定。
根据上述试验结果,本品的有效期暂定为2年。
长期留样试验仍在进行当中。
