中考化学(沪教版)全程复习方略精练精析:第3章第1节构成物质的基本微粒.docx
(名师整理)最新沪教版(全国)化学9年级上册第3章第1节《构成物质的基本微粒》精品课件
说明: 由分子构成的物质在物理变 化中分子本身不发生改变;由分子构 成的物质在化学变化中分子本身发生 了改变。
一、用分子、原子的知识解释: 2、纯净物与混合物有何不同?
说明:由分子构成的物质,如果 是由同种分子构成则属于纯净物; 如果是由不同种分子构成则属于 混合物
分子
1、构成物质的基本微粒 原子
离子
2、原子、离子、分子的关系
结合
物质,如
金属如铜、铁、钙等 稀有气体如氦、氖等
原子
结合 分解
金刚石、硅等 分子 聚集 物质,如氧气、二氧
化碳、水、蔗糖等
失去或得到电子 得到或失去电子
离子 结合 物质,如食盐等
★原子和离子间能相互转化。
板书设计
光读书不思考也许能使平庸之辈知识 丰富,但它决不能使他们头脑清醒。
复习提问:
构成物质的微粒有哪些特征?
1、微粒总在不停地做无规则的运 动,且温度越高,运动越快;
2、构成物质的微粒间都有一定 的间隙。
自主学习:
思考:构成物质的微粒有哪些?请列举
出具体的物质及其构成微粒。
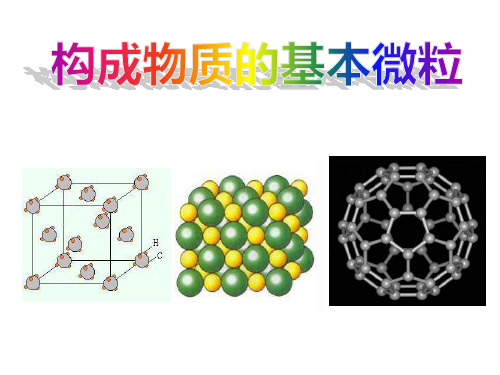
• 构成物质的基本粒子有分子、原子和离子
一、构成物质的基本微粒
例如:
——分子
氧气由氧分子构成;
5、1999年诺贝尔化学奖获得者迈德---泽 维尔开创了”飞秒”化学的新领域,使用激 光光谱观测化学反应时分子中原子的运动 成为可能.你认为该技术还不能观察到的是 ( D) A、化学反应中反应物分子的分解 B、反应中原子的运动 C、化学变化中生成物分子的形成 D、原子的内部结构
6如图中 表示1个甲分子, 表示
分子是保持物质化学性质的一种微粒
(名师整理)最新沪教版(全国)化学9年级上册第3章第1节《构成物质的基本微粒》精品课件
教材分析学情分析 教学目标 教法学法 教学过程板书设计
知识与能力 过程与方法 情感态度与价值观
( 1 )通过生活实例,知道 物质是由分子、原子等微小 粒子构成的。 ( 2 )通过实验,认识分子 的三大特点并能够解释一些 生活现象。
教材分析学情分析 教学目标 教法学法 教学过程板书设计
知识与能力 过程与方法 情感态度与价值观
3.小木条能在空气中燃烧,也能在氧 气中燃烧,但是不能在二氧化碳气 体中燃烧,从分子角度分析原因。
教材分析学情分析 教学过程 教法学法 教学过程 板书设计
课题一 分子和原子
一、分子是构成物质的一种微粒 二、分子的特点
1、分子的质量很小,体积很小 2、分子是不停运动的 3、分子间有间隔 三、分子是保持物质化学性质的最小粒子。
呢?根本原因是什么?
同种物质的分子性质相同,不同种物质的分子性质不同
教学过程——课堂小结
分子不停的运
动 体积、质量都
分子间有间隔
很小
分子
保持化 学性质 的最小 粒子
教学过程——巩固练习
1.举例说明分子间有间隔;分子在不 停的运动。
2.保持二氧化碳气体、干冰(即固态 二氧化碳)化学性质的最小粒子是 。
学习了本课后,你有哪些收获和感想? 告诉大家好吗?
分子
1、构成物质的基本微粒 原子
离子
2、原子、离子、分子的关系
结合
物质,如
金属如铜、铁、钙等 稀有气体如氦、氖等
原子
结合 分解
金刚石、硅等 分子 聚集 物质,如氧气、二氧
化碳、水、蔗糖等
失去或得到电子 得到或失去电子
离子 结合 物质,如食盐等
★原子和离子间能相互转化。
【推荐】沪教版初中化学全程复习方略精练精析:第3章第1节构成物质的基本微粒(沪教版).doc

综合检测·知能升级一、选择题1.知识梳理有助于我们对已学知识的巩固,如图是某同学学习物质结构层次后以氧气为例进行的梳理,下列选项中与a、b、c相对应的是( )A.原子、原子核、核外电子B.原子核、原子、核外电子C.原子、核外电子、原子核D.核外电子、原子核、原子2.(2012·青岛中考)下列粒子结构示意图中,表示阳离子的是( )3.(2012·佛山中考)今年1月,广西柳州龙江河发生镉污染。
但镉是人类的朋友,如制造“镍—镉”充电电池。
镉(Cd)的原子序数为48,相对原子质量是112。
下列有关说法正确的是( )A.镉元素为非金属元素B.镉原子的质量为112 gC.镉原子的核外电子数为48D.镉原子的中子数为484.下列叙述错误的是( )A.分子、原子和离子都能直接构成物质B.原子中原子核与核外电子的电量相等,电性相反,因而原子不显电性C.决定原子质量大小的主要是质子和电子D.原子如果得到或失去电子就变成离子5.(2012·桂林中考)下列事实与对应的解释相符合的是( )A.空气能被压缩——分子体积可以变小B.甘蔗甜,苦瓜苦——不同分子性质不同C.结冰的水不能流动——0℃以下,水分子不再运动D.50 mL水和50 mL酒精混合后的总体积小于100 mL——分子的质量和体积都很小6.(2012·重庆中考)下列叙述正确的是( )A.水结冰后分子停止运动B.氯化钠晶体由氯化钠分子构成C.氢原子和氧原子保持水的化学性质D.氧化汞分子在化学变化中能够再分7.(2012·泸州中考)某元素原子失去1个电子后形成的粒子与Ne有相同的核外电子数,下列说法正确的是( )A.该元素位于周期表第2周期B.该粒子为阴离子C.该粒子核电荷数为10D.该粒子为Na+8.空气中氧分子得到电子就能形成负氧离子(如O2-),O2-与O2比较,不相同的是() A.质子数 B.电子数C.含氧原子个数D.相对原子质量之和二、填空与简答题9.如图是甲烷与氧气反应的微观示意图:请通过比较、归纳,回答下列问题:(1)一个甲烷分子是由___________构成的,该化学变化中的最小粒子是___ _______________。
2013版中考化学(沪教版)全程复习方略配套课件:第3章 物质构成的

铝中,钠中含有的原子个数最多,铝中含有的原子个数最少。
离子 带电 的微粒。 1.定义:_____ 2.分类
失 去电子
正电荷
Mg2+
NH4+ S2CO32-
得 到电子
负电荷
3.离子符号表示的意义 2Mg2+ 一个镁离子带2个单位正电荷 表示__________________________
2个镁离子 表示__________
【思考感悟】
1.离子一定带有电荷,但由离子构成的物质为什么呈电中性?
提示:由离子构成的物质中,阳离子所带的正电荷数与阴离子 所带的负电荷数相等、电性相反,故离子构成的物质不显电性。 2.最外层电子数为8的微粒一定是稀有气体元素的原子吗? 提示:不一定。稀有气体元素的原子最外层电子数一般是 8个
(He是2个),但金属元素的阳离子和非金属元素的阴离子的最
第1节 构成物质的基本微粒
微粒的性质 1.物质都是由肉眼看不见的微粒构成的,构成物质的基本微粒
分子 、_____ 原子 和_____ 离子 。 有_____
2.微粒的性质 质量 都很小; 体积 和_____ (1)其_____
越快 。 运动 的,且温度越高,微粒的运动速率_____ (2)微粒是不断_____
外层电子数一般也是8个。
【甄别·判断】
1.氧气和液氧的化学性质不同。( × )
提示:由分子构成的物质,分子保持该物质的化学性质。氧气 和液氧都由氧分子构成,故它们的化学性质相同。
2.原子都是由质子、中子和电子构成的。( × )
提示:有的原子如通常所说的氢原子中不含有中子。
3.原子得失电子变成离子时,元素的化学性质发生了变化。 ( √) 提示:元素的化学性质与原子的最外层电子数关系密切,原子
(名师整理)最新沪教版(全国)化学9年级上册第3章第1节《构成物质的基本微粒》精品课件
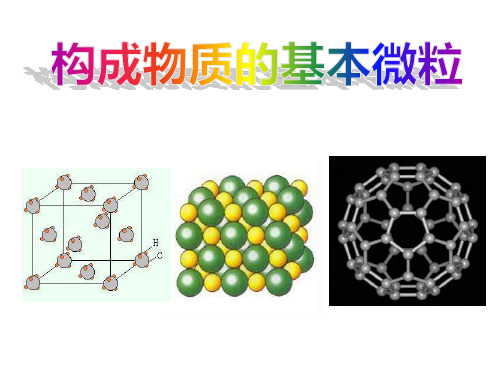
在化学变化中可以 在化学反应前后不
不同点 再分,变成新的分 可再分,没有变成
子
其他原子。
相互关 分子可以分裂为原子,原子可以相互结 系 合形成分子
化学变化的实质:
分子分裂成原子,原子重新组合 成新的分子。
分子和原子的本质区别:
化学变化中,分子可分,而 原子不可再分.
用分子或原子的观点解释物质的分类
D、以上都不是
3、下列说法中正确的是( B )
A、水电解生成氢气和氧气,说明水中含有氢分子和氧分
子
B、同种物质的分子化学性质相同,不同种物质的分子化
学性质不同
C、物质都是由分子构成的,分子又是由原子构成
D、同种原子可以构成分子,而不同种原子不能构成分子
中考链接
1.用“分子”的观点解答下列现象,不正确的是( A)
只是分子间的间隔 变大.
化学变化
水的电解中水分子分成了氢原子 和氧原子,每2个氢原子结合成1个 氢分子,许多氢分子聚集氢气,每2 个氧原子结合成1个氧分子,许多氧 分子聚集成氧气。
HH HH
O
HH HH
OO
水分子
通电
+
氧分子
氢分子
讨论
氢气在氯气中
燃烧生成氯化
氢。试分析在
氢气与氯气反
应的化学变化
中,分子和原
大气
大气
大气
A.水分子本身变大
大气
B.水分子之间的间隔变大
大气
C.水分子的数目增多
D.水分子受热都跑到容器的一端
5.分子和原子的主要区别是( C )
A、分子大、原子小 B、分子间有间隔,原子间没有间隔 C、在化学变化中,分子可再分,原子不可再分 D、分子可直接构成物质,而原子则先构成分子后 再构成物质。
沪教版(2012年秋)九年级化学第3章第1节 构成物质的基本微粒教案(第2课时:分子 原子)

第一节构成物质的基本微粒第2课时:分子原子卢荣毅【回忆】我们都知道,世界是由物质组成的。
而物质又是由许许多多的微粒所构成的,通过上节课的学习你已经知道这些微粒具有哪些基本性质?【回答】1. 构成物质的微粒都是体积、质量极其微小的。
2. 微粒是在不断运动的。
3. 微粒之间存在一定的空隙。
【引入】既然物质都是由微粒构成的,那么这些微粒又都是什么样的呢?这些微粒是否还能再分呢?这节课就让我们带这些问题来探索充满奥秘的微观世界。
【出示】(教材第64页图3-5)干冰、铜、食盐、金刚石图片及二氧化碳分子、铜、氯化钠、金刚石球棍模型或比例模型。
【启发思考】观察上述这些图示,比较一下,有何启迪?构成物质的微粒不同(大小、组合);微粒间的结构不同(间隙、堆积方式)【讲解】不同的物质,其构成的微粒不同。
科学家经过长期研究证实,构成物质的微粒有原子、分子和离子。
(阅读课本)【引入】本节课我们就先来认识分子、原子这两种微粒。
【问题】根据学过的微粒的基本性质,你能说出分子具有哪些基本性质吗?【回答】分子很小(阅读教材66页第1-2段。
质量小,体积小),分子是在不停运动着的,分子之间有空隙。
【设疑】(教材第65页联想与启示)电解水可以得到氧气和氢气。
氧气、氢气和水各有自己的不同性质。
为什么氧气、氢气不再具有水的性质呢?【回答】(阅读教材65页第一段)不同的物质具有不同的性质,这是由于构成的微粒不同。
水发生电解时水分解得到氧气和氢气,而水是由大量的水分子聚集而成的(教材65页图3-7、8),氢气是由大量的氢分子聚集而成的(教材65页图3-6、8),换句话说,大量分子聚集成物质。
既然,构成它们的微粒---分子已经不同,其性质也就不同,所以氧气、氢气不再具有水的性质了。
【归纳】(因此我们也可明白)分子是保持其化学性质的一种微粒(由分子构成的物质,分子是保持其化学性质的最小微粒。
)【小结】二、分子1.分子是构成物质的一种微粒;2.分子的性质:体积和质量都很小;在不停的运动;分子之间有空隙。
沪教版九年级化学上册第3章 物质构成的奥秘 知识点汇总
第3章物质构成的奥秘第1节构成物质的基本微粒第1课时微粒的性质一、微粒的性质1.微粒的质量和体积都很小例如:1个水微粒的质量大约是3×10-26kg。
用胶头滴管滴下的一滴水中大约含有1.7×1021个水微粒。
2.微粒在不断地运动,且温度越高运动速率越快探究微粒运动的实验(1)现象:试管中酚酞溶液变红;A烧杯中的酚酞溶液变红,B烧杯中酚酞溶液不变色。
(2)解释:试管中酚酞溶液变红证明酚酞溶液遇浓氨水变红;A烧杯中的酚酞溶液变红证明C烧杯中浓氨水中的氨气微粒运动到了A烧杯中,所以A中的溶液变红,由于大烧杯的遮挡作用,氨气微粒不能运动到B烧杯中,所以B中的溶液不变色。
其他示例:酒香不怕巷子深、湿衣服晾干、打开酒精试剂瓶瓶塞能闻到酒精气味、闻到花园里的花香……都能证明微粒在不断地运动着。
3.微粒之间有间隔实验一:水与酒精的混合实验(提示:水中含有红墨水)现象:酒精与水混合后体积小于二者体积之和。
结论:实验证明微粒之间有间隔。
实验二:水和空气的压缩实验(1)水和空气都可以被压缩,因为构成物质的微粒之间有间隔。
(2)比较是一种很好的实验探究方法,通过上图对比发现,空气要比水更易被压缩,说明:气体微粒间的间隔大于液体微粒间的间隔。
二、构成物质的微粒构成物质的微粒有:分子、原子、离子。
1.由分子构成的物质:如氧气、水、酒精等。
2.由原子直接构成的物质:如铁、金刚石等。
3.由离子直接构成的物质:如氯化钠由氯离子和钠离子构成。
第2课时分子原子一、分子1.分子的基本性质(1)分子的质量和体积均很小、分子在不停地运动、分子之间有间隔。
(2)同种物质的分子化学性质相同,不同种物质的分子化学性质不同。
如:氧气和液氧均能支持燃烧是因为二者均是由氧分子构成的。
(3)由分子构成的物质,分子是保持该物质化学性质的最小微粒。
(4)分子由原子构成,分子可以分成原子。
2.用分子的观点解释物质的变化及分类(1)区别物理变化和化学变化对于由分子构成的物质,发生物理变化时,分子本身不变,分子间间隔可能变化;发生化学变化时,分子本身发生变化,变成了其他物质的分子。
沪教版九年级全册(全国版)化学 第三章 第一节-构成物质的基本微粒(共20张PPT)
汤姆生
卢瑟福
二、原子
二、原子
原子的种类
氢 碳 氧 钠 铁
原 质子数
1 6 8 11
26
子核 中子数
6 8 12 30
核外电子数
1 6 8 11 26
质子 原子 原子核 中子
核外电子
原子中:质子数=核
分子的间隔性
分子的间隔性
1、书籍是朋友,虽然没有热情,但是非常忠实。2022年2月14日星期一上午2时17分40秒02:17:4022.2.14 2、科学的灵感,决不是坐等可以等来的。如果说,科学上的发现有什么偶然的机遇的话,那么这种‘偶然的机遇’只能给那些学有素养的人,
分子的微观性
以空气为例,说明混合物没有固定的化学性质。
• 空气是由多种物质组成的,不同的物质是由不同 的微粒构成的(氮气是由氮分子构成的,氧气是 由氧分子构成的……),每种分子保持自身的化 学性质。因此,混合物没有固定的化学性质。
分子可以再分吗?
分子可以再分吗? ➢分子是由原子结合而成的
交流与讨论
➢ 在水电解过程中,发生变化的是什么?不变的又是什么? ➢ 物理变化与化学变化的本质区别是什么?
➢ 化学变化的实质 分子1→原子→分子2 →新物质
分子是由原子构成的 原子是构成物质的一
种微粒 金属和稀有气体都是
由原子构成的
放大三百万倍的硅原子
原子很小 原子还可以再分吗?
道尔顿
谢谢观赏
You made my day!
我们,还在路上……
给那些善于独立思考的人,给那些具有锲而不舍的人。2022年2月上午2时17分22.2.1402:17February 14, 2022 3、书籍—通过心灵观察世界的窗口.住宅里没有书,犹如房间里没有窗户。2022年2月14日星期一2时17分40秒02:17:4014 February 2022 4、享受阅读快乐,提高生活质量。上午2时17分40秒上午2时17分02:17:4022.2.14
沪教课标版初中化学九年级全册第三章第1节 构成物质的基本微粒(共17张PPT)
水
冰
花
银
糖
第一节构成物质的基本微粒
铝
硫酸铜晶体
钻石
假如你能看到这些物质里面的样子,你猜想这 些物质是由什么构成的?是怎样构成的?
你能将试剂瓶中的高 锰酸钾小颗粒继续分吗
盛有高锰酸 钾的试剂瓶
试剂瓶中的 高锰酸钾
高锰酸钾颗粒是 否可以再分?
用研钵研碎 高锰酸钾
已呈粉末状的 细小高锰酸钾 颗粒是否还可 以再分?
•9、要学生做的事,教职员躬亲共做;要学生学的知识,教职员躬亲共学;要学生守的规则,教职员躬亲共守。2021/8/272021/8/27Friday, August 27, 2021 •10、阅读一切好书如同和过去最杰出的人谈话。2021/8/272021/8/272021/8/278/27/2021 9:06:51 PM •11、只有让学生不把全部时间都用在学习上,而留下许多自由支配的时间,他才能顺利地学习……(这)是教育过程的逻辑。2021/8/272021/8/272021/8/27Aug-2127-Aug-21 •12、要记住,你不仅是教课的教师,也是学生的教育者,生活的导师和道德的引路人。2021/8/272021/8/272021/8/27Friday, August 27, 2021
物质三种状态的分子间隔模拟动画
Hale Waihona Puke 固态液态气态一般情况
固体分子 < 液体分子 < 气体分子
间的间隔
间的间隔
间的间隔
温度升高,分子间间隔变大。(热胀冷缩) 压强增大,分子间间隔变小。
三、微粒之间存在一定的空隙
1、构成物质的微粒间都有一定的空隙。 2、不同物质微粒间的空隙大小不同。 3、同种物质时,固体和液体微粒间的空隙较小,气体微
(名师整理)最新沪教版(全国)化学9年级上册第3章第1节《构成物质的基本微粒》精品课件
三、原子
1、由原子直接构成的物质 ①金属(铜、铁) ②稀有气体(氦气、氩气)
③部分固态非金属 (如 金刚石、石墨、硅 )
原子性质
❖1. 原子很小 ❖2. 原子不断地运动 ❖3. 原子间有间隙
原子操纵技术
通过移动硅 原子构成的
文字
2、仔细观察几种分子模型,你对水有新认识吗? 【自学成果】1、下列分子模型可以表示水分子的是(C )
A
B
C
D
2、仔细观察几种分子模型,你对水有新认识吗?
一些分子模型
二氧化碳分子 (CO2)
【检测反馈】1.有关水(化学式H2O)的认识正 确的是( D)
A、水是由氢原子和氧原子构成
B、水是由2个氢原子和一个氧原子构成 C、一个水分子是一个氢分子和一个氧原子 构成
D、一个水分子共有3个原子
2. 2015年10月11日 - 屠呦呦研究员凭借青蒿素
4、气体易压缩,固体、液体难压缩,说明气体微粒间
,固空体隙、较液大体微粒间 ; 空隙较小
5、温度计可以测量温度,是因为微粒间 空隙随着温度 ,而升高 ,随增着大温度 ,而 降。低 减小
熟能生巧
1.将浓氨水和酚酞试液倒扣在一起,该实验不能说明(B) A、浓氨水能使酚酞试液变红 B、氨分子运动速率较快,酚酞试液中的微粒不运动 C、相同条件下,不同微粒运动速率不同 D、浓氨水具有较强的挥发性
二、分子 意大利化学家 阿佛加德罗 提出了分子学说。
分子是构成物质的一种微粒
氧气、氢气、水、二氧化碳等大多数物 质是由分子构成,而且它们的分子不同, 导致性质不同。
Hale Waihona Puke • 每个水分子约为3×10-26kg,计算一下一滴水 (1/20g)中含有水分子的个数为 多少?
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
温馨提示:此套题为Word版,请按住Ctrl,滑动鼠标滚轴,调节合适的观看比例,答案解析附后。
综合检测·知能升级一、选择题1.知识梳理有助于我们对已学知识的巩固,如图是某同学学习物质结构层次后以氧气为例进行的梳理,下列选项中与a、b、c相对应的是( )A.原子、原子核、核外电子B.原子核、原子、核外电子C.原子、核外电子、原子核D.核外电子、原子核、原子2.(2012·青岛中考)下列粒子结构示意图中,表示阳离子的是( )3.(2012·佛山中考)今年1月,广西柳州龙江河发生镉污染。
但镉是人类的朋友,如制造“镍—镉”充电电池。
镉(Cd)的原子序数为48,相对原子质量是112。
下列有关说法正确的是( )A.镉元素为非金属元素B.镉原子的质量为112 gC.镉原子的核外电子数为48D.镉原子的中子数为484.下列叙述错误的是( )A.分子、原子和离子都能直接构成物质B.原子中原子核与核外电子的电量相等,电性相反,因而原子不显电性C.决定原子质量大小的主要是质子和电子D.原子如果得到或失去电子就变成离子5.(2012·桂林中考)下列事实与对应的解释相符合的是( )A.空气能被压缩——分子体积可以变小B.甘蔗甜,苦瓜苦——不同分子性质不同C.结冰的水不能流动——0℃以下,水分子不再运动D.50 mL水和50 mL酒精混合后的总体积小于100 mL——分子的质量和体积都很小6.(2012·重庆中考)下列叙述正确的是( )A.水结冰后分子停止运动B.氯化钠晶体由氯化钠分子构成C.氢原子和氧原子保持水的化学性质D.氧化汞分子在化学变化中能够再分7.(2012·泸州中考)某元素原子失去1个电子后形成的粒子与Ne有相同的核外电子数,下列说法正确的是( )A.该元素位于周期表第2周期B.该粒子为阴离子C.该粒子核电荷数为10D.该粒子为Na+8.空气中氧分子得到电子就能形成负氧离子(如O2-),O2-与O2比较,不相同的是( ) A.质子数 B.电子数C.含氧原子个数D.相对原子质量之和二、填空与简答题9.如图是甲烷与氧气反应的微观示意图:请通过比较、归纳,回答下列问题:(1)一个甲烷分子是由___________构成的,该化学变化中的最小粒子是__________________。
(2)氧分子、二氧化碳分子、水分子的相同点是________________________。
(3)根据上述示意图,请从微观角度描述你获得的关于化学变化的一个信息______________________________________________________________。
10.如图是锂原子的构成示意图,根据图示信息回答:(1)锂元素的原子序数为___________,元素符号为_____________。
(2)锂原子的结构示意图为__________(填字母)。
(3)锂元素与氧元素形成的化合物的化学式为__________。
(4)下列对原子构成的理解错误的是__________ (填字母)。
A.原子整体不显电性B.原子核比原子小得多C.原子都是由质子和中子构成的D.原子质量主要集中在原子核上11.填写下图中的空白:12.如图是物质与其构成粒子之间的关系图。
回答下列问题:(1)金属铁是由________(填“原子”“分子”或“离子”,下同)构成的,硫酸铜是由________构成的。
(2)原子得到或失去电子后形成离子。
某粒子的结构示意图为①当a=_______时,该粒子是原子。
②当a=8时,该粒子是_______(填“原子”“阳离子”或“阴离子”),其符号为___________。
(3)据报道,2011年12月15日,位于山东省青岛市的一市民的厨房内惊现水银,检测显示,该住户厨房内空气中汞的含量为正常值的1 000多倍。
试从原子的角度解释这一现象产生的原因:_______________________。
三、实验与探究题13.某兴趣小组做如下实验来探究分子的运动,请回答实验中的有关问题。
(1)实验Ⅰ:在盛有少量蒸馏水的小烧杯中滴入2滴~3滴酚酞溶液,再向其中滴加浓氨水。
得出的结论有____________________________________________ ___________________________________________________________________。
(2)实验Ⅱ(如图所示):烧杯B中的现象是__________________;产生这一现象的原因是___________________________________________________________。
(3)若实验室只提供氢氧化钠稀溶液、浓盐酸、酚酞溶液,请利用实验Ⅱ的实验原理,设计实验,证明浓盐酸具有挥发性从而说明分子在不断运动。
①请用图示表示实验过程:②描述实验现象_____________________________________________________。
14.人类对原子结构的认识是逐渐深入的,下图所示是不同时期科学家提出的原子结构模型:(1)1803年,英国科学家道尔顿提出了原子论:他认为物质都是由原子直接构成的;原子是一个实心球体,不可再分割;同一类原子性质相同等。
道尔顿的原子结构模型的缺陷是_________________________________________________。
(2)1897年汤姆生发现电子并提出类似“西瓜”的原子模型,认为电子就像“西瓜子”一样镶嵌在带正电荷的“西瓜瓤”中,汤姆生原子结构模型的缺陷是__ __________________________。
(3)1911年英国科学家卢瑟福做了一个实验:用一束质量比电子大很多的带正电的高速运动的α粒子轰击金箔,结果是大多数α粒子能穿过金箔且不改变原来的前进方向,但也有一小部分改变了原来的方向,还有极少数的α粒子被反弹了回来。
据此他提出了带核的原子结构模型:原子是由原子核和核外电子构成。
根据卢瑟福的实验所产生的现象,不能够获得的结论是__________。
A.原子核体积很小B.原子核质量较大C.原子核带有正电D.核外电子带有负电(4)通过人类认识原子结构的历史,你对科学的发展有什么感想?(回答一种感想即可)答案解析1.【解析】选A。
本题考查原子的内部结构。
氧气由氧分子构成,分子由原子构成,原子由原子核和核外电子构成,原子核由质子和中子构成。
故选A。
2.【解析】选C。
阳离子是由原子失去最外层上的电子形成,故阳离子中质子数多于电子数。
A和B中质子数=电子数;C中质子数多于电子数;D中质子数少于电子数。
故选C。
3.【解析】选C。
本题考查原子的构成。
明确构成原子的粒子及这些粒子间的关系是解题关键。
镉元素带“钅”字旁,属于金属元素;相对原子质量不是原子的实际质量,与原子的实际质量不相等;在原子中,原子序数=质子数=核外电子数;镉原子的中子数=112-48=64。
4.【解析】选C。
决定原子质量大小的主要是原子核或者说决定原子质量大小的主要是质子和中子,电子质量太小,一个电子的质量仅为一个质子质量的1。
1 836 5.【解析】选B。
空气能被压缩,是由于分子间的间隔变小,而不是分子体积变小,故A错误;甘蔗甜,苦瓜苦,是由于构成甘蔗、苦瓜的分子不同,故性质不同,故B正确;分子总是在不断地运动,结冰的水中水分子运动的速度变慢了,而不是不再运动,故C错误;50 mL水和50 mL酒精混合后的总体积小于100 mL,是因为分子之间有间隔,一部分水分子和酒精分子会互相占据对方分子之间的间隔,故D错误。
6.【解析】选D。
三种状态的物质中,分子都在不停地运动;氯化钠是由离子构成的,不含分子;水由水分子构成,水分子保持水的化学性质;分子在化学变化中可分为原子。
故选D。
7.【解析】选D。
本题考查物质的结构及原子与离子的区别。
由于该原子失去1个电子后形成的粒子与Ne有相同的核外电子数,说明该原子的电子数和核电荷数均为11,即为钠原子;该原子的核外有三个电子层,说明所属元素位于第3周期;原子失去一个电子后形成带一个单位正电荷的阳离子,离子符号为Na+。
8.【解析】选B。
氧分子得到电子形成负氧离子的过程中,氧原子个数及氧原子中的质子数皆没有变化,故A、C、D中的内容,二者仍相同,只是电子数有所不同,故选B。
9.【解析】(1)根据物质的分子模型可知,一个甲烷分子由1个碳原子和4个氢原子构成;甲烷分子和氧分子中的原子是化学变化中的最小粒子。
(2)氧分子由氧原子构成,二氧化碳分子由碳原子和氧原子构成,水分子由氢原子和氧原子构成,三种分子的构成中都含有氧原子。
(3)由微观图中分子构成及分子个数可得,反应前后原子种类、个数不变,而分子的种类改变,变化前后分子可分而原子不可分。
答案:(1)1个碳原子和4个氢原子氧原子、氢原子和碳原子 (2)都含有氧原子(3)反应前后原子种类、个数不变(或在化学变化中分子可以分成原子,原子也可以结合成新分子,其他合理答案均可)10.【解析】原子序数等于核内质子数,由锂原子的构成示意图能判断核内有3个质子,所以原子序数为3,核外电子数等于质子数为3个,第一层2个,第二层1个电子;原子并不都是由质子和中子构成的,如普通氢原子只含质子不含中子。
答案:(1)3 Li (2)D (3)Li2O (4)C11.【解析】本题考查有关元素的知识,由于镁元素的核电荷数为12,则其核外有12个电子,因而其最外层有2个电子,在化学反应中易失去2个电子,带2个单位正电荷,化合价常显+2价。
答案:(1)Mg (2)2 (3)失 (4)Mg2+(5)MgO或MgCl2等12.【解析】(1)金属是由原子构成的,CuSO4是由Cu2+和SO42-构成的;(2)在原子中,质子数等于核外电子数,a=2+8=10;当a=8时,质子数比电子数少2个,该粒子带负电,属于阴离子,符号为O2-;(3)因为汞是由汞原子构成的,原子是在不停运动着的,所以当室内有汞存在时,汞原子就会不断运动到空气中。
答案:(1)原子离子 (2)①10 ②阴离子 O2- (3)原子是不断运动的【拓展归纳】原子和离子的关系1.区别(1)电性上:原子不显电性,而离子带有电荷。
(2)结构上:①原子中质子数等于电子数,而离子中质子数不等于电子数。
②大多数原子不具有相对稳定结构,而离子一般具有相对稳定结构。
2.联系失电子得电子阳离子原子阴离子得电子失电子13.【解析】(1)该实验以对比的形式,说明水不能使酚酞溶液变红色,而氨水能,证明使酚酞溶液变红的物质是氨水不是水。
(2)通过不接触的两种药品仍能出现酚酞变红的实验,证明了分子是不断运动的,NH3分子从A烧杯运动到了B烧杯。
