第7章 多环芳烃和非苯芳烃
合集下载
徐寿昌主编《有机化学》(第二版)-课后1-13章习题答案
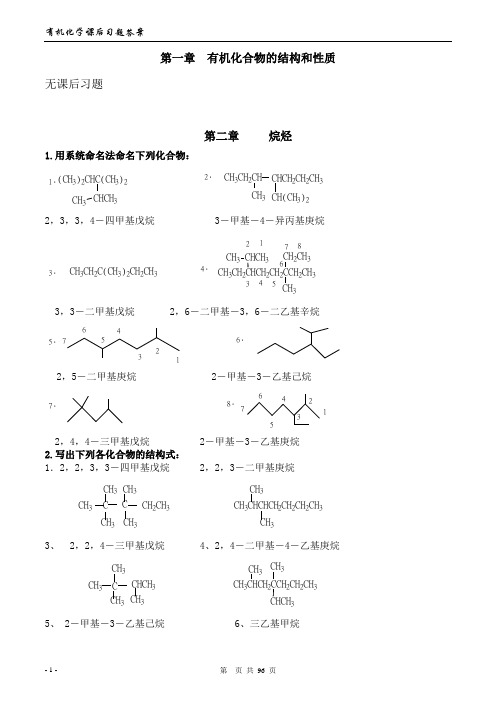
(6)聚丙烯腈
(7)环氧氯丙烷
11.某烯烃催化加氢得2-甲基丁烷,加氯化氢可得2-甲基-2-氯丁烷,如果经臭氧化并在锌纷存在下水解只得丙酮和乙醛,写出给烯烃的结构式以及各步反应式:
解:由题意得:
则物质A为:
12.某化合物分子式为C8H16,它可以使溴水褪色,也可以溶于浓硫酸,经臭氧化,锌纷存在下水解只得一种产物丁酮,写出该烯烃可能的结构式。
顺,顺-2-4-庚二烯
(Z,Z)-2-4-庚二烯
顺,反-2-4-庚二烯
(Z,E)-2-4-庚二烯
反,顺-2-4-庚二烯
(E,Z)-2-4-庚二烯
反,反-2-4-庚二烯
(E,E)-2-4-庚二烯
6.3-甲基-2-戊烯分别在下列条件下发生反应,写出各反应式的主要产物:
7.乙烯、丙烯、异丁烯在酸催化下与水加成生成的活性中间体和稳定性及分别为:
14.解:低温反应,为动力学控制反应,由中间体的稳定性决定反应主要产物,为1,2-加成为主。高温时反应为热力学控制反应,由产物的稳定性决定主要产物,1,4-加成产物比1,2-加成稳定。
15.解:10mg样品为0.125mmol,8.40mL氢气为0.375mmole。可见化合物分子中有三个双键或一个双键,一个叁键。但是根据臭氧化反应产物,确定化合物分子式为:CH2=CHCH=CHCH=CH2;分子式:C6H8;1,3,5-己三烯。
3-己烯
有顺反异构
2-甲基-1-戊烯
有顺反异构
2-甲基-2-戊烯Fra bibliotek有顺反异构4-甲基-2-戊烯
有顺反异构
4-甲基-1-戊烯
3-甲基-1-戊烯
有顺反异构
3-甲基-2-戊烯
有顺反异构
2,3-二甲基-1-丁烯
(7)环氧氯丙烷
11.某烯烃催化加氢得2-甲基丁烷,加氯化氢可得2-甲基-2-氯丁烷,如果经臭氧化并在锌纷存在下水解只得丙酮和乙醛,写出给烯烃的结构式以及各步反应式:
解:由题意得:
则物质A为:
12.某化合物分子式为C8H16,它可以使溴水褪色,也可以溶于浓硫酸,经臭氧化,锌纷存在下水解只得一种产物丁酮,写出该烯烃可能的结构式。
顺,顺-2-4-庚二烯
(Z,Z)-2-4-庚二烯
顺,反-2-4-庚二烯
(Z,E)-2-4-庚二烯
反,顺-2-4-庚二烯
(E,Z)-2-4-庚二烯
反,反-2-4-庚二烯
(E,E)-2-4-庚二烯
6.3-甲基-2-戊烯分别在下列条件下发生反应,写出各反应式的主要产物:
7.乙烯、丙烯、异丁烯在酸催化下与水加成生成的活性中间体和稳定性及分别为:
14.解:低温反应,为动力学控制反应,由中间体的稳定性决定反应主要产物,为1,2-加成为主。高温时反应为热力学控制反应,由产物的稳定性决定主要产物,1,4-加成产物比1,2-加成稳定。
15.解:10mg样品为0.125mmol,8.40mL氢气为0.375mmole。可见化合物分子中有三个双键或一个双键,一个叁键。但是根据臭氧化反应产物,确定化合物分子式为:CH2=CHCH=CHCH=CH2;分子式:C6H8;1,3,5-己三烯。
3-己烯
有顺反异构
2-甲基-1-戊烯
有顺反异构
2-甲基-2-戊烯Fra bibliotek有顺反异构4-甲基-2-戊烯
有顺反异构
4-甲基-1-戊烯
3-甲基-1-戊烯
有顺反异构
3-甲基-2-戊烯
有顺反异构
2,3-二甲基-1-丁烯
第七章芳香烃

第七章 芳香烃
目的和要求:
了解和掌握:1.苯的结构,休克尔规律,芳香性 ;2.苯衍生物的异构命名和物性;3.苯的亲电取 代反应和机理;4.苯环上亲电取代反应的定位规 律和解释;5.烷基苯侧链的反应;6.手性芳烃和 多环芳烃。
教学重点:
一、苯的结构 1 凯库勒(Kekule)结构式,2 分子轨道理论,3 共振论,
二、化学性质
1 亲电取代反应 :(1) 反应历程,(2) 卤代反应,(3) 硝化反应,(4) 磺 化反应 (5) 傅瑞德尔—克拉夫茨(Friedel—Crafts)反应
2 加成反应,3 链氧化
氧化反应,4
环上侧链的反应:(1) 侧链卤化,(2) 侧
三、苯环亲电取代的定位规律 1 取代基的分类,2 定位效应的理论解释,3 取代定位规律的应用
根据文献中的计算,即使略去
键的超共扼作用不计,叔
丁基总的共扼效应指数(一0.1186)还是要比甲基总的共扼效应指 数(一0.0791)大得多。所以综合考虑烷基的诱导效应,超共扼效 应(包括 )和同共扼效应,叔丁基对苯环的致活作用
应该比甲基强。它们的核磁共振13c值也证实了这一点,
不论是邻对位还是间位,13c化学位移值叔丁苯都比甲苯小,这
Br
虽然凯库勒假设存在共振结构,但实验证明不存在。
3,氢化热实验
+
H2
-119.6KJ/mol
+
2 H2
-2*119.6KJ /mol
+
2 H2
-3*119.6KJ/mol
实验测的苯的氢化热为 -208.4KJ/mol,所以苯不 是简单的单双键相间的1,3,5-环已三烯。
4,分子轨道理论计算苯的共振能
表明叔丁基增加苯环碳原子的电子云密度比甲基增加苯环碳原 子的电子云密度大。
目的和要求:
了解和掌握:1.苯的结构,休克尔规律,芳香性 ;2.苯衍生物的异构命名和物性;3.苯的亲电取 代反应和机理;4.苯环上亲电取代反应的定位规 律和解释;5.烷基苯侧链的反应;6.手性芳烃和 多环芳烃。
教学重点:
一、苯的结构 1 凯库勒(Kekule)结构式,2 分子轨道理论,3 共振论,
二、化学性质
1 亲电取代反应 :(1) 反应历程,(2) 卤代反应,(3) 硝化反应,(4) 磺 化反应 (5) 傅瑞德尔—克拉夫茨(Friedel—Crafts)反应
2 加成反应,3 链氧化
氧化反应,4
环上侧链的反应:(1) 侧链卤化,(2) 侧
三、苯环亲电取代的定位规律 1 取代基的分类,2 定位效应的理论解释,3 取代定位规律的应用
根据文献中的计算,即使略去
键的超共扼作用不计,叔
丁基总的共扼效应指数(一0.1186)还是要比甲基总的共扼效应指 数(一0.0791)大得多。所以综合考虑烷基的诱导效应,超共扼效 应(包括 )和同共扼效应,叔丁基对苯环的致活作用
应该比甲基强。它们的核磁共振13c值也证实了这一点,
不论是邻对位还是间位,13c化学位移值叔丁苯都比甲苯小,这
Br
虽然凯库勒假设存在共振结构,但实验证明不存在。
3,氢化热实验
+
H2
-119.6KJ/mol
+
2 H2
-2*119.6KJ /mol
+
2 H2
-3*119.6KJ/mol
实验测的苯的氢化热为 -208.4KJ/mol,所以苯不 是简单的单双键相间的1,3,5-环已三烯。
4,分子轨道理论计算苯的共振能
表明叔丁基增加苯环碳原子的电子云密度比甲基增加苯环碳原 子的电子云密度大。
第七章 芳 烃

上一内容
下一内容
回主目录
返回
苯中的P轨道
P轨道的重叠
2、 分子轨道理论解释 、 分子轨道理论认为, 分子中六个P轨道线 分子轨道理论认为 , 分子中六个 轨道线 形组合成六个π分子轨道 , 其中三个成键规定, 形组合成六个 分子轨道, 其中三个成键规定 , 分子轨道 三个反键轨道。 在基态时, 苯分子的六个π电 三个反键轨道 。 在基态时 , 苯分子的六个 电 子成对填入三个成键轨道, 子成对填入三个成键轨道,其能量比原子轨道 所以苯分子稳定, 低,所以苯分子稳定,体系能量 较低 。
CH3 CH CH3 NO2 Cl
异丙基苯
叔丁基苯
硝基苯
氯苯
上一内容
下一内容
回主目录
返回
当苯环上连有 -COOH、 -SO3H、-NH2、-OH、-CHO、 、 、 、 、 较复杂时, -CH=CH2或R较复杂时,则把苯环作为取代基。例如: 较复杂时 则把苯环作为取代基。例如:
COOH SO3H CHO OH NH2
上一内容 下一内容 回主目录 返回
反键轨道 E 原子轨道 成键 轨道 苯的分子轨道能级示意图
上一内容
下一内容
回主目录
返回
三个节面 ψ6
ψ4
二个节面
ψ5
E
ψ2 一个节面 无节面 ψ1 苯 的 π电 子 分 子 轨 道 重 叠 情 况 ψ3
苯分子的大π键是三个成键轨道叠加的结果,由于 电子都是离域的 电子都是离域的, 苯分子的大 键是三个成键轨道叠加的结果,由于π电子都是离域的, 键是三个成键轨道叠加的结果 所以碳碳键长完全相同。 所以碳碳键长完全相同。
一、 苯的凯库勒式 1865年凯库勒从苯的分子式 6H6出发 根据苯 年凯库勒从苯的分子式C 出发,根据苯 年凯库勒从苯的分子式 的一元取代物只有一种( 的一元取代物只有一种(说明六个氢原子是等同 的事实),提出了苯的环状构造式 ),提出了苯的环状构造式。 的事实),提出了苯的环状构造式。
第7章 芳烃-1
HF
HO
0°C 62%
BF3 60°C
56%
注意事项:
⑴ 当苯环上具有吸电子基(二类定位基)时不能进行付克反应。如: -+NR3 -NO2、 -CF3 -CCl3 -CN、 -SO3H、 -CHO、 -COR、 -COOH、-COOR …….
O -CCH3 +CH CH Cl 3 2
AlCl3
⑵ 乙烯基与芳基卤不能作为烃基化试剂。
-CH2CH2CH3
O O O AlCl3
COOH
COOH
=
O
PPA
Zn-Hg HCl
HO CH3
S(或Pd)
(1)CH3MgX (2)H2O CH3 1.-H2O
PPA:多聚磷酸 Pd~C:低温催化加氢,高温催化脱氢。
2.Pd/C, -H2
=
O
Zn-Hg HCl
氯甲基化
3
无水ZnCl2 + (HCHO)3 + 3 HCl △
连苯四甲酸
催化氧化:这是工业上合成顺丁烯二酸酐的方法
O
+ 9O2
V2O5 385°~400°C
O O
顺丁烯二酸酐 (马来酸酐)
43
2. 侧链卤代.
CH3 Cl2 -CH2Cl 自由基取代 CH3 亲电取代 Cl
CH3 Cl Fe
-CH2CH3
Br2光照 或NBS
-CHCH3 Br
Cl
Cl , PCl5 CH3 2 h ,△ υ
卤代烷的活性: RI > RBr > RCl
3°> 2°> 1° > CH3X
常用烷基化试剂:R—X RCH=CH2
AlCl3 FeCl3 ZnCl2 SnCl4 AlCl3 H2SO4 H3PO4 HF
第七章芳香烃资料.

§7.1 芳香族化合物的分类
芳烃
单环 芳烃
分子中含一个苯环
联苯 苯环各以环上 一个碳原子直 接相连。
CH3
联苯 mp.70.5
多环 芳烃
多苯代 脂肪烃
CH2
二苯甲烷 mp.27
芴 CmHp2.116
苯环共用相 稠环芳烃 邻两个以上
碳原子稠合 而成。
萘 mp.80.2
蒽 mp.218
单环芳烃
§7.2 苯的结构
道
E
节面
反键轨道
节面
成键轨道
苯的分子轨道模型
▪ 由于苯的大体系结构是封闭成环的,所以其电子 具有完全的离域性,分子内能进一步降低,因此具 有特殊的稳定性,即所谓的“芳香性”。
§7.3 单环芳烃的异构现象及命名
单环芳烃可看作是苯环上的氢原子被烃基取 代所得的衍生物,分为一烃基苯、二烃基苯、三烃 基苯等等。
一、一烃基苯
例:
只有一种,而无异 构体。命名时,以 苯环作母体,烃基 作取代基,称为某 烃(基)苯。
CH3
甲苯 methylbenzene
Bp. 111
CH2CH3
乙苯 ethylbenzene Bp. 136.2
二、二烃基苯
二烃基苯有三种异构体, 用数字或邻、间、对 (o-, m-, p-)表示取代基位置。 例如:
CH3 CH3
CH3
CH3
1,2-二甲苯 邻-二甲苯
o-二甲苯
CH3
1,3-二甲苯 间-二甲苯
m-二甲苯
CH3
1,4-二甲苯
对-二甲苯
p-二甲苯
o– orther
m– meta
p- para
三、三烃基苯 若三个相同烃基的三烃基苯也有三种异构体,例如:
《有机化学》第7章 芳香烃

若把反应步骤颠倒一下,先氧化,后硝化,那么所得的产物是单一的间硝基苯甲酸。
所以如果希望获得所需的产物,使用正确的反应步骤是重要的。
2023/6/13
18
第三节 稠环芳烃
一、 萘
萘,分子式C10H8,光亮的片状结构,熔点80.2 ℃,沸点218 ℃,有特殊气味,易 升华,不溶于水,易溶于乙醇、乙醚、苯等有机溶剂。其化学性质与苯相似。
2023/6/13
11
⑷ 傅-克(Friedel-Crafts)反应 ① 烷基化反应 凡在有机化合物分子中引入烷基的反应,称为烷基化反应。反
应中提供烷基的试剂叫烷基化剂,它可以是卤代烷、烯烃和醇。
当烷基化剂含有三个或三个以上直链碳原子时,产物发生碳链异构。
② 酰基化反应 凡在有机化合物分子中引入酰基(
①若原有两个取代基不是同一类的,则第三个取代基进入的位置一般受邻、对 位定位基的支配,因为邻、对位基反应的速率大于间位基。
②若原有两个取代基是同一类的,则第三个取代基进入的位置主要受强的定位基 的支配。
2023/6/13
17
⑵ 选择适当的合成路线
例如:由甲苯制备对硝基苯甲酸。
比较这两个结构,反应步骤必须是先硝化,后侧链氧化。
1.取代反应
在萘环上,p电子的离域并不像苯环那样完全平均化,而是在α-碳原子上的电子 云密度较高,β-碳原子上次之,中间共用的两个碳原子上更小,因此亲电取代反应 一般发生在α位。
⑴ 卤化反应
在Fe或FeCl3存在下,将Cl2 通入萘的苯溶液中,主要得到α-氯萘。α-氯萘为无 色液体,沸点259 ℃,可做高沸点溶剂和增塑剂。
2023/6/13
6
苯分子去掉一个氢原子后的基团(C6H5―)叫做苯基,也可以用Ph―代 表。芳烃分子的芳环上去掉一个氢原子后的基团叫做芳基,可用Ar―代表。甲 苯分子中苯环上去掉一个氢原子后所得的基团CH3C6H5―称甲苯基;如果甲苯 的甲基上去掉一个氢原子,C6H5CH2―称苯甲基,又称苄基。
所以如果希望获得所需的产物,使用正确的反应步骤是重要的。
2023/6/13
18
第三节 稠环芳烃
一、 萘
萘,分子式C10H8,光亮的片状结构,熔点80.2 ℃,沸点218 ℃,有特殊气味,易 升华,不溶于水,易溶于乙醇、乙醚、苯等有机溶剂。其化学性质与苯相似。
2023/6/13
11
⑷ 傅-克(Friedel-Crafts)反应 ① 烷基化反应 凡在有机化合物分子中引入烷基的反应,称为烷基化反应。反
应中提供烷基的试剂叫烷基化剂,它可以是卤代烷、烯烃和醇。
当烷基化剂含有三个或三个以上直链碳原子时,产物发生碳链异构。
② 酰基化反应 凡在有机化合物分子中引入酰基(
①若原有两个取代基不是同一类的,则第三个取代基进入的位置一般受邻、对 位定位基的支配,因为邻、对位基反应的速率大于间位基。
②若原有两个取代基是同一类的,则第三个取代基进入的位置主要受强的定位基 的支配。
2023/6/13
17
⑵ 选择适当的合成路线
例如:由甲苯制备对硝基苯甲酸。
比较这两个结构,反应步骤必须是先硝化,后侧链氧化。
1.取代反应
在萘环上,p电子的离域并不像苯环那样完全平均化,而是在α-碳原子上的电子 云密度较高,β-碳原子上次之,中间共用的两个碳原子上更小,因此亲电取代反应 一般发生在α位。
⑴ 卤化反应
在Fe或FeCl3存在下,将Cl2 通入萘的苯溶液中,主要得到α-氯萘。α-氯萘为无 色液体,沸点259 ℃,可做高沸点溶剂和增塑剂。
2023/6/13
6
苯分子去掉一个氢原子后的基团(C6H5―)叫做苯基,也可以用Ph―代 表。芳烃分子的芳环上去掉一个氢原子后的基团叫做芳基,可用Ar―代表。甲 苯分子中苯环上去掉一个氢原子后所得的基团CH3C6H5―称甲苯基;如果甲苯 的甲基上去掉一个氢原子,C6H5CH2―称苯甲基,又称苄基。
有机化学第七章 芳烃
1
一、教学目的和要求 通过对本章的学习,掌握芳烃的定义、分类、苯的结构、 闭合共轭体系、芳香性及苯的同系物的命名,掌握苯环上 的亲电取代反应及定位规则,侧链卤代和氧化反应,掌握 萘的结构及命名,萘的亲电取代反应、氧化反应;熟悉休 克尔规则及非苯芳烃的芳香性判断;了解联苯、蒽、菲的 结构及命名以及苯及其同系物的主要物理性质(易燃性)。 二、教学重点内容 芳烃的结构、闭合共轭体系、命名、亲电取代反应及其定 位规律、侧链氧化、萘的结构、命名及亲电取代反应、非 苯芳烃芳香性的判断是本章的重点。
CH3 CH3 CH3
(1)单环芳烃
苯 甲苯 间二甲苯
(2)多环芳烃
连 苯 三
C H 苯 甲
烷
(3)稠环芳烃
萘 蒽 菲
4
5.1
芳烃的构造异构和命名
5.1.1 构造异构
苯及其同系物的通式为:CnH2n-6。 例如苯有六个碳和六个氢,其六个碳和六个氢是等同的; 结构异构: 一元取代:只有一种
CH3 CH CH2 H3C CH CH3
(a)
(b) (c) (d) (e)
卤化
硝化 磺化 Friedel-Crafts反应 氯甲基化
17
(1)亲电取代反应
(a) 卤化
苯环上和卤代反应较困难,常用FeX3(Lewis酸)作催化剂。
+ Cl2
FeCl3,25oC 90%
Cl + HCl
控制苯过量,不要太激烈,避免二卤代。 因是亲电反应,所以苯的同系物(甲苯)比苯更易反应。 Cl 卤代活性: F2>Cl2>Br2>ICH CH3 CH3 CH3 2。 3
14
5.3
单环芳烃的物理性质
第七章芳香烃
7.1.2 按苯环数目和结合方式分类
按苯环数目分类:单环芳烃、 多环芳烃 、非苯芳烃
CH(CH3)2
CH3
苯
间甲基异丙苯
萘
菲
蒽
芘
苯并芘 (强效致癌物质)
3
联苯 三苯基甲烷
反-二苯乙烯
[18]-轮烯 富勒烯 (非苯芳烃)
4
7.2 苯的结构 7.2.1 苯的结构研究历史
1825年,Faraday从路灯照明燃气凝结液中 分离出来,测定实验式CH。 1833年,确定分子式C6H6,有下列反应。
OCH3 CH3
主要产物
COOH NO2
主要产物
CH3 CI
混合物
36
(3)苯环上原有两个取代基对引入第三个取代基的定 位作用不一致,两个取代基属不同类定位基时,这时 第三个取代基进入苯环的位置主要由第一类定位基定 位:
NHCOCH3 COOH O2N CH3
在考虑第三个取代基进入苯环的位置时,除考虑 原有两个取代基的定位作用外,还应该考虑空间位 阻,如 3-乙酰氨基苯甲酸的 2 位取代产物很少。
Ⅰa
CH3
+
H E
+
CH3
Ⅰc
Ⅰb
+
H E
CH3
CH3 或 H E
+
进攻对位:
CH3
+
CH3 H E
Ⅱc
+
H E
Ⅱ
H E
Ⅱb
Ⅱa
CH3
CH3
+
CH3
+
进攻间位:
+ H或 E
CH3 H +E
Ⅲc
H
E
07第7章_芳烃
+
R
C X
注意:
每类反应的特点; 比较苯、甲苯和硝基苯的反应活性; 反应机理。
总目录
1. 硝化反应
注意1:反应 温度、试剂浓 度的差别!
注意2: 引入取代基的位置!
总目录
两个取代基定位作用一致
两个取代基定位作用不一 致,致活基团起主导作用
总目录
思考
(1)浓硫酸起什么作用? (2) 从反应条件(试剂浓度、反应温度),看几种 单环芳烃的硝化活性。
6个Csp2— Csp2键 6个C—H键
Csp2杂化(垂直的p 轨道未画出)
总目录
(2)6个p 轨道平行重叠形成大π键
碳原子的p轨道
苯分子的大π 键
总目录
苯环所有键示意图
总目录
2. 分子轨道理论解释
(1)苯的骨架结构(同上) (2)6个p 原子轨道线性组合成6个分子轨道:
反键轨道 原子轨道 成键轨道
第四节 苯环的亲电取代定 位效应 一、定位效应 二、定位效应的解释 三、定位效应的应用 第五节 多环芳烃 一、联苯 二、稠环芳烃 第六节 非苯系芳烃 一、芳香性的几个特征 二、休克尔规则 三、非苯芳烃 四、大环芳烃 第七节 富勒烯与C60
ห้องสมุดไป่ตู้
总目录
脂肪烃
aliphatics
烃
芳香烃
aromatic hydrocarbons
+
总目录
(2)反应机理—— 亲电加成-消除反应历程
σ 络合物 (该中间体亲电取代都经历) 亲电加成 消除
说明σ 配合物的生成决速步骤
总目录
σ 配合物: 碳原子杂化态从sp2转化为sp3,大π
键被破坏,4个π电子离域于环上5 个碳原子上,使苯环呈正电荷。
第七章 芳烃
甲、卤化 乙、硝化 丁、Friedel-Crafts 反应 丙、磺化
甲、卤化反应
Cl2
FeCl3 25 0 C
Cl 90%
芳烃与卤素作用生成卤代芳烃
a.催化剂:FeCl3 、FeBr3 、AlCl3等 b.卤素活性:F>Cl>Br>I c.芳烃活性:烷基苯>苯>卤代苯
卤化反应机理
Br Br FeBr3
0
NO2 75-85%
硝化反应机理
O2N OH
+ O2N OH2
HOSO3H
HOSO3H
+ O2N OH2
OSO3H
O2N
H3O+
NO2
OSO3H
O2N
H NO2
+
slow
H
NO2
OSO3H fast
HOSO3H
丙、磺化反应
芳烃与浓H2SO4作用,芳环上H原子被磺(酸)基 -SO3H取代生成芳磺酸 a. 磺化剂: 浓H2SO4 或 发烟H2SO4 b. 底物活性:烷基苯>苯>苯磺酸
CH3CH2Br
AlCl3, 850C
CH2CH3
74%
c. 常用酰基化剂:酰卤、酸酐(酸)
(CH3CO)2O
AlCl3, 40 C CS2
0
O CCH3
90%
d. 芳环上不能连有强吸电基(-NO2、-CN、-COR、-SO2R)
e. 烷基化对吸电基更敏感
烷基化和酰基化机理
CH3CH2CH2Cl
AlCl3
HOOC
C(CH3)3
思考题:如果另一反应物为NBS,产物是什么?
六、苯环上取代反应定位规则
当苯环上有一个以上取代基时,将面临两个重要的问题: ※取代基对苯环上的亲电反应速率有何影响? ※取代基对苯环上的亲电反应有何定位效应?
甲、卤化反应
Cl2
FeCl3 25 0 C
Cl 90%
芳烃与卤素作用生成卤代芳烃
a.催化剂:FeCl3 、FeBr3 、AlCl3等 b.卤素活性:F>Cl>Br>I c.芳烃活性:烷基苯>苯>卤代苯
卤化反应机理
Br Br FeBr3
0
NO2 75-85%
硝化反应机理
O2N OH
+ O2N OH2
HOSO3H
HOSO3H
+ O2N OH2
OSO3H
O2N
H3O+
NO2
OSO3H
O2N
H NO2
+
slow
H
NO2
OSO3H fast
HOSO3H
丙、磺化反应
芳烃与浓H2SO4作用,芳环上H原子被磺(酸)基 -SO3H取代生成芳磺酸 a. 磺化剂: 浓H2SO4 或 发烟H2SO4 b. 底物活性:烷基苯>苯>苯磺酸
CH3CH2Br
AlCl3, 850C
CH2CH3
74%
c. 常用酰基化剂:酰卤、酸酐(酸)
(CH3CO)2O
AlCl3, 40 C CS2
0
O CCH3
90%
d. 芳环上不能连有强吸电基(-NO2、-CN、-COR、-SO2R)
e. 烷基化对吸电基更敏感
烷基化和酰基化机理
CH3CH2CH2Cl
AlCl3
HOOC
C(CH3)3
思考题:如果另一反应物为NBS,产物是什么?
六、苯环上取代反应定位规则
当苯环上有一个以上取代基时,将面临两个重要的问题: ※取代基对苯环上的亲电反应速率有何影响? ※取代基对苯环上的亲电反应有何定位效应?
